实验54 四碘化锡的制备
实验目的
掌握在非水溶剂中制备四碘化锡的原理和操作方法;掌握非水溶剂的重结晶方法。
实验原理
无水四碘化锡是橙红色、共价型立方晶体,密度4.50g·cm-3(299K),熔点416.5K,沸点621K,约453K开始升华。受潮易水解,易溶于四氯化碳、三氯甲烷、二硫化碳、乙醚、苯等有机溶剂,在石油醚和冰醋酸中溶解度较小。
本实验采用在非水溶剂中直接合成法制备无水四碘化锡。金属锡和碘在非水溶剂冰醋酸和醋酸酐体系中直接合成:
![]()
用冰醋酸和醋酸酐作溶剂比用二硫化碳、四氯化碳、氯仿、苯等非水溶剂的毒性要小,产物不会水解,可以得到较纯的晶状产品。
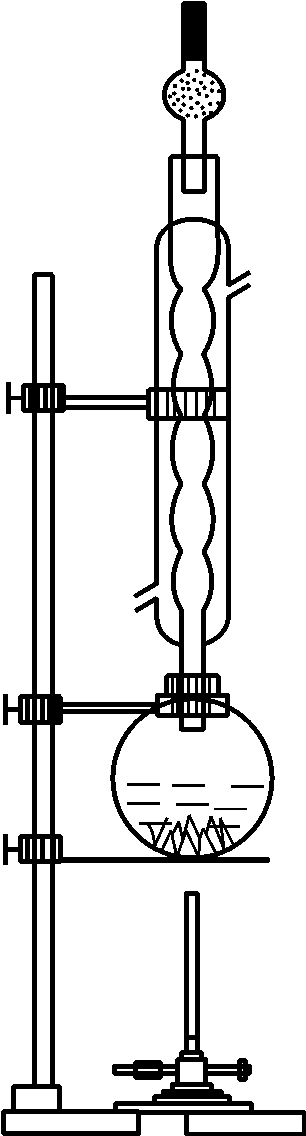
图5-2 制备四碘化锡的装置
实验用品
仪器 托盘天平;圆底烧瓶(100~150mL);冷凝管;干燥管;抽滤瓶;滤纸;烧杯。
试剂 锡片(或锡箔);碘;无水氯化钙;冰醋酸;醋酸酐;氯仿。
实验步骤
1.无水四碘化锡的制备
称取0.5g剪碎的锡片和2.2g碘置于洁净干燥的100~150mL圆底烧瓶中,再向其中加入25mL冰醋酸和25mL醋酸酐,加入少量沸石,以防暴沸。装好冷凝管和干燥管(见图5-2),用水冷却回流加热,保持回流状态1~1.5h。当紫红色碘蒸气消失,溶液颜色由紫红变为深橙红色时,停止加热,冷却至室温,可见到橙红色针状四碘化锡晶体析出,迅速抽滤。将晶体放在小烧杯中,加20~30mL氯仿,用小火水浴温热溶解后迅速抽滤,除去杂质(是什么杂质?)。滤液倒入蒸发皿中,在通风橱内不断搅拌滤液,促使溶剂挥发,待氯仿全部挥发后便可得到橙红色晶体(必要时可重复操作),最后称重,计算产率。
2.性质检验
(1)取少量四碘化锡固体于试管中,再向试管中加入少量蒸馏水,观察现象,写出反应式,其溶液及沉淀留作下面实验用。
(2)取四碘化锡水解后的溶液,分别盛于两支试管中,一支滴加AgNO3溶液,另一支滴加Pb(NO3)2溶液,观察现象,写出反应式。
(3)取实验(1)中沉淀,分别盛于两支试管中,分别滴加稀酸、稀碱,观察现象,写出反应式。
思考题
(1)本实验在操作中应注意什么问题?
(2)若制备反应完毕,锡已经完全反应,但体系中还有少量碘,用什么方法除去?
(3)在合成四碘化锡时,以何种原料过量为好?为什么?
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














