Ⅱ 硫酸铜中铜含量的测定
实验步骤
1.0.1mol·L-1 Na2S2O3溶液的配制
用台秤称取10g Na2S2O3·5H2O溶于刚煮沸并冷却后的400mL蒸馏水中,加入约0.1g Na2CO3,保存于棕色瓶中,塞好塞子,于暗处放置一周后标定。
2.0.1mol·L-1 Na2S2O3 溶液的标定
准确称取已烘干的K2Cr2O7(分析纯)0.13~0.15g于250mL锥形瓶中,加入10~20mL水溶解,再加入20mL 10%KI溶液(或2g固体KI)和6mol·L-1 HCl溶液5mL,混匀后用表面皿盖好,放在暗处5min然后用50mL水稀释,用待标定的Na2S2O3溶液滴定至溶液呈浅黄绿色,加入1.0mL 1%的淀粉溶液,继续滴定至蓝色变为亮绿色即为终点。记下消耗Na2S2O3溶液的体积,计算Na2S2O3标准溶液的浓度。平行滴定三次。
3.铜盐中铜含量的测定
精确称取CuSO4·5H2O试样0.25~0.3g于250mL锥形瓶中,加1mol·L-1 H2SO4溶液3mL和水30mL,溶解。加入10%KI溶液7~9mL,立即用Na2S2O3标准溶液滴定至呈浅黄色。然后加入1%淀粉溶液1mL,继续滴定到呈浅蓝色。再加入5mL 10%KSCN(可否用NH4SCN代替?)溶液,摇匀后溶液由蓝色转深,再继续滴定到蓝色恰好消失,此时溶液为米色CuSCN悬浮液。由实验结果计算硫酸铜中的含铜量。平行测定三次。
注意事项
(1)K2Cr2O7和KI的反应不是立刻完成的,在稀溶液中反应更慢,因此应等反应完成后再加水稀释。在上述条件下,大约经5min反应即可完成。
(2)Na2S2O3溶液进行标定时,生成的Cr3+使溶液显蓝绿色,妨碍终点观察,滴定前预先稀释,可使Cr3+浓度降低,蓝绿色变浅,终点时溶液由蓝色变到绿色,容易观察。同时稀释也使溶液的酸度降低,适于用Na2S2O3溶液滴定I2。
(3)本实验只能用于不含干扰性物质的试样测定。
思考题
(1)硫酸铜易溶于水,为什么溶解要加硫酸?
(2)用碘法测定铜含量时,为什么要加入KSCN溶液?如果在酸化后立即加入KSCN溶液,会产生什么影响?
(3)已知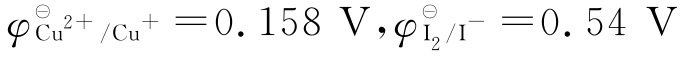 ,为什么在本法中Cu2+却能使I-氧化为I2?
,为什么在本法中Cu2+却能使I-氧化为I2?
(4)测定反应为什么一定要在弱酸性溶液中进行?
(5)如果分析矿石或合金中的铜,其试液中含有干扰性杂质,如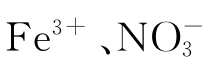 等离子,应如何消除它们的干扰?
等离子,应如何消除它们的干扰?
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















