实验89 燃烧热的测定
实验目的
通过萘燃烧热的测定,掌握氧弹式量热计的工作原理、结构和使用方法;掌握燃烧热的测定技术;学会使用贝克曼温度计;学会应用图解法校正温度改变值。
实验原理
燃烧热是指1mol物质完全燃烧时所放出的热量。在恒容条件下测得的燃烧热为恒容燃烧热(QV),在恒压条件下测得的燃烧热为恒压燃烧热(Qp)。
燃烧热可以通过热力学中的基本实验方法———量热法来测定,测量化学反应热的仪器称为量热计。量热计的种类很多,本实验采用氧弹式量热计(结构见图6-3、图6-4)测量萘的燃烧热。
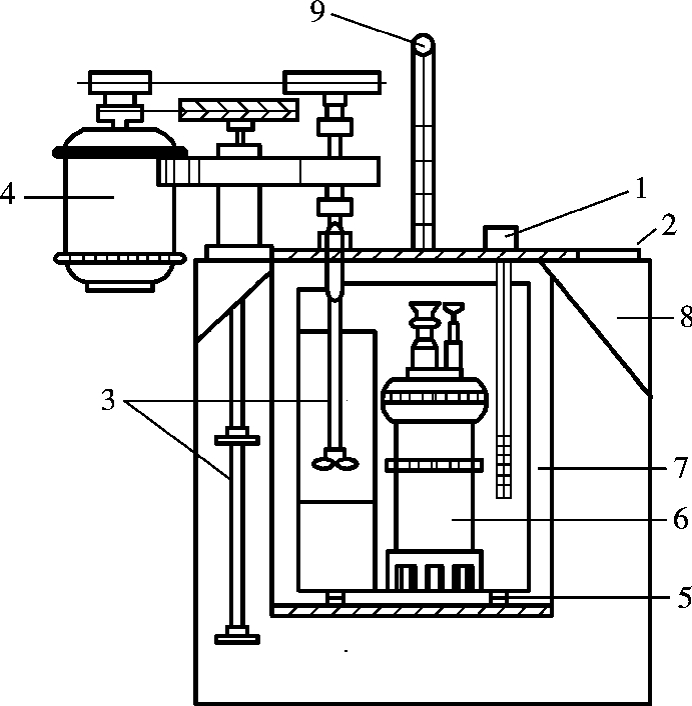
图6-3 氧弹式量热计装置
1—测温探头;2—氧弹盖;3—搅拌器;4—搅拌马达;5—衬垫;6—氧弹;7—内桶;8—外壳;9—温度计

图6-4 氧弹剖面图
1—充气阀(兼作电极之一);2—电极;3—排气孔;4—氧弹盖;5—螺帽;6—垫圈;7—厚壁圆筒;8—燃烧皿;9—样品;10—点火线;11—火焰遮板;12—电极(同时也是进气管)
氧弹式量热计属于恒容式恒温夹套式量热计,测量时将一定量待测物质放在充有高压氧气的氧弹中,使其完全燃烧,燃烧时放出的热量使氧弹本身及周围介质(本实验用水)和量热计有关的附件温度升高。通过测定燃烧前后氧弹周围介质温度的变化值,根据量热计的热容CV,就可以求算出该样品的恒容燃烧热。在恒容、无其他功时,有
![]()
一般燃烧热是指恒压燃烧热,在恒压、无其他功时,有
![]()
若把参加反应的气体和反应生成的气体看作理想气体,则有下列关系式:
![]()
氧弹式量热计的热容CV含吸热介质(水)和仪器的热容两项(量热计常数,用WN表示,即量热计本身温度升高1℃需要的热量),不同仪器的热容各不相同,必须事先测定。测定方法是用已知燃烧热的物质作为标准物质,将一定量的标准物质放在高压氧弹中燃烧,测出量热计温度的改变值,从而求出仪器的热容。
本实验成功的关键是样品必须完全燃烧,其次,还必须使燃烧后放出的热量尽可能全部传递给量热计本身和其中盛放的水,而不与周围环境发生热交换。由于热量的散失无法完全避免,因此燃烧前、后温度的变化值不能直接、准确测量,而必须经过作图法进行校正,校正的方法如下。
将燃烧前后历次观测到的水温记录下来,并作温度-时间曲线,连成abcd线(见图6-5)。图中b点相当于开始燃烧之点,c点为观测到的最高温度读数点,由于量热计和外界存在热交换,曲线ab及cd常发生倾斜。取b点所对应的温度T1,c点对应的温度T2,其平均温度(T1+T2)/2为T,经过T点作横坐标的平行线TC,与折线abcd交于C点,然后过C点作垂直线AB,此线与ab和cd的延长线交于E、F两点,则E点和F点所表示的温差即为欲求温度的升高值ΔT。如图6-5所示,EE′表示环境辐射进来的热量所造成量热计温度的升高,这部分是必须扣除的,而FF′表示量热计向环境辐射出去的热量而造成量热计温度的降低,因此这部分是必须加入的。经过这样校正后的温差表示了由于样品燃烧使量热计温度升高的数值。有时量热计绝热良好,热量散失少,而搅拌器的功率又比较大,这样往往不断引进少量热量,使得燃烧后的温度最高点不明显出现,这种情况下仍然可以按照同法进行校正(见图6-6)。
实验用品
仪器 氧弹式量热计;压片机;温度计(0~100℃);温差测量仪;万用表;氧气钢瓶;点火丝;天平;容量瓶等。
试剂 萘;苯甲酸;NaOH标准溶液(0.1mol·L-1左右);酚酞指示剂等。
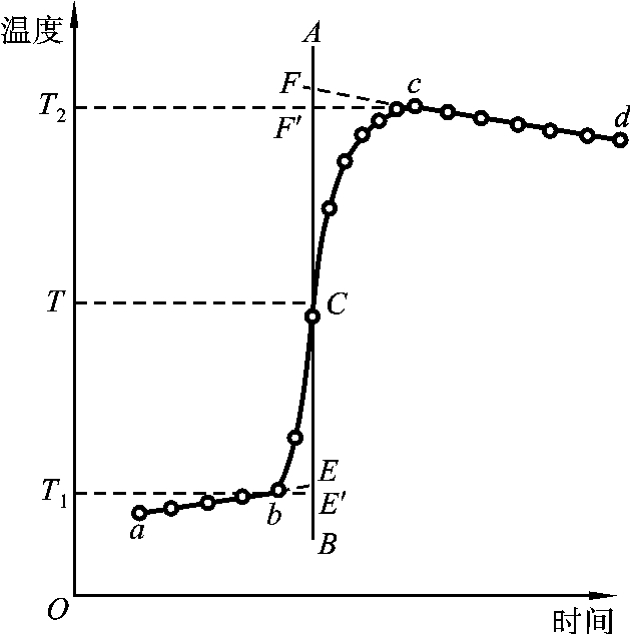
图6-5 绝热较差时的温度校正图
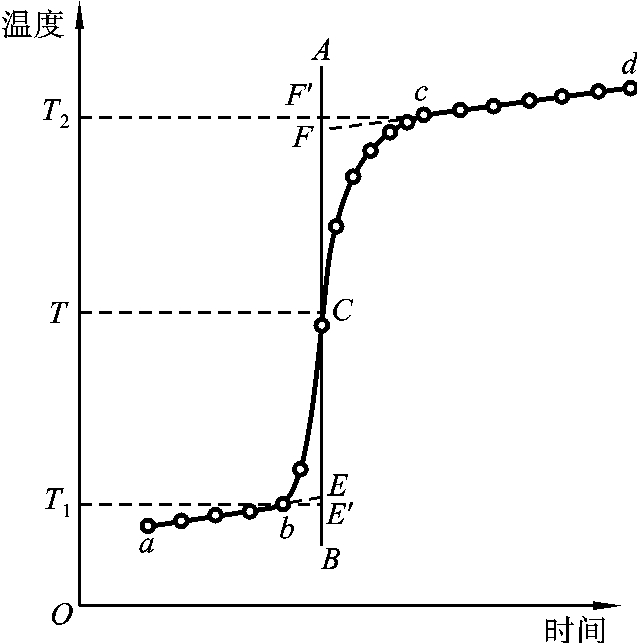
图6-6 绝热良好时的温度校正图
实验步骤
1.量热计常数测定
(1)样品压片:先将压片机中的钢模擦净,将约15cm点火丝准确称量后,记录质量m0。称取约0.6g苯甲酸,将点火丝适当弯曲后置于钢模中,放入苯甲酸粉末,调整压片机的螺杆,将样品压成片状。将模底的托盘翻过来,再继续向下压,使样品脱落下来(也可以将燃烧皿准确称重,直接将样品放入燃烧皿的底部,用玻璃瓶塞将样品压实、压平后再准确称取燃烧皿体系的质量,计算出样品的质量)。准确称取压片样品和点火丝的总质量后,计算出苯甲酸压片的实际质量,并记录为m苯甲酸。将其放入燃烧皿中,并将点火丝的两端分别连接在氧弹内的两个电极上,样品压片悬空在燃烧皿的上方,注意点火丝与压片不要触及燃烧皿,用万用电表检查氧弹两电极是否通路。
(2)充氧:将氧弹内壁擦干净,在氧弹中加入1mL水,旋紧氧弹盖及放气孔的螺丝,按图6-7将氧弹接上氧气钢瓶。打开氧气钢瓶上的阀门1,待氧气钢瓶内压力指示表2(指示钢瓶内氧气的压力)的指针指示的压力恒定,然后缓缓旋紧氧气表上的减压阀门8(旋紧即为打开),氧气通过表3和导气管4进入氧弹中。注意表3的压力指针应在1.5MPa附近,切不可超过3MPa。充氧时间不少于30s,然后按逆时针方向旋松减压阀门调节螺杆8,再关总阀门1,拆下导气管4,放掉氧气表3中的余气。将氧弹进气螺栓旋上,再次用万用电表检查两电极是否为通路。
(3)燃烧和测量温度:将氧弹放入量热计的盛水桶内,用容量瓶准确量取自来水2000mL,倒入盛水桶内,然后接上点火电极插头,面板上点火指示灯应微亮,否则表示点火线未接通。盖好盖子,插入温度传感器,在操作数显温度计处理器上按下“电源”开关,开机;按“复位”键将计时清零;按“时间”键,将计时间隔调在1min;按下“搅拌”键。观察温度计,当体系的温度较稳定后,每隔1min读取温度1次。这样继续10min,迅速按下“点火”键,自按下“点火”键后,读数的时间间隔改为每30s一次,继续记录10min。
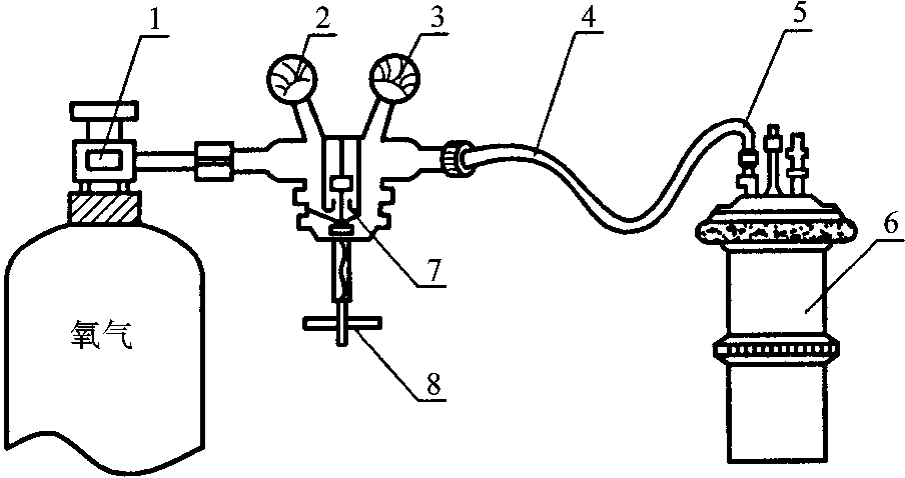
图6-7 氧弹充气示意图
1—氧气钢瓶总阀;2—氧气钢瓶内压力指示表;3—减压阀出口压力指示表;4—导气管;5—氧弹充气孔;6—减压阀;8—减压阀门调节螺杆
(4)实验停止后,取出氧弹,放出余气。最后旋开氧弹盖,检查样品燃烧情况。若氧弹中没有未燃尽的剩余物,表示燃烧完全,反之,则表示燃烧不完全,实验失败。取出燃烧后剩下的点火丝,称重,记录为m1。参与燃烧放热的点火丝质量记为m点火丝(m点火丝=m0-m1)。
为了在测得的总燃烧热中扣除氧弹中的水与空气中的O2、N2作用生成HNO3溶液的热量,必须用蒸馏水(每次10mL)洗涤氧弹及内件3~4次,洗涤液收集在250mL锥形瓶中。煮沸5min,加入2滴酚酞指示剂,用NaOH标准溶液滴定至粉红色,得到消耗碱液的体积VNaOH。
2.萘的燃烧热测定
称取0.5g左右萘,按上法进行压片、燃烧等实验操作。
实验完备后,洗净氧弹,倒出量热计盛水桶中的自来水,并擦干待下次实验用。
实验结果与数据处理
(1)按作图法求出苯甲酸及萘燃烧时体系温度的变化值(ΔT)。
(2)用下面的公式计算量热计常数WN。
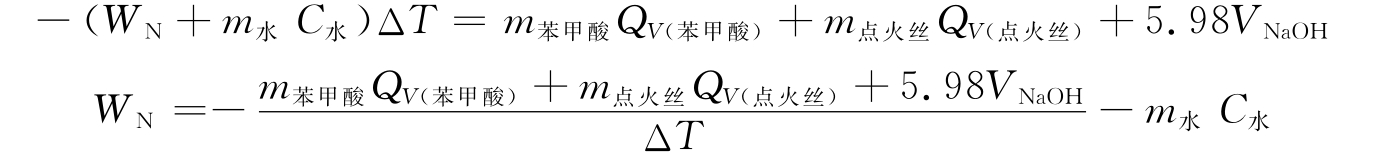
式中:m为物质的质量;QV(苯甲酸)为-26480.5J·g-1;QV(点火丝)为-6694J·g-1;VNaOH为滴定消耗NaOH溶液的体积,mL;ΔT为体系的温度变化,由作图法求得;5.98为酸形成的校正值。
(3)根据QV与Qp的关系式,求Qp;由物化手册查出萘的恒压燃烧热Qp,计算实验误差。
思考题
(1)在本实验装置中哪些是体系?哪些是环境?体系和环境通过哪些途径进行热交换?
(2)简述装配氧弹和拆开氧弹的操作过程。
(3)为什么实验测量得到的温差值要经过作图法校正?
(4)使用氧气钢瓶和减压阀时有哪些注意事项?
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















