实验100 甲基红的酸电解平衡常数的测定———分光光度法
实验目的
通过测定甲基红的酸电解平衡常数,进一步掌握分光光度计和酸度计的正确使用方法。
实验原理
前面介绍了用pH法、电导率法、滴定曲线法测定醋酸的电离平衡常数,本实验将介绍用分光光度法测定弱电解质的电离平衡常数。
甲基红是一种弱酸型染料指示剂,具有酸(HMR)和碱(MR-)两种形式,它在溶液中部分电离,简单地写成:
![]()
用浓度表示的电离平衡常数:
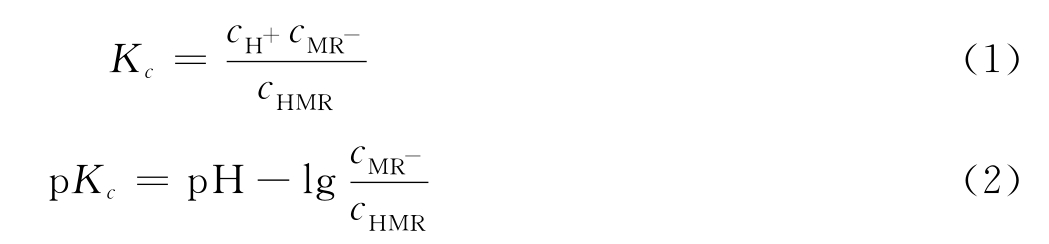
因此,对于一定温度下已达平衡的甲基红溶液,只需测出其pH值和cMR-/cHMR,即可求得电离平衡常数。
测定体系的组成常用分光光度法,对一化学反应平衡体系,分光光度计测得的吸光度包括各物质的贡献,根据朗伯-比耳定律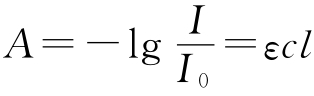 ,由此可推知甲基红溶液在最大吸收波长λ1、λ2处的总吸光度分别为
,由此可推知甲基红溶液在最大吸收波长λ1、λ2处的总吸光度分别为
![]()
式中:A1、A2分别为HMR和MR-的最大吸收波长处所测得的总的吸光度;εi,j分别为HMR和MR-在最大吸收波长λ1、λ2下的摩尔吸光系数,它们可由作图法求得,即配制甲基红以纯酸式存在时的溶液,在波长λ1下分别测定各溶液的吸光度,对A1-cHMR作图,得一直线,由直线斜率可求得ε1,HMR,其余各摩尔吸光系数的求法类同。由式(3)、式(4)求得cMR-与cHMR的比值为
![]()
再测得溶液pH值,根据式(2)求出pKc。
实验用品
仪器 分光光度计;酸度计;容量瓶等。
试剂 甲基红标准溶液(3×10-4 mol·L-1);缓冲溶液(pH=6.86,pH=4.00);NaAc(0.04mol·L-1);HCl(0.1mol·L-1);HAc(0.02mol·L-1)等。
实验步骤
1.测定甲基红酸式和碱式的最大吸收波长
取10mL甲基红标准溶液,加10mL 0.1mol·L-1 HCl溶液,稀释至100mL,此溶液甲基红完全以HMR形式存在,测其在460~590nm之间每隔10nm相对于水的吸光度,找出最大吸收波长λ1。
取10mL甲基红标准溶液,加25mL 0.04mol·L-1 NaAc溶液,稀释至100 mL,此溶液甲基红完全以MR-形式存在,测其在380~520nm之间每隔10nm相对于水的吸光度,找出最大吸收波长λ2。
2.摩尔吸光系数的测求
分别吸取甲基红标准溶液10mL、8mL、6mL、4mL、2mL,各置于100mL容量瓶中,再各加入10mL 0.1mol·L-1 HCl溶液,稀释至刻度,在波长λ1、l=1cm和λ2、l=3cm下测定各溶液相对于水的吸光度,作图求ε1,HMR、ε2,HMR。
分别吸取甲基红标准溶液10mL、8mL、6mL、4mL、2mL,各置于100mL容量瓶中,再各加入25mL 0.04mol·L-1 NaAc溶液,稀释至刻度,在波长λ1、l=3cm和λ2、l=1cm下测定各溶液相对于水的吸光度,作图求ε1,MR-、ε2,MR-。
3.求不同pH值下cHMR 和cMR-的比值
在5支100mL容量瓶中分别加入25mL 0.04mol·L-1 NaAc溶液和甲基红标准溶液10mL,再分别加入0.02mol·L-1 HAc溶液50mL、35mL、25mL、10mL、5 mL,稀释至刻度,测定各溶液在λ1、l=1cm和λ2、l=1cm下的吸光度A1、A2,用pH计测得各溶液的pH值。
实验结果与数据处理
(1)分别对A1-λ,A2-λ作图,求出最大吸收波长λ1、λ2。
(2)作λ1处的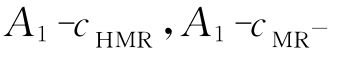 直线图以及λ2处的
直线图以及λ2处的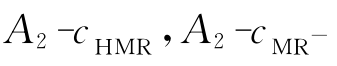 直线图,求得各直线的斜率k。再由A=εcl求出摩尔吸光系数
直线图,求得各直线的斜率k。再由A=εcl求出摩尔吸光系数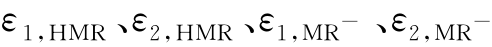 。
。
(3)由式(5)求得不同pH值下的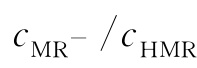 ,再由式(2)计算电离平衡常数,并取平均值。
,再由式(2)计算电离平衡常数,并取平均值。
思考题
(1)本实验中,温度对测定结果有何影响?采取哪些措施可以减少由此而引起的实验误差?
(2)甲基红酸式吸收曲线和碱式吸收曲线的交点称之为“等色点”,讨论等色点处的吸光度和甲基红浓度的关系。
(3)为什么要用相对浓度?为什么可以用相对浓度?
(4)在吸光度测定中,应该怎样选用比色皿?
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















