实验105 氢阴极析出极化曲线的测定
实验目的
通过在1mol·L-1的NaOH溶液中氢在阴极析出极化曲线的测定,掌握测量极化曲线的基本方法;了解过电位、极化电极电位等概念和基本测量方法;了解影响氢过电位和氢阴极析出速度的主要因素。
实验原理
许多电化学过程都是不可逆电极过程,电解过程中的阴极和阳极反应也是如此。这些电极过程都是在远离平衡的条件下进行的,而电极反应离开了原来的平衡态就称为电极极化。电极极化是由于电流(净电流)超过了该反应的交换电流而引起的,它的主要特征是电极电位离开了原有的平衡值,电极电位偏离平衡值的大小作为电极极化的量度,并称之为过电位η,且定义阳极极化过电位ηA=φ-φP,阴极极化过电位ηK=φP-φ(φP为平衡电位,φ为电位),以使ηA和ηK均为正值。研究发现,η或φ是电流密度i的函数,称为Tafel关系,大都满足下列两个Tafel方程:
![]()
φ-lgi曲线称为电极反应极化曲线,如图6-24所示。极化曲线在电化学动力学、化学电源、电镀、电抛光、金属腐蚀、电化学合成、电催化和光电催化等领域的研究中都有重要的意义。

图6-24 极化曲线示意
由于电极反应是在金属/溶液界面进行的,当溶液中存在一些杂质时,由于它们在电极上吸附或电沉积,将会改变电极表面的性质,从而影响到电极界面所进行的电极过程的速度,使极化曲线的测量产生误差。因此在测量时,必须注意溶液的纯度和电极表面的处理,使电极表面尽可能保持清洁,表面状态比较一致。测量极化曲线有两种方法:控制电流法和控制电位法。本实验采用控制电流法,即逐步改变回路中的电流大小,测量电极电位的变化情况。
极化曲线的测量通常采用三电极的电解池,除阳极和阴极外,还有一个电极电位固定不变的参比电极,以测量待研究电极的电极电位。实验装置和电路示意图如图6-25、图6-26所示。
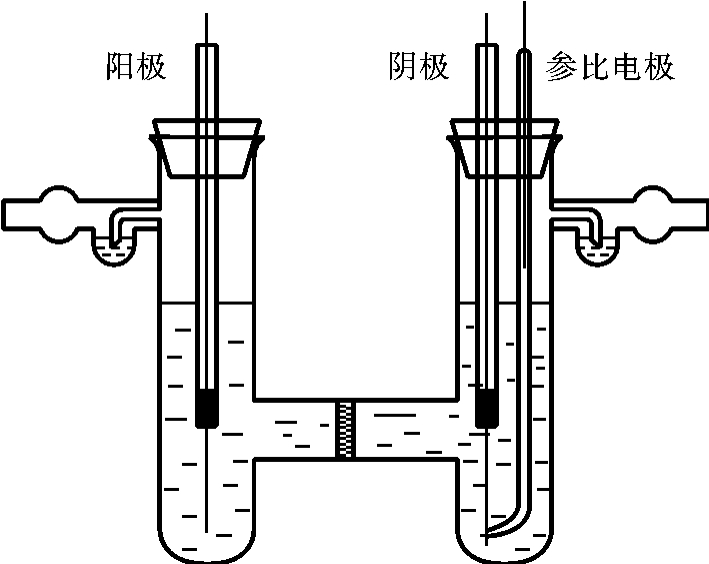
图6-25 电解池示意
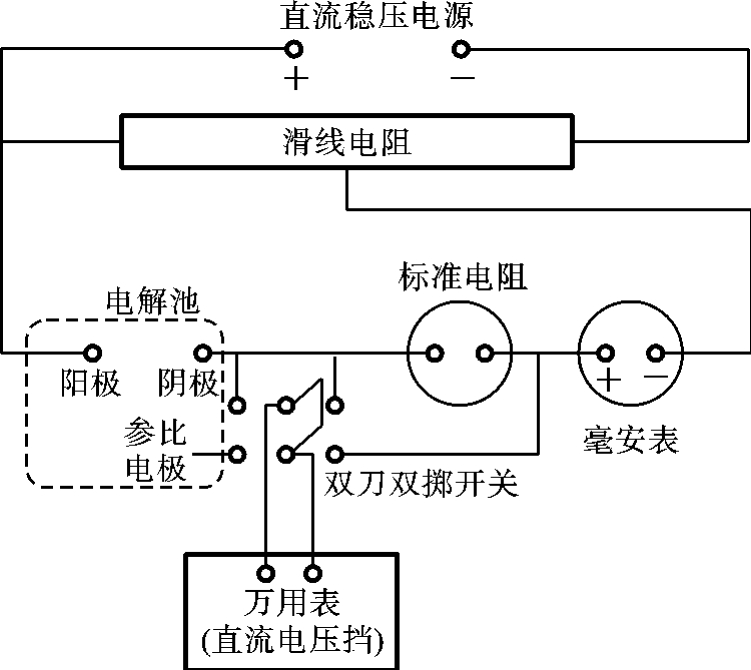
图6-26 测量线路示意图
本实验阳极和阴极均采用铁电极,参比电极为饱和甘汞电极,电解质溶液为1mol·L-1的NaOH溶液。电极反应为
阳极:4OH-═══O2↑+2H2O+4e-
阴极:2H3O++2e-═══H2↑+2H2O
为研究氢在阴极析出的极化曲线,应该用磨砂隔板将阳极室和阴极室隔开,以避免阳极析出的O2随溶液扩散至阴极还原。为避免电极表面吸附的O2和溶液中溶解的O2干扰,应该在实验前,进行较长时间的预极化,使电极获得稳定的表面状态。测量时,从大电流开始向小电流逐点测量。
实验用品
仪器 稳压电源;滑线电阻(200~500Ω,1A);可变电阻箱[(0.01~1.00)×106Ω];标准电阻(10kΩ);毫安电流表;万用表;电解池等。
试剂 氢氧化钠(分析纯)等。
实验步骤
检查电解池中电解质溶液及参比电极中饱和KCl溶液,如液面太低则补足。按测量电路示意图连接线路。检查无误后,以100mA电流进行预极化1h。测量φlgi曲线时,用万用表的直流电压测量挡测量一定电流下阴极与参比电极的电位差φ(单位:V,vs SCE)。电流(I)由大到小,顺序如下(单位为mA):100、50、20、10、5、2、1、0.5、0.2、0.1、0.05、0.02、0.01、0.005、0.002。测至2mA及以下电流时,由于毫安电流表已不能准确测量电流大小,可通过用滑线电阻和可变电阻箱调节10kΩ标准电阻两端的电位差来确定电流的大小。
在测量过程中应注意电流不要中断和变为负值。测量完毕后记下所用阴极的电极面积(S)、室温和大气压,整理好实验仪器。
实验结果与数据处理
(1)根据阴极面积(S)计算出电流密度(i=I/S,单位:A·cm-2)和lgi,与相应的阴极电位φ数据列表。
(2)作φ-lgi图,并从图上找出低极化区和高极化区两个Tafel线,并分别求出低极化区和高极化区两个Tafel方程的常数a1、b1、a2、b2。
思考题
(1)如何将所测得的相对于饱和甘汞电极(SCE)的电极电位换算至相对于标准氢电极的电极电位?
(2)测量氢阴极析出极化曲线为什么要进行较长时间的预极化?
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















