实验13 硫代硫酸钠标准溶液的配制和标定
实验目的
(1)掌握间接碘量法的测定原理;
(2)掌握硫代硫酸钠标准溶液的配制、保存和标定方法;
(3)熟悉应用淀粉指示剂准确地判断滴定终点。
实验原理
结晶的Na2S2O3·5H2O一般均含有少量S、Na2SO3、Na2SO4、Na2CO3及NaCl等杂质,同时还容易风化和潮解,需采用间接法配制。
Na2S2O3溶液易受空气中的O2、溶解在水中的CO2、微生物和光照等作用而分解。它在微碱性介质中较稳定。配制溶液时,为了减少溶解在水中的CO2和杀死水中的微生物,应用新煮沸的冷蒸馏水配溶液,并加入少量Na2CO3,其浓度约为0.02%,维持溶液的微碱性,以防止Na2S2O3的分解。日光能促使Na2S2O3溶液分解,所以Na2S2O3溶液应贮于棕色瓶中,放置暗处,经8~14天后再标定。长期保存的溶液,应每隔一定时期重新标定。如果发现溶液变浑(表示有硫析出)时,就应该过滤后再标定,或者重新另配溶液。若保存得好,可两个月标定一次。
标定Na2S2O3溶液,常选用强氧化剂如KIO3、KBrO3或K2Cr2O7等作基准物,这些物质均能与I-反应析出定量的I2,反应为
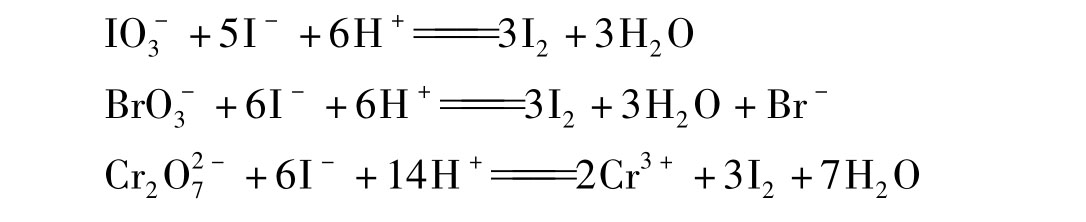
用Na2S2O3溶液滴定析出的I2,反应为
![]()
以淀粉为指示剂,蓝色消失即为终点。
仪器与药品
仪器:分析天平、台秤、酸式滴定管、锥形瓶、移液管、容量瓶、烧杯。
药品:固体Na2S2O3·5H2O(AR)、固体Na2CO3(AR)、K2Cr2O7基准物质、固体KI(AR)、6mol·L-1HCl、0.5%淀粉溶液。(淀粉溶液的制备方法:称取可溶性淀粉0.5g,加入少量水搅拌成悬浮状,然后在搅拌下将此悬浮液逐滴加到100mL沸水中,继续煮沸1~2min至溶液透明为止,冷却后使用。淀粉溶液易腐败,可加入少量的防腐剂,如HgI2、ZnCl2等。)
实验步骤
1.0.1mol·L-1Na2S2O3溶液的配制
在台秤上称取6.5gNa2S2O3·5H2O(s),溶于250mL新煮沸的冷蒸馏水中,加入约0.1g(米粒大小)Na2CO3①,摇匀后保存于棕色瓶中,在暗处放置7~14天后进行标定。
2.0.1mol·L-1Na2S2O3溶液的标定
准确称取0.12~0.15gK2Cr2O7基准物,置于250mL锥形瓶中②,加水25mL使之溶解,再加入1.8g固体KI和6mol·L-1HCl5mL,盖上表面皿,在暗处放置5min③。加入100mL水④,立即用0.1mol·L-1Na2S2O3溶液滴定到呈浅黄绿色。加入0.5%淀粉溶液5mL⑤,并用尽量少的蒸馏水冲洗内壁(为什么?)后,继续滴定至蓝色恰好变为绿色,即为终点⑥。
平行测定3次,计算Na2S2O3溶液的准确浓度。
注释
①空气中的CO2溶解于溶液中,可促使Na2S2O3分解,即
![]()
这一分解作用一般在配制成溶液最初几天内进行。加入Na2CO3后,生成的NaHCO3使Na2S2O3分解受到抑制。
②因I2容易挥发损失,在碘量法实验中,最好使用碘量瓶。
③K2Cr2O7与KI的反应需在足够浓度、适当的酸度和一定的反应时间条件下才能进行得较完全。过量的KI与K2Cr2O7在上述条件下大约5min才能完成反应。
④生成的Cr3+呈蓝绿色,妨碍终点观察,滴定前预先将溶液稀释,可使Cr3+浓度降低,蓝绿色变浅,以利于观察终点颜色的变化;同时稀释也使溶液的酸度降低,避免因酸度过大时,I-易被空气中的O2氧化。
⑤淀粉指示剂不宜过早地加入,应尽量在接近终点前加入,否则大量的I2将与淀粉结合成蓝色物质,这一部分被结合的I2不易与Na2S2O3反应,因而使滴定发生误差。
⑥滴定不可超过终点,因为过量的Na2S2O3在酸性溶液中会分解,无法返滴定。滴定结束后溶液因放置会变蓝色,如果不是很快变蓝(5~10min),那是由于空气氧化所致;如果很快变蓝,说明K2Cr2O7与KI作用不完全,溶液稀释过早,遇此情况,实验应重做。
思考题
(1)如何配制和保存Na2S2O3溶液?
(2)在配制Na2S2O3标准溶液时,所用的蒸馏水为何要先煮沸并冷却后才能使用?
(3)以K2Cr2O7标定Na2S2O3溶液的浓度时为何要加入KI?为何要在暗处放置5min?滴定前为何要稀释?淀粉指示剂为何要在接近终点时才能加入?
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















