实验三 溶胶的制备及其性质
一、实验目的
1.掌握制备溶胶的原理和方法。
2.了解溶胶的稳定性和高分子化合物溶液对溶胶的保护作用。
二、实验原理
胶体是由直径为1~100nm的分散相粒子分散在分散剂中构成的多相体系。溶胶可由两个途径获得:一是凝聚法,二是分散法。
胶体粒子表面具有电荷及水化膜,是动力学稳定体系,若胶粒表面的电荷及水化膜被除去,溶胶将发生聚沉。例如,向胶体溶液中加入电解质,反离子中和胶粒电荷而使之聚沉;若两种带相反电荷的溶胶相混合,电荷相互中和而彼此聚沉;加热会使粒子运动加剧,克服相互间的电荷斥力而聚沉。然而,若在加入电解质之前于溶胶中加入适量的高分子溶液,胶粒会受到保护而免于沉聚。
三、仪器和药品
1.仪器:试管、试管夹、烧杯、酒精灯、玻璃棒、电泳仪、手电筒。
2.药品:0.2mol/L FeCl3、0.01mol/L KI、0.01mol/L AgNO3、0.2mol/L NaCl、0.2mol/L Na2SO4、0.2mol/L Na3PO4、白明胶。
四、实验内容
1.溶胶的制备
(1)Fe(OH)3溶胶:在一个100ml烧杯中加入50ml蒸馏水,加热至沸,然后边搅拌边慢慢加入0.2mol/L FeCl3溶液5ml,继续搅拌1分钟,观察溶液的颜色变化,保留溶胶备用。
(2)AgI溶胶:在锥形瓶中加入30ml 0.01mol/L KI溶液,然后从滴定管中把AgNO3(0.01mol/L)溶液慢慢滴加20ml于锥形瓶中,即得AgI负溶胶(A)。
按同样方法将10ml 0.01mol/L KI溶液慢慢滴入15ml 0.01mol/L AgNO3溶液中,即得AgI正溶胶(B)。
2.溶胶的丁铎尔效应
取一定量氢氧化铁溶胶于试管中,在黑色的背景下用手电筒照射上面所制备的溶胶。在与光束垂直方向上观察溶胶的散射现象,并解释原因。
3.溶胶的电泳现象
将U型管洗净、烘干(或用少量胶体溶液洗几次),注入本实验制备的Fe(OH)3溶胶。静置片刻,用吸管小心加入1~2cm高的水柱(注意切勿破坏溶胶与水之间的界面),分别插入铜电极,接通电压200V直流电源,通电几分钟后,可见溶胶与水之间的界面向一极移动。判断Fe(OH)3溶胶的带电性质。
4.溶胶的聚沉
(1)电解质对溶胶的作用:取3支试管各加入2ml本实验制备的Fe(OH)3溶胶,然后分别滴加0.2mol/L NaCl、0.2mol/L Na2SO4、0.2mol/L Na3PO4溶液。记录发生相同程度浑浊时,所需各种电解质的量,并加以比较。
(2)正负溶胶的相互作用:将上述制得的AgI负溶胶(A)和AgI正溶胶(B)按表3-1所列比例混合,逐个观察混合后的实验现象,注意颜色变化。
表3-1 正负溶胶的相互作用
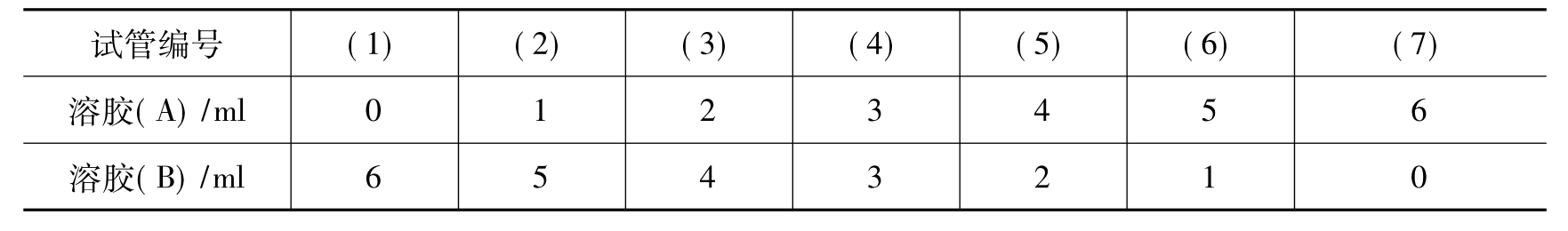
(3)加热对溶胶的作用:取1支试管,加入3ml Fe(OH)3溶胶,慢慢加热煮沸,观察现象,解释原因。
5.高分子化合物对溶胶的保护作用
取3支试管,各加入2ml Fe(OH)3溶胶和4滴白明胶,摇匀。然后分别加入1滴0.2mol/L NaCl、0.2mol/L Na2SO4、0.2mol/L Na3PO4溶液,振荡,观察有无沉淀生成,解释原因。
五、实验讨论
1.使溶胶聚沉的方法有哪些?为什么?
2.胶体电泳的方向有什么规律?
[注意事项]
制备溶胶的过程中,应很好地控制浓度、温度、搅拌和滴加速度。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。

















