实验四 配合物的生成和性质
一、实验目的
1.了解配位离子的生成、组成和离解。
2.了解配位离子和简单离子、配合物和复盐的区别。
3.了解配合物的一些特性和制备方法。
二、实验原理
配合物是由中心原子、配位体和外界组成。由中心离子和配体组成配离子,带正电荷的称为配阳离子,带负电荷的称为配阴离子。配合物与复盐不同,在水溶液中电离出来的配离子很稳定,只有一部分电离出简单离子,而复盐则全部电离为简单离子。
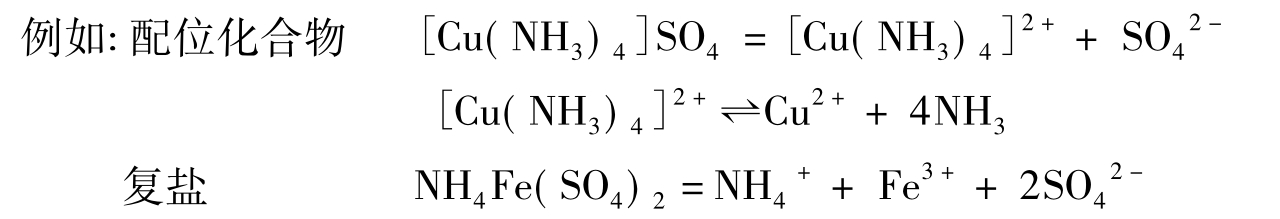
配合物中的内界和外界可用实验来确定。
通过配位反应形成的配合物的性质(如颜色、溶解度、氧化还原性等),往往和原物质有很大的差别。例如,AgCl难溶于水,但Ag(NH3)2Cl易溶于水,因此可以通过AgCl与氨水的配位反应使AgCl溶解。
配位反应常用来分离和鉴定某些离子。例如,在Cu2+、Fe3+、Ba2+的混合溶液中,加入稀H2SO4,则BaSO4沉淀出来。分离沉淀后,在溶液中加入过量的氨水,Cu2+能与过量氨水反应生成铜氨离子[Cu(NH3)4]2+而溶解。Fe3+则不与氨水作用生成配离子,而是生成Fe(OH)3沉淀,从而使Cu2+和Fe3+分离。
三、仪器和药品
1.仪器:试管若干、离心试管3只、烧杯1只、胶头滴管、离心机。
2.药品:2mol/L NaOH、氨水(2mol/L、6 mol/L)、0.1mol/L AgNO3、0.1mol/L CuSO4、0.1mol/L BaCl2、0.1mol/L FeCl3、0.1mol/L KNCS、KI(0.1 mol/L、0.2mol/L)、0.1mol/L K3[Fe(CN)6]、0.1mol/L NaCl、0.1mol/L NH4Fe(SO4)2、95%酒精。
四、实验内容
1.配合物的生成和组成
在2支试管中各加入10滴0.1mol/L CuSO4溶液,然后分别加入2滴0.1mol/L BaCl2和2mol/L NaOH溶液,观察现象。
另取20滴0.1mol/L CuSO4溶液,加入6mol/L氨水至生成深蓝色溶液时再多加数滴。然后将深蓝色溶液分盛在2支试管中,分别加入2滴0.1mol/L BaCl2和2mol/L NaOH,观察是否都有沉淀产生。
2.配离子的离解
(1)在2支试管中,各加入10滴0.1mol/L AgNO3溶液,再分别滴加2滴2mol/L NaOH和0.2mol/L KI溶液,各有什么现象产生?
(2)另取1支试管,加入10滴0.1mol/L AgNO3,再滴加2mol/L氨水,直到生成沉淀又溶解,再多加数滴。将所得溶液分别盛在2支试管中,分别加入2滴2mol/L NaOH和0.1mol/L KI溶液。观察现象,并解释原因。写出配离子的离解方程式。
3.简单离子与配位离子的区别
(1)在1支试管中滴入5滴0.1 mol/L FeCl3溶液,加入1滴0.1 mol/L KSCN溶液,观察现象。
(2)以铁氰化钾K3[Fe(CN)6]代替FeCl3,做同样实验,观察溶液是否呈血红色。根据实验说明简单离子和配离子有何区别。
4.配位化合物与复盐的区别
在3支试管中,各滴入10滴0.1mol/L NH4Fe(SO4)2溶液,分别检验溶液中是否含有NH4+(用奈斯勒试剂检验)、Fe3+、SO42-。比较实验3(2)和本实验结果,说明配合物和复盐有何区别。
5.铜氨配合物的制备
在小烧杯中加入5ml 0.1mol/L CuSO4,逐滴加入6mol/L氨水,直至最初生成的沉淀后又溶解为止。再多加几滴,然后加入6ml 95%酒精,观察晶体的析出。将制得的晶体过滤,再用少量酒精洗涤晶体两次。观察晶体的颜色。写出反应方程式。证明所得晶体中含有铜氨配离子。
五、实验讨论
1.怎样根据实验结果推测铜氨配离子的生成、组成和离解?
2.配合物与复盐有何区别?如何证明?
[注意事项]
1.制备配位化合物时,配合剂要逐滴加入,否则一次加入过量的配合剂可能看不到中间产物沉淀的生成。
2.配位化合物生成时,有的使用的配合剂浓度较大,例如:[Cu(NH3)4]2+的生成要用6 mol/L氨水,实验中注意不要将药品浓度搞错。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















