实验十六 高锰酸钾法测定过氧化氢的含量
一、实验目的
1.掌握KMnO4溶液配制及标定方法。
2.了解自身指示剂指示终点的方法。
3.掌握KMnO4法测定过氧化氢的方法。
二、实验原理
1.KMnO4溶液配制与标定
(1)配制:KMnO4是强氧化剂,常含有杂质,不能直接配制标准溶液。蒸馏水中常含有少量的还原性物质,使KMnO4还原为MnO2·nH2O,它能加速KMnO4的分解,故要将KMnO4溶液煮沸一段时间,放置几天,使之充分反应过滤后,才能标定。
(2)标定:标定KMnO4溶液常用分析纯Na2C2O4,在酸性溶液中反应如下:
2MnO44-+5C2O42-+16H+=2Mn2++8H2O+10CO2↑
此标定反应要在H2SO4酸性、溶液预热至75~85℃和有Mn2+催化的条件下进行。滴定开始时,反应很慢,KMnO4溶液必须先加入1滴,待褪色后再逐滴加入,如果滴加过快,在热酸溶液中KMnO4能部分分解而造成误差。
4KMnO4+6H2SO4=2K2SO4+4MnSO4+6H2O+5O2↑
在滴定过程中(保持溶液温度:温低反应慢,温高H2C2O4分解),溶液中生成了Mn2+自动催化,使反应速度加快,所以滴定速度可稍加快些,以每秒2~3滴为宜。由于KMnO4溶液本身具有颜色,滴定时溶液中有稍微过量的MnO4-即显粉红色,故不需另加指示剂。
2.双氧水中H2O2含量的测定
H2O2在酸性溶液中是强氧化剂,但遇KMnO4时表现为还原剂。在酸性溶液中H2O2很容易被KMnO4氧化,反应式如下:
2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑
开始时反应很慢,待溶液中生成了Mn2+,反应速度加快,故能顺利地、定量地完成反应。KMnO4稍过量即显粉红色,指示终点。
三、仪器和药品
1.仪器:称量瓶、分析天平、托盘天平、酸式滴定管(棕色,50ml)、锥形瓶(250ml)、量杯(100ml)、电炉、垂熔玻璃漏斗、试剂瓶(棕色,500ml)。
2.药品:基准物Na2C2O4、6mol/L H2SO4溶液、(A.R)KMnO4、30%H2O2水溶液、0.02mol/ LKMnO4等。
四、实验步骤
1.KMnO4溶液配制
称取KMnO4固体1.6g于烧杯中,加新煮沸放冷的蒸馏水溶解,置于试剂瓶(棕色,500ml),稀释至刻度,暗处静置7~10天。用4号微孔玻璃漏斗过滤,滤液贮存于另一棕色试剂瓶中。
2.KMnO4溶液的标定
精密称取干燥至恒重的分析纯Na2C2O40.15~0.20g 3份,分别置于250ml锥形瓶中,加入新煮沸放冷的蒸馏水100ml使之溶解,再加入5ml 6mol/L H2SO4,在水浴上加热到75~85℃。趁热用KMnO4溶液滴定,开始先1滴,充分振摇,等第1滴紫红色褪去,再加第2滴,然后再继续滴。接近终点时,紫红色褪去很慢,应减慢速度,同时充分摇匀,直至最后半滴KMnO4溶液滴入摇匀后,保持30秒不褪色。平行测定3次,记录数据(表16-1)。
3.双氧水中H2O2含量的测定
(1)稀释:用1ml移液管吸取原装双氧水(原装H2O2约30%)1.00ml于250ml容量瓶中(容量瓶中先装入半瓶水),用水稀释至标线充分摇匀。
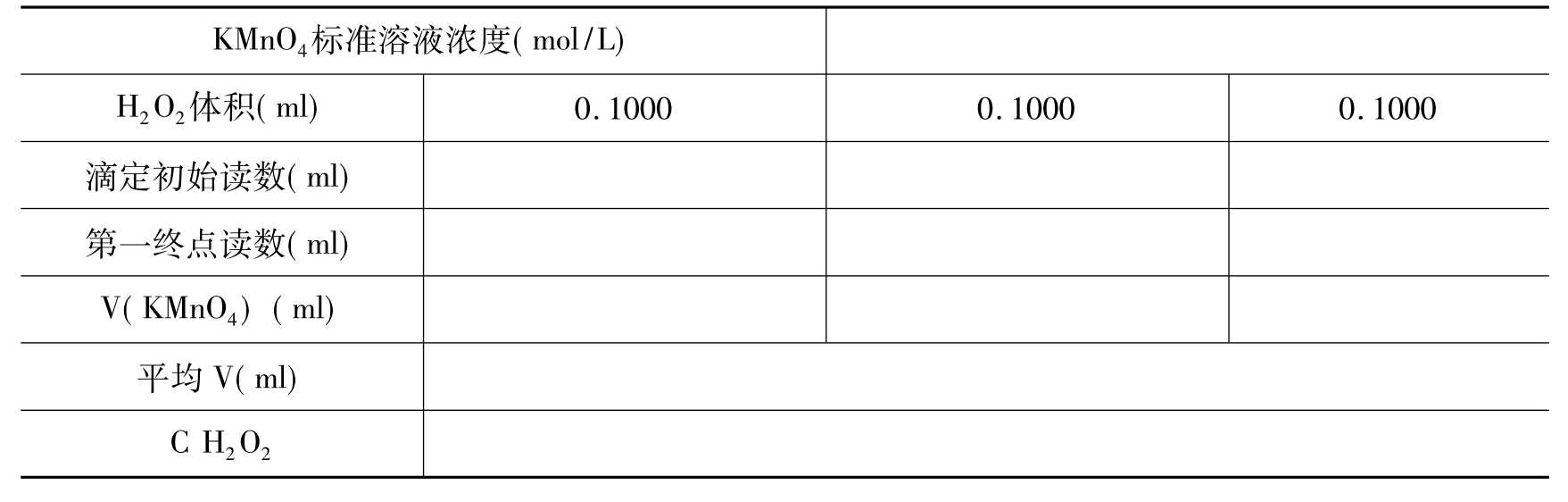
(2)测定:用25ml移液管吸取待测溶液25.00ml于250ml锥形瓶中,加75ml水,6mol/L H2SO415ml,用KMnO4标准溶液滴定至溶液显粉红色,经过30秒钟不褪色,即为终点。平行测定3次,记录数据(表16-2)。
五、实验结果
1.数据记录
表16-1 KMnO4溶液浓度的标定

续表16-1
表16-2 H2O2含量的测定
2.计算公式

六、实验讨论
1.在KMnO4法中,如果H2SO4用量不足,对结果有何影响?
2.用KMnO4滴定双氧水时,溶液是否可以加热?
[注意事项]
1.标定KMnO4溶液浓度时,整个滴定过程要注意控制溶液的酸度、温度、滴定速度。
2.温度不宜太高。
3.KMnO4滴定的终点是不太稳定的,由于空气中含有还原性气体及尘埃等杂质,落入溶液中能使KMnO4慢慢分解,而使粉红色消失,所以经过30秒不褪色,即可认为已达终点。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















