在电子海洋中遨游
金属元素在周期表中占了约80%的地盘,在室温下,几乎所有的金属都是晶体,唯有汞例外——呈液态。金属有着共同的宝贵而实用的优良品质:有美丽耀眼的金属光泽,你只要稍加留意,就会发现金属为我们的衣食住行增添的“光彩”无处不在;金属是电热的良导体,其中以银、铜为最优。要发展工业生产,改善人民生活,电力是先行官,担任电传导和输送任务的主角的是金属铜和铝;金属有延展性,其中金为最佳,1克金可以拉成3千米长的细丝,可辗成0.0001毫米厚的箔片,500张这样的箔片的总厚度也超不过人的一根头发丝的直径。多么美妙的特性,难怪自古以来,“点石成金”就成为人们梦寐以求的理想呢!
金属这些优良的品格来源于金属内部化学键的特殊性。
金属原子的最外层电子较少(1~3个),原子核与这些电子的距离稍远。与非金属相比,金属原子中核与电子之间是一种较为松散的联系,核对最外层电子的吸引力较弱,所以这些电子容易摆脱原子核的束缚,自由自在地在金属晶体中游荡,于是就称其为“自由电子”。对于每一个自由电子来说,犹如在众多自由电子形成的“电子海洋”里漂游,它们已不再属于哪一个金属原子,金属原子无私地奉献出自己的最外层电子之后,变成了“贫穷”的阳离子,浸泡在自由电子的海洋中。(也有人把这种情形比喻为“米饭布丁”,阳离子好像是米饭里面的葡萄干)但自由电子并不是绝对的自由,它不能跳出阳离子所布下的引力范围,好像孙悟空一个筋斗翻了十万八千里,可怎么也逃不出如来佛的手掌心。正是靠了阳离子与自由电子之间的作用力,才把金属原子粘合在一起,成为金属晶体(见图2—9)。金属阳离子和自由电子之间这种强烈的相互作用叫做金属键。也正是由于金属晶体中存在着自由电子,才表现出前面我们讲过的金属的那些可贵品质。
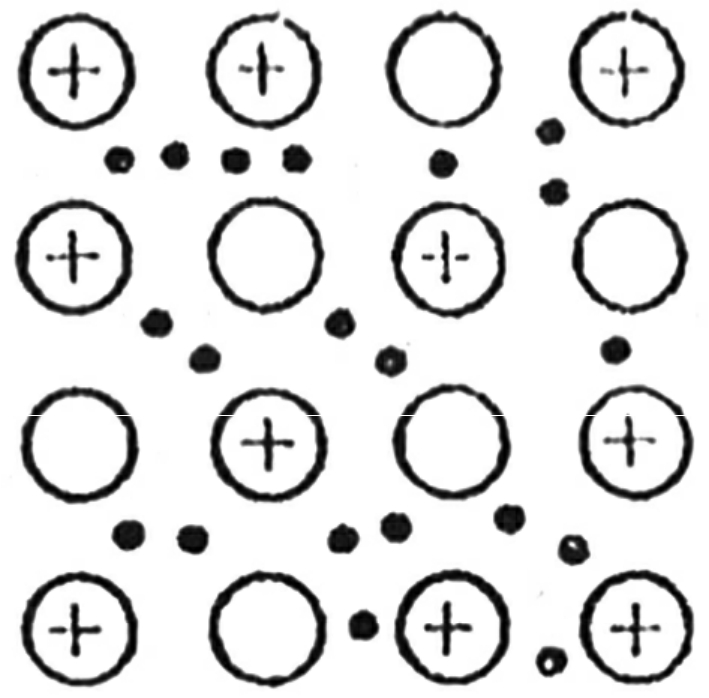
图2-9 金属晶体示意图
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















