当氢原子“赤裸”的时候
在化学发展史上,以反常现象为突破口,进行深入探索、悉心钻研,最终有所建树的事例屡见不鲜。正是这种见微知著的胆识和锲而不舍的精神,成为推动化学学科发展的重要力量。
水的熔沸点比氧族的硫、硒、碲、氢化物的熔沸点本应该低,但实际却要高出许多,氨和氟化氢的情况也相仿(图2-10),这显然是违反了常规。凡是反常现象,必有其内在根源,若能追根溯源,必有新发现。
原来在HF、H2O、NH3分子之间存在着“氢键”,氢键键能的大小介于化学键键能和分子间力之间。我们还是以水为例说明氢键是怎样形成的。
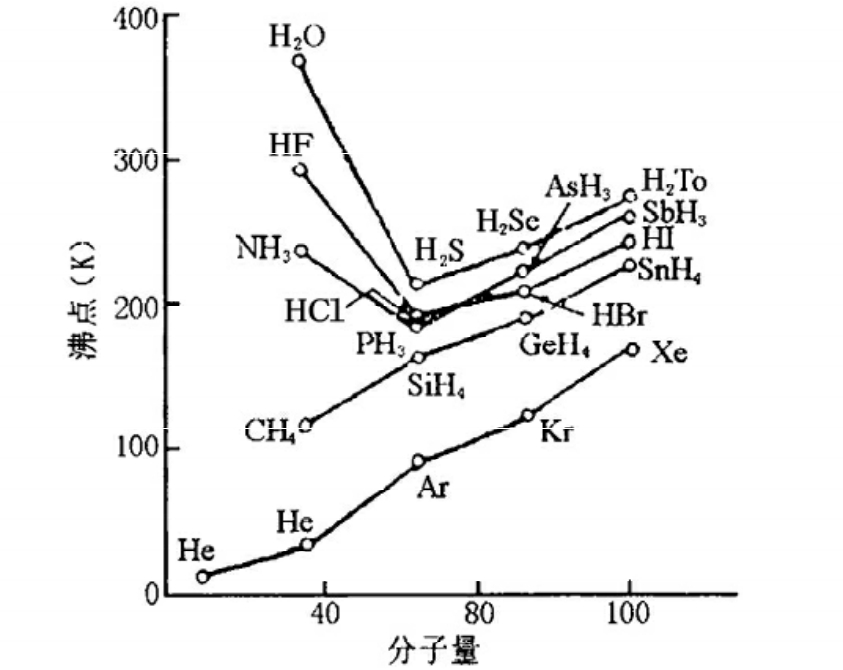
图2-10 四、五、六、七主族元素氢化物的沸点
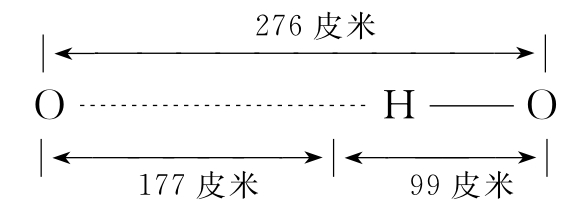
每一个H2O分子中都有两个H—O键,因为O原子个头小,吸引电子的能力又很强,它总是把与H共用的电子对拼命往自己这边拉扯,使H原子核外唯一的电子大大地偏靠O原子一边,H原子几乎成了一个裸露的原子核。正当此时,如果另有一个H2O分子靠近它,这个裸核就会与这靠近的H2O分子中O原子上的一对孤对电子产生静电吸引力。这个力大到一定程度就形成了键,这个键是靠氢把两个分子中的两个氧原子拉在一起,所以叫做氢键。它的键长为276皮米。
上述氢键属于分子间氢键。此外还有分子内氢键,如:邻硝基苯酚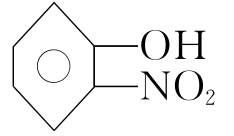 分子内,依靠裸氢和O、N原子相连,就构成了分子内氢键。
分子内,依靠裸氢和O、N原子相连,就构成了分子内氢键。
形成氢键的非金属元素要符合两个条件:第一是吸引电子的能力要足够强;第二是原子个头要足够小。周期表中所有的非金属元素中只有F、O、N有资格中选。
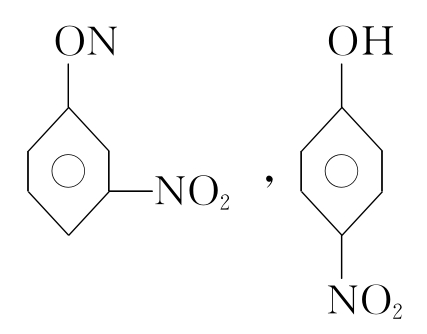
HF、H2O、NH3之所以与它们本族元素的氢化物的熔沸点相比都反常的高。就是由于这些分子间存在氢键,是凝聚容易拆散难的根源所在。NH3在水中溶解度特别大,是因为NH3与H2O之间可以形成氢键,而PH3在水中溶解度特别小,必是不能与H2O形成氢键。邻位的硝基苯酚的挥发性大于间位和对位,是因为邻位中—OH与—NO2距离近,可以形成分子内氢键;而间位和对位硝基苯酚的—OH与—NO2相距较远只能形成分子间氢键的缘故。
随着生命科学研究的深入进行,人们对蛋白质和DNA(脱氧核糖核酸)结构的认识愈来愈透彻,发现蛋白质和DNA分子中存在着大量分子内和分子间氢键,是使得这些生物大分子能够稳定存在的重要因素。而这些生物大分子又负担着机体内贮存营养、传递信息等各种生物功能。可见,氢键对生命过程有着巨大贡献,恐怕这是当初氢键理论的创始者们也未曾预料到的。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















