冰为什么会浮在水面
“北国风光,千里冰封,万里雪飘”。这12个字,就把伟大祖国辽阔北疆雄伟壮观的冬季景色描绘得淋漓尽致。在数九寒冬的日子里,遍布北国的江河、湖泊,都被厚厚的坚冰所封冻。溜冰爱好者在冰上翩翩起舞,与冰下的水族一家的畅游相映成趣。面对这一令人陶醉的景色,这里提出一个似乎不成问题的问题:冰为什么会浮在水面上?你可能会不加思索地回答:“不是明摆着吗,冰比水轻吗!”如果再追问一句:“物质都是热涨冷缩,水遇冷结成了冰,体积怎么反而膨胀了呢?”看来要想准确回答这第二个问题,似乎就不那么容易了。
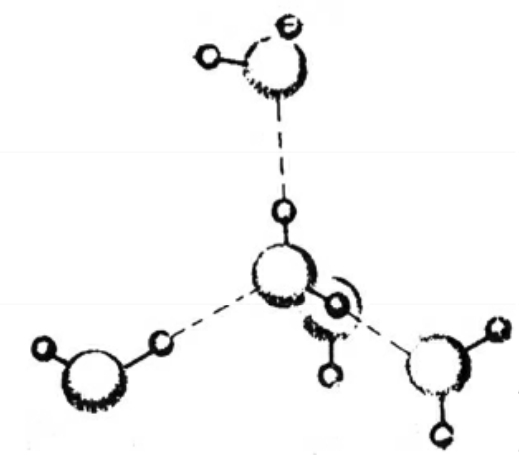
图6-2 冰中的共价键和氢键
构成物质的微粒在不停地做着热运动,温度愈高,微粒的热运动就愈剧烈,导致微粒间的平均距离就愈大,反之亦然,这就是物质热胀冷缩的根本原因。水分子构成水,特别是构成冰时,情况就有些与众不同:水分子由1个氧原子和2个氢原子构成,这2个氢原子除与水分子内的那个氧原子形成共价键外,还有“余力”与其他半径小的、非金属性强的原子形成“氢键”,而这个水分子和邻近的水分子中的氧原子之间正好满足这一条件。因此每个水分子中的氧原子,除与分子内的氢原子形成两条氧—氢共价键外,还能与相邻水分子中的氢原子形成两条氢键,这样就形成了四面体取向的两条共价键和两条氢键。冰中的氧原子与周围原子的成键及原子空间分布示于图6—2,图中实线表示共价键,虚线表示氢键。因此,当水结成冰时,冰分子间就通过氢键相结合形成了类似金刚石的立体架式结构,结果导致冰的空间结构中出现了很多空隙(见图6—3),使冰的密度反倒比水要小(0℃时冰的密度为0.9107克/厘米3,而水的密度为0.9998克/厘米3),这就是冰为什么会浮在水面的本质原因。冰的“反常”膨胀,真乃造物者的“巧妙安排”。设想一下,如果冰的密度比水大,那水结冰后就会沉到水底,水就会始终暴露在寒冷的大气之中,没有了冰这层“厚棉被”,就有可能使河流、湖泊中的水全部结冰,那水中的动植物怎么越冬!但万幸的是,冰来了个“反常”膨胀浮在水面,使冰下的水仍能保持0℃以上,这才使水中的鱼虾能够平安过冬,我们也才有了吃大个的鱼虾的口福。
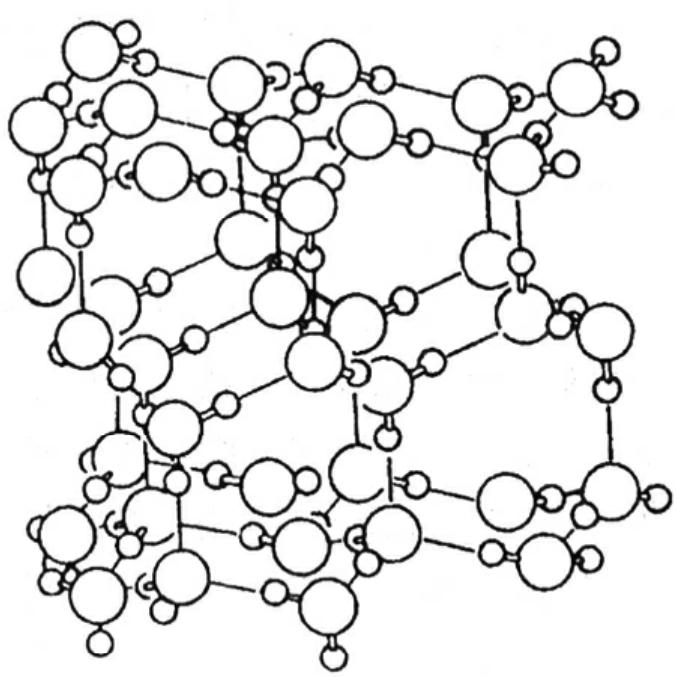
图6-3 冰的结构
不仅结冰时水分子间有氢键,冰融化时仅仅是部分氢键遭破坏。因此,0℃以上,随着温度升高,影响液态水的密度因素有两个:一是水分子间的氢键继续被破坏,分子间空隙减小,导致密度加大;另一是分子间平均距离加大,导致密度减小。在0℃~4℃区间,前者是主要影响因素,即随温度升高,液态水的密度反而加大;4℃以上,后者成了主要影响因素,这时随温度升高,水的密度就减小了。因此,4℃时水的密度最大,此时水的密度为1.0000克/厘米3。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















