Quantitative Determination of Vitamin C
一、实验目的
通过维生素C的含量测定,掌握直接碘量法的原理及操作。
二、预习要点
(1)为什么维生素C含量可以用碘量法测定?
(2)维生素C本身就是一个酸,为什么测定时还要加入HAc?
(3)维生素C(药片)试样溶解时为何要加入新煮沸的冷蒸馏水?
三、实验基本原理
维生素C(Vitamin C)又名抗坏血酸(Ascorbicacid)。分子式为C6H8O6,分子量 176. 1 易溶于水,略溶于乙醇。因为分子中含有烯二醇基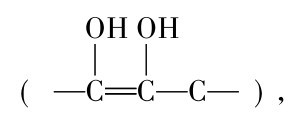 故具有强还原性,能与碘直接作用,维生素C分子中的烯二醇基
故具有强还原性,能与碘直接作用,维生素C分子中的烯二醇基 被氧化成二酮基
被氧化成二酮基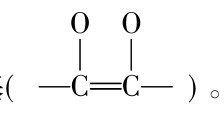
此反应进行很完全。使用淀粉作为指示剂,用直接碘量法可测定药片、注射液、蔬菜、水果中维生素C的含量。
四、仪器和试剂
仪器: 分析天平,酸式滴定管(50m L),锥形瓶(250m L),量筒(10m L, 100m L),烧杯(150m L),容量瓶(100m L),容量吸管(25m L),滴定台,洗耳球,洗瓶,玻棒。
试剂: 标准碘溶液(0.05mol/L),维生素C(药片),稀醋酸(2mol/L); 淀粉指示液[0.5%(W/V)水溶液]。
五、实验内容
(1)准确称取维生素C样品0.6~0.8g,置于150m L烧杯中,加入新煮沸的冷却蒸馏水约50m L,2mol·L-1HAc溶液30m L,使其溶解。然后小心转入100m L容量瓶中,用少量蒸馏水洗涤烧杯2~3次,洗液并入容量瓶中,加水稀释至刻度,摇匀,备用。
(2)用容量吸管吸取上述维生素C样品溶液25.00m L,置于250m L锥形瓶中,加入0.5%(W/V)淀粉指示液1m L,立即用I2标准溶液滴定至溶液呈稳定蓝色,半分钟内不退色,即为终点。
六、数据记录与结果
维生素C的百分含量按下式计算:
取3份平行样的数据,分别计算百分含量,求出含量百分平均值、偏差及相对偏差。
(编者: 李春云)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















