一、活细胞观察
细胞培养法允许实验者在细胞培养的不同阶段,进行观察和纪录活细胞的变化过程。最常用的观察记录方法是相差显微镜观察和摄像。
培养的活细胞在一般显微镜下观察时,细胞是透明的,反差小,难以观察到细胞清晰结构,只有应用相差装置的显微镜,才能使目的物与背景反差增强,能够看清细胞的轮廓和一些微细结构如线粒体、核仁、染色质等(图3-1)。
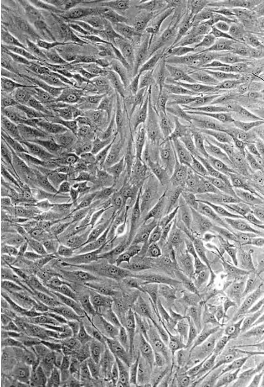
图3-1 人成骨肉瘤细胞株MG-63体外培养的相差显微镜观察 ×150
相差显微镜的相差装置或显微镜都由两个主要部分组成:相差聚光器和相差物镜。在每个相差物镜的光学系统中都有一个光环透镜;在聚光器里有数个可转换的相位板,一定倍数的物镜使用时须与相应的相位板一致。相差观察时对照明要求严格,光轴要对正,视野照明光度均匀。
【操作步骤】
1.先调好相位板,使聚光器相位板号与相差物镜放大倍数相一致。
2.然后抽出目镜,再换辅助望远镜,移动辅助镜筒并调整聚光器相位板,使视野中两个大小一样的光环必须相互吻合,如不同说明倍数不一致。
3.再重新换上原目镜,即成相差图像,可进行观察和摄影;当更换不同倍数物镜时,须按上述过程重新调节。
【注意事项】
(1)对培养瓶、皿的要求。相差显微镜观察要求底物要平坦、质地均匀、透光度好;一般玻璃瓶凹凸不平不适做相差观察和摄影。最好用质地均匀的塑料培养瓶。
(2)观察和摄像前要擦净培养瓶面,勿使残留污迹影响透光度。
(3)调光。对正光轴是显微摄影的重要条件,忽视时不易获得理想效果。
二、化学染色观察
培养细胞既可直接观察活细胞,也可进行固定制成永久标本进行染色观察。固定染色观察是细胞培养中常用显示细胞形成的技术,能揭示细胞的微细结构。培养细胞可用各种方法染色,有一般和特殊之分。一般化学染色观察为观察细胞一般形态之用,如常用的Giemsa染色、苏木精-伊红(HE)染色法等;特殊染色为用于观察细胞的特殊成分和结构的方法,如酶细胞化学、免疫细胞化学方法等。以下介绍培养细胞的一般化学染色观察方法。
(一)细胞培养物固定前的处理
各种细胞材料如盖片单层培养物(细胞爬片)、悬浮培养物等都可进行细胞固定。盖片条从培养瓶或培养皿中取出后经Hanks液漂洗多次,洗去血清和附着于细胞表面的死细胞残渣。悬浮细胞经低速离心去除血清,再用Hanks液清洗后,制成涂片,空气干燥。
(二)细胞固定
细胞固定的目的在于迅速终止组织内种酶的活性,防止细胞自溶,保持细胞完整的形态结构,使细胞内化学物质和酶能准确定位。常用的固定试剂为甲醇、乙醇、丙酮、冰醋酸、甲醛、戊二醛、重铬酸钾、锇酸等,分别以不同的剂量单用或混合配制。以下为常用的几种固定液:
1.10%甲醛溶液 甲醛100ml,蒸馏水900ml。
2.10%中性甲醛(pH 7.2) 0.2mol/L Na2HPO472ml,0.2mol/L NaH2PO428ml,甲醛20ml,加双蒸水至200ml。
3.甲醇/冰醋酸固定液 甲醇∶冰醋酸=3∶1。
4.Carnoy固定液 无水乙醇60ml,氯仿30ml,冰醋酸10ml。
5.4%多聚甲醛 先配缓冲液:0.2mol/L Na2HPO472ml,0.2mol/L NaH2PO428ml,加双蒸水至200ml。然后将缓冲液加温至30~60℃,加入多聚甲醛2g,搅拌,滴加2mol/L NaOH使溶解,再以1mol/L HCl调pH至7.2。
培养细胞层次少,固定液穿透快,固定效果好,固定所需时间短,一般只需5~10min即可。
(三)Giemsa细胞染色法
Giemsa染色是最常用的方法,它简便、快速,适用于多种细胞和染色体染色。
【操作步骤】
1.Giemsa染色液配制 称Giemsa粉0.5g、甘油22ml,在研钵内先用少量甘油与Giemsa充分混合,研磨至无颗粒;再将剩余甘油混在一起,56℃保温2h后,加入33ml甲醇,保存于棕色瓶内。临用时按1∶9比例取Giemsa染色液与pH 7.0磷酸盐缓冲液混合配成Giemsa应用液。
2.染色步骤 细胞标本清洗→甲醇固定10min→空气干燥→滴加染色液布满玻片染15min→流水冲洗3min→空气干燥→中性树胶封片→观察与摄影。
3.结果 胞核染成紫红色或蓝紫色,细胞质染成粉红色(图3-2,彩图1)。
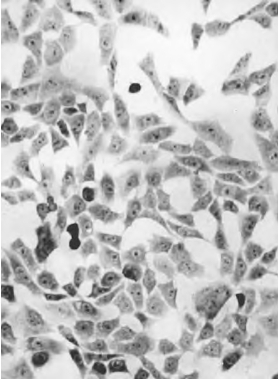
图3-2 体外培养的小鼠胚胎成纤维细胞的Giemsa染色观察 ×150
【注意事项】
1.染色时染色液应布满玻片,不要有气泡;固定后,玻片一定要干燥后染色,否则残留固定液会使局部浅染、不染或染成褐色。
2.应用染色液宜现配现用,保存时间最好不要超过48h。
3.Giesma对pH极敏感,磷酸盐缓冲液pH值要调准确;染色后的标本一定要干燥后再封片,否则中性树胶封片后,残留的水与胶作用,标本局部呈现乳白色浑浊。
4.染色完毕,不能先倒去染料后冲洗,因为染色液表面常形成一层氧化膜,若先倒去液体,氧化膜易附着片上形成污渣,不易被水冲掉,结果细胞和背景都不清晰,正确方法是:小量流水从玻片一端流下,染料漂起随流水冲走。
(四)苏木精-伊红染色
【操作步骤】
1.染色液配制
(1)苏木精染液(Mayer):取1g苏木精溶于1000ml热蒸馏水中→加入钾明矾50g、碘酸钠0.2g,搅拌至溶→加入水合氯醛50g,柠檬酸1g,加入至沸腾5min→冷却后过滤,次日即可用。
(2)1.0%伊红染液配方:将1.0g伊红(水溶性)溶于100ml蒸馏水中。
2.染色步骤 细胞单层培养物漂洗→固定→苏木精染色5~10min→自来水漂洗→浸入稀盐酸乙醇液(用75%乙醇与1%盐酸配制)数秒后进行分色处理。脱去多余的蓝浮色,使核呈深蓝色,胞质无色或呈灰蓝色→自来水浸洗→淡氨水(400ml自来水加2滴氨水)冲洗10min以上,使细胞核蓝化→自来水浸洗→1%伊红染色液染5~10min,进行对比染色→用蒸馏水洗去玻片上的浮色→70%、80%、90%梯度乙醇脱水一次,再经95%、100%乙醇脱水两次,每次1min,浸入二甲苯两次,每次1min,树胶封固→观察。
3.结果 光镜下细胞核呈深蓝色,细胞质粉红色(图3-3,彩图2)。
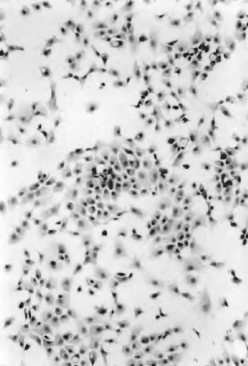
图3-3 体外培养的兔软骨细胞的H.E.染色观察 ×100
三、超微结构观察
培养细胞具有层次薄和材料新鲜的特点,固定时很容易穿透,固定效果很好,适于做电镜观察,以下分别介绍培养细胞的透射电镜与扫描电镜观察。
(一)透射电镜观察
【试剂】 2%~3%琼脂糖,戊二醛,75%乙醇,1%四氧化锇,pH7.2~7.4PBS缓冲液。
【操作步骤】
1.细胞悬液标本制备
(1)收集5×107/ml左右对数生长期细胞(在收集前一天换液一次)连同培养基一起置2ml塑料小管中,用Hanks液或PBS液清洗2~3次,1 000~1 500g离心10min,去上清液。
(2)沿着管壁加入2%~3%戊二醛,轻轻吹打,使细胞混悬于固定液中,4℃固定30min,用小铝片将细胞团块铲离管底,翻面继续用新固定液固定30min或更长时间,1 000g离心5min,去上清液。
(3)4℃PBS液冲洗,冲洗时间不等,一般为1~2h或过夜,离心后去上清液。
(4)离心管内加入0.1~0.5ml 2%~4%琼脂糖液(37℃),两手搓离心管,使细胞与琼脂糖液混匀,室温下冷却,形成细胞琼脂凝胶预包埋块。
(5)离心管内加适量PBS液或75%乙醇,用铝片沿管壁轻轻地将细胞琼脂糖凝胶块松动,将其移入含75%乙醇的青霉素瓶内,24h后换固定液一次,4℃保存,1年内使用。
(6)预包埋块切成1mm3大小,置1%四氧化锇4℃固定1~2h。PBS液反复漂洗。
(7)分别用50%、70%、90%丙酮脱水一次,每次10~15min;100%丙酮脱水3次,每次30min。
(8)浸入稀释包埋剂中(丙酮∶包埋剂=1∶1),室温1h;再浸入纯包埋剂(如环氧树脂)37℃过夜。60℃固化48h。干燥器内保存备用。
(9)常规电镜样品超薄切片,铀铅染色及透射电镜观察,具体方法请参照相关文献,因篇幅有限,这里不再赘述(图3-4)。
2.细胞盖片标本制备
(1)将生长在盖玻片或聚苯乙烯盖片上的单层细胞取出,置青霉素瓶内,用4℃PBS液漂洗3次。
(2)用2%冷的戊二醛固定30min,冷PBS液漂洗3次。
(3)用1%四氧化锇固定30min。
(4)梯度丙酮脱水(50%、70%各1次,90%2次,100%3次)。
(5)浸入稀释包埋剂3ml,室温30min后换纯包埋剂1ml,2h或过夜。
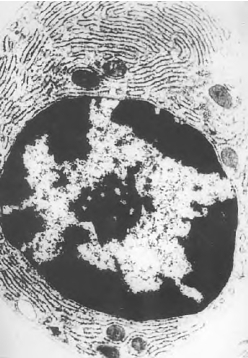
图3-4 小鼠浆细胞的透射电镜观察×6 000
(6)将明胶囊装满混合包埋剂,倒盖在单层细胞上,60℃固化2h。聚苯乙烯盖片与包埋剂直接用手分离。而玻璃盖片与包埋剂一齐放入盛液氮的烧杯内片刻,迅速取出放在自来水中,二者即可分离。常规电镜样品超薄切片,铀铅染色及透射电镜观察。
(二)培养细胞扫描电镜观察
【试剂】 2%~3%戊二醛,pH7.2~7.4 PBS缓冲液,梯度乙醇(30%、50%、70%、80%、90%、95%),1%四氧化锇。
【操作步骤】
1.单层细胞盖玻片培养物漂洗后,用2%~3%戊二醛4℃固定1h。PBS液洗3次,每次10min。
2.1%锇酸固定1h,PBS液清洗3次,每次10min(锇酸一定要除净,因为锇酸本身也发射电子,影响观察)。
3.乙醇上行脱水(30%、50%、70%、80%、90%、95%),各浓度乙醇通过2次,每次15min。
4.95%乙醇保存或临界点干燥后噴金,扫描电镜观察(图3-5)。
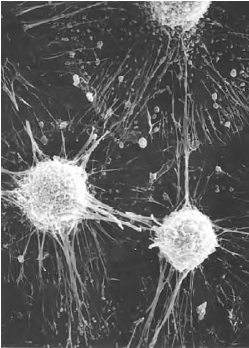
图3-5 体外培养细胞的扫描电镜观察 ×2 000
四、免疫细胞化学观察
免疫细胞化学(immunocytochemistry)是利用免疫学抗原抗体反应的原理对组织细胞内特定抗原进行定性、定位和定量研究的一种技术。此技术需预先将某种标记物结合到抗体上,借标记物的荧光或酶的有色反应、放射性或高电子密度,在光镜或电镜下进行定性、定位或定量观察。由于抗原抗体的结合是高度特异的,所以免疫细胞化学具有灵敏度高,特异性强,定位准确及应用广泛等特点。这里介绍利用免疫细胞化学方法显示培养细胞内波形纤维蛋白。
胶原蛋白(collagen)在体外培养的成纤维细胞中都有表达。使抗胶原蛋白的一抗与细胞内的胶原蛋白结合,再使生物素标记的二抗与一抗结合,然后滴加辣根过氧化物酶(horseradish peroxidase,HRP)标记的亲和素,后者与二抗结合,通过显示HRP,最终显示了胶原蛋白。
【实验用品】
1.器材 超净工作台、CO2培养箱、倒置相差显微镜、滴管、吸管、移液管、培养皿、24孔培养板、试管架、恒温水浴锅、20μl微量加样器。
2.试剂 PBS溶液(pH7.4);一抗;免疫学检测试剂盒;显色试剂盒。
3.材料 培养细胞飞片。
【操作步骤】
1.培养细胞飞片取出后,Hanks液冲洗,4℃冷丙酮固定,干燥30min,用PBS溶液(pH7.4)冲洗3次,每次3~5min(3× 5min)。
2.每张切片加1滴3%H2O2溶液以阻断内源性过氧化物酶的活性,室温下孵育0min。
3.PBS溶液冲洗(3×5min)。
4.每张切片加1滴非免疫性动物血清,室温下孵育10min,减少非特异性背景,不必冲洗,只须吸去多余的液体。
5.每张切片加1滴第一抗体,室温下孵育30min。入4℃过夜。
6.次日取出后,先在湿盒室温下放置20~30min,然后PBS溶液冲洗(3×5min)。
7.每张切片加1滴生物素标记的第二抗体,37℃,30min。
8.PBS溶液冲洗(3×5min)。
9.每张切片加1滴抗亲和素-HRP溶液,37℃,40min。
10.PBS溶液冲洗(3×5min)。
11.每张切片加1滴新鲜配制的DAB溶液,显微镜下观察3~10min。
12.自来水冲洗,苏木精复染,中性树胶封固。
【观察结果】 细胞质内显示棕黄色的部位即为胶原蛋白所在的部位(图3-6,彩图3)。
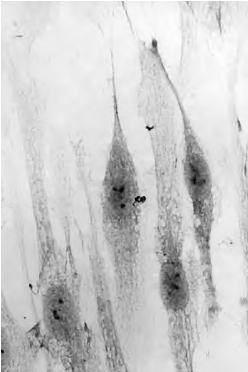
图3-6 体外培养的小鼠成纤维细胞胶原蛋白免疫细胞化学观察 ×400
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














