一、培养细胞DNA的提取
培养的真核细胞在蛋白酶K、SDS、RNA酶的作用下,消化破裂细胞膜与核膜,蛋白质变性并降解成小肽或氨基酸;DNA从核蛋白中游离,与蛋白质分开,同时RNA酶降解污染的RNA。用饱和酚、氯仿抽提使蛋白质与DNA脱离,在高盐存在下用乙醇沉淀收集DNA,最后得到欲提取的DNA。
【实验用品】
1.器材 移液器、低温离心机、冰箱、Tip头、Eppendorf管、紫外分光光度计、水浴箱。
2.试剂
(1)DNA提取液:10mmol/L pH8.0 Tris-HCl、0.1mol/L pH8.0EDTA、20μg/ml胰RNA酶、0.5%SDS。
(2)TE缓冲液:10mmol/L pH8.0Tris-HCl、1mmol/L pH8.0EDTA。
(3)其他试剂:20mg/ml蛋白酶K、3mol/L pH5.2醋酸钠(NaAc)、Tris-HCl pH8.0饱和酚、10mmol/L pH7.4PBS、氯仿∶异戊醇(24∶1)、无水乙醇。
3.材料 体外培养的细胞。
【操作步骤】
1.对于悬浮培养的细胞,以1 500g 4℃离心10min收集细胞,弃培养液。用预冷的PBS液离心洗涤细胞2次。按5×106/ml加入DNA提取液,悬浮细胞,37℃水浴温育1h。
2.对于贴壁生长的细胞,弃培养液,用预冷的PBS液漂洗涤细胞3次,尽量除净瓶内PBS,按5×106/ml加入DNA提取液至瓶内,晃动瓶至液体变黏稠。将其移入离心管内,37℃水浴温育1h。
3.加入蛋白酶K到终浓度为100~ 200μg/ml,上下转运混匀。37℃水浴温育3h或37℃水浴过夜,裂解细胞、消化蛋白。保温过程中,应不时转运离心管,混匀反应液。
4.加入等体积的饱和酚溶液温和地上下转动离心管5~10min,直至水相与酚相混匀成乳状液。5 000g离心15min,用大口吸管小心吸取上层黏稠水相,移至另一离心管中。重复酚抽提1次。加等体积的氯仿∶异戊醇(24∶1),上下倒转混匀,5 000g离心15min,用大口吸管小心吸取上层黏稠水相,移至另一离心管中。重复1次。
5.加入1/5体积的3mol/L NaAc及2倍体积的预冷的无水乙醇,室温下慢慢摇动离心管,待乳白色絮状DNA出现后,用牙签或玻璃棒小心挑取DNA,转入另一离心管中,加70%乙醇1ml,5 000g离心5min洗涤DNA,弃上清,去除残余的盐。
6.室温尽量挥发残留的痕量乙醇,但不要让DNA完全干燥。按5×107个细胞DNA提取物加TE液1ml溶解DNA。溶解过程通常需要12~24h。
7.DNA的浓度测定:取DNA溶液用TE液做适量稀释,以TE液做空白对照,在紫外分光光度计读取A260和A280的光密度值。按以下公式计算浓度:DNA浓度(μg/μl)=A260×50×稀释倍数/1 000。
8.DNA纯度的判定:A260/A280比值应在1.7~2.0之间。
【注意事项】
1.器皿和试剂的无DNA酶化处理:通过高压、干烤等方法去除试剂、器材等的DNA酶。
2.仔细吸取酚抽水相:酚抽提离心后,转移上层水相时,用大口吸管非常缓慢地将上层含DNA相吸入吸管内,勿带动界面。
3.避免DNA大分子剪切:提取过程中每一步的混匀,动作不可剧烈,防止机械剪切对林分子DNA的破坏而不能获得大分子的DNA。75%乙醇洗涤DNA后晾干时,注意不要让DNA完全干燥,否则极难溶解。
二、DNA的凝胶电泳
琼脂糖凝胶电泳是分离、鉴定和纯化DNA片段的首选标准方法。琼脂糖的浓度变化所形成大小不同的分子筛网孔,可分离不同分子量的核酸片段。
【实验用品】
1.器材 电泳仪、移液器、水平式凝胶电泳槽、紫外线检测仪、微波炉、照相机等。
2.试剂 5×TBE:54.0g Tris、27.5g
硼酸、20ml 0.5mol/L pH8.0EDTA,用时10倍稀释;溴化乙锭(ethidium bromide,EB):用水配制成10mg/ml的储存液,分装,避光4℃保存;6×加样缓冲液:0.25%溴酚蓝、0.25%二甲苯青FF、40%(W/V)蔗糖溶液,4℃保存;电泳级琼脂糖。
【操作步骤】
1.用胶带纸将洗净、干燥的电泳凝胶床的两端开口封好,形成一个胶模,水平放在工作台的位置上。
2.用TBE电泳缓冲液在水浴上或微波炉上将琼脂糖颗粒用最短时间完全溶解,所用的浓度参见表3-3。熔化的琼脂糖溶液冷却到60℃时,加入溴化乙锭,使其终浓度为0.5μg/ml,充分混匀。
表3-3 凝胶浓度与DNA分子的有效分离范围(kb)

3.在胶模上放置好梳子后,半温热凝胶倒入胶模中,凝胶的厚度在3~5mm之间。倒胶时要避免产生气泡,若有气泡可用吸管小心吸去。
4.凝胶凝固后,小心移去梳子和胶带纸,将凝胶往往放入电泳槽。也可同时制作几块凝胶,待其固化后用保鲜纸包住以防水分挥发,4℃保存。
5.加入电泳缓冲液,使液面高出凝胶表面1~2mm,如加样孔内有水泡,用吸管小心吸出,以免影响加样。
6.将样品与上样缓冲液混合,用微量移液器将样品依次加入加样孔内。
7.盖上电泳槽并通电,60~100V恒压电泳,使DNA向阳极方向移动。
8.电泳完成后切断电源,取出凝胶,直接在透射紫外灯下观察。
9.用加红色滤色镜的相机,光圈放到最大,曝光15~30s,拍照留底,或在凝胶图像分析仪上观察分析并留底。
【注意事项】
1.电压。要使大于2kb的DNA片段的分辨率达到最大,一般凝胶电泳的电场强度不超过5V/cm,对于大分子真核基因组DNA分子的电泳通常采用0.5~1.0V/cm电泳过夜,以取得较好的分辨率和整齐的带型。
2.加样。加样时枪头不要碰坏凝胶孔壁,否则DNA带型不整齐。
3.为检查电泳结果,样品中应有对照样品或分子量标准物。
4.EB是致癌物质,应注意防护,紫外光对眼睛有害,观察时应戴上护目镜或防护面罩。
三、PCR技术
PCR是一种在体外由引物介导的特定DNA序列的酶扩增。PCR全过程是基于一套“三”步曲的若干轮次的循环组合而成。依次为DNA模板热变性,双链DNA解链成单链;在低温下与引物退火,引物与单链DNA互补配对;在适宜温度下Taq DNA聚合酶催化引物延伸(扩增步骤),这三步称为一个循环。PCR方法基于该循环的重复进行,这种酶促反应可将特异性DNA扩增率至少达到2×106拷贝。近年PCR技术得到广泛应用,衍生出许多种PCR相关的新技术,本节主要介绍以DNA为模板的经典PCR技术。
【实验用品】
1.器材 DNA扩增仪、电泳仪、电泳槽、离心机、紫外检测仪、移液器、Tip头、Eppendorf管、照相机等。
2.试剂
(1)引物:用去离子水配成10~50μmol/L浓度,扩增时用量为1~2μl/100μl反应体积。
(2)Taq聚合酶:商品供应一般为5U/μl,扩增时用量为2~5U/100μl反应体积。
(3)PCR反应缓冲液:部分随Taq酶提供给用户,需要时自己配制,10×浓度如下:250~500mmol/L KCl、100~500mmol/L pH8.4Tris-Cl、15~20mmol/L MgCl2、0.5%Tween-20、1mg/L BSA(组分ⅴ)。
(4)dNTPs:已有商品化中性混合液(2mmol,10×)供应,如需要自己配制,则将dATP、dGTP、dCTP、dTTP钠盐各10mg合并,加去离子水2ml溶解,用0.1mmol/L的NaOH调至pH7.0~7.5,分装后-20℃保存(浓度为5mmol/L)。
(5)模板:用合适方法制备的模板DNA。
(6)其他试剂:无菌液体石蜡、琼脂糖、溴化乙锭。
【操作步骤】
1.在一0.5ml Ep管中加入下列各成分(按100μl反应体积计算):二种引物各1~2μl、10×PCR反应缓冲液10μl、dNTPs(2mmol/L混合母液)10μl、模板1~5μl、去离子水补至100μl(包括Taq酶体积)。上述诸液混合后,离心15s,使液体沉至管底。加石蜡油30~50μl于反应表面,以防止加温过程中液体蒸发影响反应体积。
2.95~97℃变性5~10min,水浴冷却,加Taq酶(1U/μl)2~5μl,短暂离心。
3.开始循环依据设计的循环参数进行扩增:变性,90~94℃,30~50s;退火,25~65℃,60~90s;延伸,70~74℃,60~120s。反复循环25~35次,末次循环后,在延伸温度再延时5min。
4.反应结果后,短暂离心,吸取少量扩增产物(5~10μl),加1~2μl上样缓冲液,于适当浓度的琼脂糖凝胶中进行电泳分析。为确定扩增产物是否符合设计要求,需选择合适分子量DNA标准平行电泳。
【注意事项】
1.PCR中的对照设置 为确保结果的可肯定性,应设置阳性及阴性或空白对照,阳性对照为用已知阳性模进行扩增,阴性对照为加无关或不加模板DNA进行扩增。
2.模板制备 DNA提取过程中应注意避免DNA的降解并尽量使DNA中不含任何蛋白酶、核酸酶、Taq DNA聚合酶抑制剂及能与DNA结合的蛋白质,以获取理想的扩增结果。
3.引物设计与引物浓度 引物是欲扩增核酸片段两端的已知序列,是保证PCR特异性扩增的关键因素。因此,应注意引物设计符合设计的一般原则。否则得不到特异性的扩增带。引物浓度应通过预实验确定最适引物浓度,范围一般在0.2~1.0μmol/L。浓度太低可能得不到扩增结果或产量过低;太高易出现引物二聚体。
4.循环参数 PCR中控制温度是关系到试验成败的重要环节。模板DNA的彻底变性是实验进行的基础,DNA解链不完全是导致PCR失败的最主要原因。退火的温度及时间依赖于引物的长度、浓度及碱基组成中GC的含量。退火温度太低,易出现非特异扩增。一般来说,退火温度为Tm值减去5℃。PCR中延伸的温度要根据Taq DNA酶的最适作用温度而定,通常在70~75℃之间;延伸时间则依扩增片段和长度而定,正常情况下,每分钟可延长1kb的长度,如果扩增的片段的150bp左右或更少,可省去此步骤。
四、Southern Blot法
Southern杂交可用来检测经限制性内切酶酶切后的DNA片段中是否存在与探针同源的序列。其主要步骤包括:基因组DNA的限制性酶切;将DNA片段电泳分离,经变性后转移并固定于支持膜上;预杂交以除去非特异性结合位点;以标记的探针进行杂交;通过放射自显影或显色反应检查目的DNA性酶切片段的位置。
【实验用品】
1.器材 电泳仪、电泳槽、紫外检测仪、移液器、Tip头、Eppendorf管、尼龙膜、吸水纸、新华3号滤纸、转移槽、水浴箱、杂交炉、离心机、照相机、杂交袋、塑料封口机、X-胶片、X线暗盒、暗室与安全灯等。
2.试剂
(1)限制性内切酶(以EcoRⅠ为例)10U/μl及适合该酶的缓冲液(10×buffer for EcoRⅠ)。
(2)变性液:0.5mol/L NaOH、1.5mol/L NaCl。
(3)中和液:0.5mol/L pH7.4Tris-C、1.5mol/L NaCl、1mol/L NH4Ac、0.03mol/L NaCl。
(4)转移液:20×SSC(配制1 000ml:NaCl 175g,柠檬酸三钠·2H2O 88g,H2O 800ml,1mol/L HCl调至pH7.0,补水至1 000ml。分装后高压灭菌);或20×SSPE(配制1 000ml:NaCl 174g,NaH2PO427.6g,EDTA-Na27.4g,H2O 800ml,用10mol/L NaOH调至pH7.4,补水至1 000ml。分装后高压灭菌)。
(5)预杂交液:6×SSC、5×Denhardt(常以50×Denhardt为储备液,配制500ml:Ficoll40 5g,聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP)5g,牛血清清蛋白组分Ⅴ,加水溶解至500ml,过滤除菌并存放于-20℃、0.5%SDS、50%甲酰胺、100μg/ml变性断裂鲑精DNA(应在1kb以下,1%琼脂糖凝胶电泳,在溴酚蓝之前;配制时称取10mg,加无菌水1.0ml,加热、超声处理使之溶解,-20℃保存,使用前需煮沸5min变性后迅速放置冰浴)。
(6)其他试剂:0.5mol/L pH8.0EDTA、双蒸水、0.2mol/L HCl、放射性标记的探针、显影液与定影液、20%SDS。
(7)样品:DNA样品0.4~0.6μg/μl。
【操作步骤】
1.基因组DNA的限制性酶切 常用30μl反应体积设置反应体系:在一个1.5ml Ep管内加入0.5μg/μl基因组DNA20.0μl、双蒸水5.0μl、10×buffer 3.0μl、EcoRⅠ(10U/μl)2.0μl。离心数秒,使管壁液珠离心到管底,以保证反应体系体积准确。放置37℃水浴保温3~6h;加入1/5体积的0.5mol/L EDTA终止反应(终浓度为12.5mmol/L)。
2.DNA的琼脂糖凝胶电泳 见本节二。
3.DNA的转移与固定 将DNA从凝胶中转移到固相支持膜(尼龙膜)的方法有毛细管转移法、电转移法及真空转移法,这里介绍最常用最经典的毛细管转移法。
(1)电泳结束后照相,然后切去凝胶的边角,并在胶的一角作好标记。
(2)将胶置于0.2mol/L HCl中处理10min,如果检测的DNA片段<1kb,可不经此步;如果>1kb,可适当延长时间(10~20min)。当胶中溴酚蓝由蓝转成橘黄色时,说明胶已处理透。
(3)弃去HCl溶液,用去离子水漂洗2次。随后浸泡于数倍体积的变性液中15~45min后,换用中和液处理15~30min。
(4)按图3-8示安装转移槽,注入足量转移液。
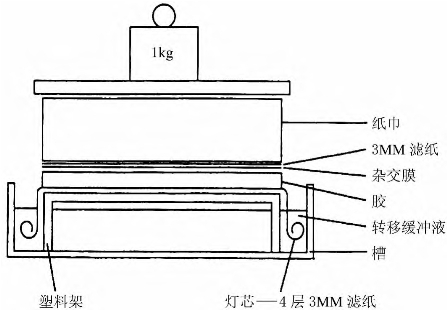
图3-8 典型的毛细胞管作用Southern转移系统
(5)根据胶的大小裁剪尼龙膜及滤纸片(3~5张),同样剪去膜的一角作标志。
(6)将膜平铺在去离子水表面,直到滤膜从下到上湿透为止,然后将其转至转移液中,至少5min,操作时戴手套,用平头镊。
(7)戴手套将在转移液中泡好的滤纸片1~2张铺到转移台上,驱逐气泡。倒上少许转移液,用大小适合的X线片将胶从中和液中托起,将加样孔先接触转移台,自一端起将滑放到滤纸上,注意不要留下气泡。将浸泡好的尼龙膜放在胶上,使膜的上端对齐加样孔。同样检查及排除气泡。放上2~3层预先浸好转移液的滤纸片,放上吸水纸10~15 cm高,上面加一块平板,然后压上0.5kg左右的重物(图3-8)。注意重物使滤纸片、吸水纸之间有较好的接触,发挥毛细胞虹吸作用。
(8)转移持续8~24h,每当纸巾浸湿后更换新的纸巾。小片段转移快,大片段转移需要更长时间。
(9)转移完毕,移去吸水纸,用平头镊将膜取出,在6×SSC溶液中浸泡滤膜5min,用滤纸吸干后夹在两层干净滤纸片中,置于80℃烤0.5~2h。可以紫外灯观察凝胶,检查转移效果。
4.预杂交和杂交
(1)配制所需的适量预杂交液,按每平方厘米杂交膜约需0.2ml计算。
(2)将已转移固定的杂交膜以6×SSC湿润并浸泡2min。
(3)将湿润的杂交膜装入杂交袋中,按0.2ml/cm2加入预杂交液,浸透杂交膜之后,尽可能赶去气泡,以塑料封口机密封袋口,使杂交间隙达到最小,然后置于杂交炉中42℃水浴预杂交2~6h。
(4)将已标记的双链DNA探针于100℃加热5~10min使之变性,然后迅速置冰浴中骤冷。
(5)从杂交炉水浴中取出已经过预杂交的杂交袋,剪去杂交袋一角,通过制品向杂交袋中加入经变性的标记探针。赶尽气泡之后,用塑料封口机重新封口。于杂交袋外再套塑料袋,同样以塑料封口机封口,置杂交炉42℃水浴中杂交6~12h。
(6)小心取出杂交好的滤膜,依下列次序进行洗膜:2×SSC,0.5%SDS,室温5~10min;2×SSC,0.1%SDS,室温,10~15min;0.1×SSC,0.5%SDS,42℃,30min;0.1×SSC,0.1%SDS,56~68℃,30min。
(7)用0.1×SSC于室温短暂漂洗滤膜,将其置于一叠纸巾上,吸去大部分液体,空气中干燥滤膜,以Saran膜包好滤膜,准备进行放射自显影。
5.放射自显影 在暗室中红色安全灯下,按增感屏-X线片-增感屏的顺序放置X线片,盖紧暗盒,置-70℃自显影24h以上,取出后冲洗X线片:室温下将X线片显影3~5min,以背景不过度为宜,清水冲洗之后,置于定影液中5~15min。显影不足者,另放一张X线片,继续自显影5~7d或更长时间。
【注意事项】
1.为使Southern印迹杂交反应获得满意结果,经酶解的DNA量要求在10μg左右。
2.为了及时了解酶反应的完成程度,可在反应到预定时间后,先取1~2μl进行微型凝胶电泳检查,如果酶解不全,可补加少量酶,继续反应2~3h。
3.放射性核素标记有损害性,手上也可能带多种脏物污染X线片,故操作时要戴手套。
4.暗盒放在低温冰箱中应避免震动,以防产生重影。
5.增感屏受污染后会降低效率或使本底升高,应精心保护,及时用乙醇棉球擦净。
五、斑点杂交法
斑点杂交与Southern杂交较为相似,但斑点杂交能简便、快速地检测微量核酸,且可以半定量分析,事先也不用限制性内切酶消化及用凝胶电泳分离核酸样品,在一张固相支持膜上可同时进行多个样品的检测。
斑点杂交的原理是将DNA或RNA变性后直接点样吸附于固相支持膜上,然后用标记探针与之杂交,洗涤去除未反应探针,采用放射自显影或显色反应检测显示杂交信号,分析结果。这里主要介绍用放射性核素标记的探针检测DNA的斑点杂交方法。
【实验用品】
1.器材 移液器、自动光密度扫描仪、Tip头、Eppendorf管、尼龙膜、真空抽滤加样器、水浴箱、杂交炉、杂交袋、塑料封口机、X-胶片、带增感屏的X线暗盒、暗室与安全灯等。
2.试剂 20×SSC、50×Denhardt、10 mg/ml变性断裂鲑精DNA(配制方法见本节三Southern blot所述);其他试剂:10% SDS、甲醛、去离子甲酰胺、1mol/L pH7.0 Na2HPO4、0.5mol/L pH8.0EDTA、双蒸水、放射性标记的探针、显影液与定影液、DNA样品。
【操作步骤】
1.样膜的制备
(1)样品的预变性:取待测DNA样品的量视情况而定,一般可加样10~20μg,溶于水,煮沸5~10min,冰浴中迅速冷却,使其变性。
(2)尼龙膜的预处理:戴上一次性手套,取尼龙膜按需要剪成合适大小,并剪掉一角作为点样顺序标记。如采用手工点样,用铅笔在尼龙膜上按0.8~1cm2的面积标上小格。用蒸馏水浸湿,再浸入6×SSC溶液中至少30min,将膜取出风干待用。
(3)点样:可根据情况选用手工直接点样或用真空抽滤加样器(斑点或狭缝)点样。手工直接点样时用微量移液器将经变性处理的DNA样品依次点到尼龙膜的标记点上。斑点直径不能过大,应控制在0.5cm2以内。单个样品分少量多次点样,边点样边风干。真空抽滤架器点样时按其操作说明进行点样。
(4)固定:点样后的样膜,置于滤纸上,室温自然风干,然后80℃烤2h固定DNA样品。固定的样膜,封存于塑料袋内待用(-20℃可保存若干月)。
2.预杂交和杂交
(1)配制所需的适量预杂交液,按每平方厘米杂交膜约需0.2ml计算。预杂交液各组分的浓度为:6×SSC、5×Denhardt、0.5% SDS、50%甲酰胺、100μg/ml变性断裂鲑精DNA。
(2)将封存样膜的塑料袋剪一角开口,加少量2×SSC使其湿润,弃余液。按0.2ml/cm2加入预杂交液,尽可能赶去气泡,以塑料封口机密封袋口,然后置于杂交炉中42℃水浴预杂交2~4h。
(3)将已标记的双链DNA探针于100℃加热5~10min使之变性,然后迅速置冰浴中骤冷。
(4)从杂交炉水浴中取出已经过预杂交的杂交袋,剪去杂交袋一角,通过制品向杂交袋中加入经变性的标记探针。赶尽气泡之后,用塑料封口机重新封口。于杂交袋外再套塑料袋,同样以塑料封口机封口,置杂交炉42℃水浴中杂交16~20h。
3.洗膜 小心取出杂交好的滤膜,根据目的序列的丰度、标记探针的要求,可采用高严谨性或低严谨性洗膜。
高严谨性洗膜为:2×SSC,0.1%SDS,室温2次,每次15min;0.1×SSC,0.1% SDS,室温2次,每次15min;0.1×SSC,0.1%SDS,55℃洗2次,每次15min。
低严谨性洗膜为:6×SSC,0.1%SDS,室温2次,每次15min;2×SSC,0.1%SDS,室温2次,每次15min;1×SSC,0.1%SDS,55℃洗2次,每次15min。
4.放射自显影 见Southern杂交。
【结果观察】 根据曝光点(或狭缝)的有无、强弱,可判定目的蛋白的有无及量的多少。利用“自动灰度扫描仪”扫描条带,计算积分光密度值,可以进行半定量分析。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















