一、概 论
周围神经组织工程就是用组织工程学的方法,构建能完全替代自体神经组织修复周围神经缺损的周围神经移植物。具体地说,就是要按组织工程学的要求,先选好构建组织工程化周围神经移植物的三个重要的“要素”;即种子细胞、生物材料、生物材料的三维结构。再按照研究组织工程学的基础理论,一步一步地进行研究。即种子细胞与生物材料的生物相容性和黏附性、生物材料的降解性、构成周围神经移植物的形式、如何避免免疫排斥等。从小动物实验做起,再转入灵长类动物实验。从短的周围神经缺损做到长缺损,成功后进入临床试验。
进行周围神经组织工程学研究的三要素是:种子细胞、生物材料和三维结构,下面进行评述。
(一)种子细胞
因其是构建周围神经组织的主要功能细胞,很容易想到是神经细胞。问题在于我们现在研制的不是神经中枢的组织,而是周围神经部分。周围神经的损伤严格来说是神经元的部分损伤,整个神经元的细胞体部分仍然活着。我们现在治疗周围神经损伤缺损的部分是移植一段周围神经桥接其间,通常是取自周围神经。周围神经由许多部分组成,如轴突、髓鞘、施万细胞、神经外膜、神经束膜、神经内膜、束膜细胞和成纤维细胞等。但在周围神经损伤后,轴突和髓鞘都退变了,有活性的细胞有施万细胞、成纤维细胞、束膜细胞和新加进来的吞噬细胞。其中成纤维细胞在周围神经再生过程中不起主导作用,相反,过多反而引起瘢痕化,故不能以成纤维细胞为主要的活性细胞。束膜细胞在周围神经再生过程中,并不活跃,与再生轴突并没有直接关系,故也不能成为活性细胞来看待。吞噬细胞是周围神经损伤后入侵的,负责清除退变的轴突和髓鞘,清除任务完结后,就会减少,与轴突再生的联系不多。最后就剩下是施万细胞。施万细胞是周围神经再生过程中最活跃的细胞,它是周围神经再生过程中,表达各种与周围神经再生有关的神经营养因子的惟一的细胞,如NGF、BDNF、CDNF、GDNF、SDNF、LIF、IL-6和它们的受体等;又是分泌构成周围神经必不可少的各种细胞外基质的细胞,如构成基底膜的ECM(如Laminin、Fibronectin、Heparan Sulfate Proteogly-cans)、CAMs(Surface Cell Adhesion Molecules:N-CAM、Ng-CAM/L1、N-cadherin、L2/HNK-1等)、Galain、Chondroitin Sulfate、Chondroitin-sulfate-proteoglycans等;也是包围轴突的髓鞘的建造者,分泌所有髓鞘相关的蛋白质,如Protein 0(P0)、Peripheral Myelin Protein 22kDa(PMP22)、Connexin(Cx)32、Myelin-associated Glycoprotein(MAG)、Myelin Basic Protein(MAP)、Periaxin等,以及无髓鞘神经所必需的蛋白质,如Glial Fibrillary Acidic Protein、Growth-associated Protein 43kDa、p75NTR、N-CAM、L1等。因此,选择施万细胞为人工神经的活性细胞是比较合适的。
组织工程学的发展,最终目的是要进入临床应用。以往的研究都将施万细胞作为种子细胞,但由于自体来源的施万细胞有限,且需二次手术,异体的施万细胞具有免疫排斥反应,因此将组织工程化的神经应用于临床,会遇到难以逾越的瓶颈。近年来的研究发现,骨髓基质细胞(BMSCs)具有干细胞的特性,有多向分化的潜能,2001年Dezawa M将大鼠骨髓基质细胞体外培养分化为类施万细胞的表型,但未应用于人工神经。我们将骨髓基质细胞体外诱导分化为类施万细胞,种植于可吸收的高分子材料来构建人工神经,修复大鼠10mm长坐骨神经缺损。亦取得成功。
(二)生物材料
目前用于组织工程化周围神经移植物的生物材料有天然材料和合成材料两大类。
天然材料中以异体神经最合适,但因有异体细胞存在,移植后有排斥反应,未能广泛使用。有用冷冻处理后能减轻排斥反应,仍不能完全解决问题。近年有用化学药物把其细胞成分去掉,可免除排斥反应。实验也证明这是很好的生物材料。
至于合成材料中,如PLA,PGA等都是生物相容性很好的合成材料。还要注意生物材料的降解性也是非常重要的。因为生物材料是种子细胞在组织工程化组织里成活的必要场地。但当种子细胞生长、发育和繁殖到一定体积后,生物材料就要让出空间给种子细胞发育。也就是说生物材料的降解就要提到议事日程。而且其生长速度还要跟种子细胞的生长速度相匹配,方能保证种子细胞的正常生长。周围神经生长速度一般为1mm/d。从大鼠的实验可知,要长过1cm长的神经缺损,要1~2个月时间,到3个月时,髓鞘也长出来。因此,生物材料在1~2个月内就要开始降解,3个月就要完全让出位置给髓鞘生长。降解过程所产生的代谢产物和酸碱成分,对神经也应无毒性反应。
(三)三维结构
研究生物材料具备何种三维结构对神经生长最有利,必须从仿生学来设计,即从周围神经的结构与损伤后恢复过程的变化来设计。
众所周知,周围神经在形态学上是由许多根神经纤维组成神经束,若干根神经束再组成神经干。神经纤维之间好像电话线路一样、平行排列,但是互不相干的、呈波浪形向前直线方向行走的。周围神经损伤后,其远端神经发生轴突和髓鞘碎裂和崩解,大量吞噬细胞侵入,一方面清除轴突髓鞘的碎屑,更重要的是刺激原来处于休息状态的施万细胞分裂和增生。并沿着每一根神经纤维的神经内膜和基底膜排列成线状,实际上是一个潜在的管道,即Büengner细胞带,从近端长进来的再生轴突就长进这潜在的管道,一直伸延到终末器去,恢复其功能。同时再生轴突被施万细胞包围并给予营养和产生髓鞘,最后成为有髓神经纤维。
从此得到启发是:生物材料的形态要有利于诱导施万细胞排列成线状,形成Büengner细胞带。以便日后新生轴突靠近和长入细胞带里,或可以让施万细胞依次地包裹新生轴突。因此,目前常用的海绵状或胶状的生物材料是不能把新生轴突长成线状的。我们用化学药物处理周围神经段,把活细胞溶解出来,剩下神经纤维的支架是最生理、最合适的。施万细胞进入无细胞的异体神经段后,便能沿着神经纤维的支架往前生长,排成直线的“队列”,等候新生轴突的来临。实验也证明这是最符合生理的要求。
国外Hadlock T(1998)用PLGA制成大口径的管,其直径为2.3mm,其中有5个纵向排列的小管腔,小管腔直径为500μm。引入施万细胞在小管内向前直线状生长,便成为一段人工神经。
我们早在1998年就设计出用PLGA丝的方法,让施万细胞长上,一个牵着一个排列成直线状,以便日后新生轴突可以靠近和钻进细胞带里,直长到神经的远端去。经实践证明是成功的。比用小管的方式容易操作。因此,目前我们是采用化学药物处理的周围神经段,即化学萃取的异体神经和PLGA丝两种形式的生物材料。前者还要受用异体神经为材料的限制,后者是质量可靠和用之不尽的生物材料。
有些学者认为细胞因子是组织工程学的三要素之一,取代三维结构。其实生物材料的三维结构是种子细胞生长发育必不可少的条件,而细胞因子虽然重要,但只要种子细胞生长得好,就能分泌它必需的细胞因子,不一定要另加细胞因子。
二、施万细胞的选择,与生物材料关系的研究
施万细胞是周围神经再生的主要结构和功能细胞,在神经再生过程中为轴突提供Büengner带,参与髓鞘形成,合成和分泌多种神经营养物质和细胞外基质成分,表达多种细胞黏附分子,对神经再生和功能恢复起着重要作用,因此用作组织工程化人工神经的功能细胞是最佳选择。神经组织工程中,与生物材料的相容性、黏附性和降解性决定支架材料对施万细胞的成活状态及生物活性,是构建神经移植体成功与否的关键。但是目前国内外这方面的研究仅多限于对材料上黏附的施万细胞形态学研究,未提出测定在三维结构的生物材料上培养施万细胞时,对其生物相容性、材料-细胞界面的黏附性以及生物材料要逐步降解,让出施万细胞生长空间等研究,大都不够完善。许多基本问题都要重新系统研究,才能使组织工程化周围神经移植物的研究有扎实的基础。这应包含将施万细胞接种在生物材料上形成一种类似周围神经的施万细胞-材料复合支架,进行体外培养,并采用MTT法、显微分光光度和显微图像分析技术、单细胞凝胶电泳法检测,以及直接把生物材料种入神经干里和再生室里观察其反应。还有施万细胞在生物材料上的黏附性和降解性都要加以研究,方能从多个角度分析施万细胞与生物材料的关系。
三、施万细胞与骨髓基质细胞的培养
(一)施万细胞的培养
获取施万细胞的途径可从乳鼠或成年鼠的周围神经取得。
1.乳鼠施万细胞的获取,分离,纯化
(1)实验材料
①动物:取3~8d龄近交系F344乳鼠20只。
②试剂:DMEM复合培养液,DMEM培养基、10%小牛血清、青霉素100U/ml、链霉素100μg/ml、碳酸氢钠。阿糖胞苷,Ⅱ型胶原酶,胰蛋白酶,多聚赖氨酸,抗S-100蛋白单克隆抗体,SP免疫组化试剂盒。
③设备:超净工作台,二氧化碳培养箱,离心机,倒置相差显微镜,恒温磁力搅拌器,10倍手术显微镜,计数板,24孔培养板,6孔培养板,25ml培养瓶,分析天平。
(2)获取方法
①取材:乙醚处死乳鼠后,75%乙醇消毒5min,用灭菌生理盐水冲洗后,放置在消毒方盘内。在超净工作台上,切取双侧坐骨神经和臂丛神经,置4℃Hank′s液中,10倍手术显微镜下仔细剥除神经外膜,用Hank's液冲洗3次,在培养皿中剪成1mm3大小的组织块。
②分步酶消化法分离施万细胞:将神经组织块置入10ml离心管中,加入0.2%胶原酶,37℃孵育20min,再加入等量0.25%胰蛋白酶消化15min,立即在试管中加入含血清培养液终止消化,仔细吸出上清液,再加入0.125%胰蛋白酶消化8min,重复1~2次,直到神经组织完全消化。在整个酶消化过程中反复吹打,使组织块充分消化。
③施万细胞的纯化:由于消化后的组织液,混有大量成纤维细胞,要进一步纯化,方能得到纯化的施万细胞。方法是将其消化液在1 000r/min离心3min,弃去上清液,加入DMEM复合培养液3ml。吹打混匀细胞后,接种于预涂有0.01%多聚赖氨酸的培养瓶中,5%CO2,37℃培养箱内孵育30min,15min时轻轻晃动一次。由于成纤维细胞贴壁快,首先黏附在培养瓶底,故最后悬液在培养中的主要为施万细胞。在30min后将未贴壁的细胞悬液吸出,接种到另一预涂有多聚赖氨酸的培养瓶中,重复上述操作1次,最后将未贴壁的施万细胞制成浓度为104/ml的细胞悬液。
也可用阿糖胞苷抑制成纤维细胞生长,获得纯度高的施万细胞。方法是将差贴后的施万细胞接种在已放有无菌盖玻片的6孔培养板中,培养24h后,加入含5μg/ml阿糖胞苷的DMEM培养液,培养48h后,换为正常DMEM复合培养液培养7d,每2d换液1次便可。
④施万细胞纯度的测定方法:施万细胞经S-100蛋白免疫组化染色后,在200倍显微镜下,利用LX-50曝光系统的取景框,每张玻片随机选择10个视野,计数每个取景框内的阳性细胞和阴性细胞数,并计算出阳性百分比,表示施万细胞的纯度(图13-3,彩图32)。

图13-3 培养出的大鼠的施万细胞(左),免疫组化方法染色S-100阳性(右)
2.成年大鼠施万细胞的收集及纯化乳鼠的神经可直接取材进行制备,成年大鼠就要做预损伤神经,2~4周后能取已退变的神经来收集施万细胞。
(1)材料、试剂与器械:与上述收集乳鼠施万细胞同。
(2)方法:100只SD大鼠(体重180~220g),每批10只,10%水合氯醛腹腔麻醉(0.3/100g),无菌条件下在梨状肌下缘切断双侧坐骨神经,逐层缝合伤口。术后10~14d,无菌条件下切取双侧瓦勒变性的坐骨神经。以后方法与上述收集乳鼠施万细胞同。
(二)大鼠骨髓基质细胞的培养与诱导分化为类施万细胞
大鼠骨髓基质细胞是用骨髓穿刺方法,取得骨髓后,采用贴壁筛选法分离大鼠的骨髓基质细胞,简便易行,经传代后细胞纯度可达到95%以上。
1.动物 取1个月左右的近交系F344大鼠20只。
2.试剂 DMEM复合培养液:DMEM培养基、15%胎牛血清、青霉素100U/ml、链霉素100mg/ml、碳酸氢钠10mM HEPES,2mM L-谷氨酰胺,D-Hank′s溶液,Ⅱ型胶原酶,胰蛋白酶,多聚赖氨酸,阿糖胞苷。
诱导分化试剂:β-巯基乙醇,全反式视黄酸,Forskolin,碱性成纤维细胞生长因子(bFGF),血小板源生长因子(PDGF),HRG,抗神经胶质纤维酸性蛋白(GFAP)单克隆抗体(NeoMarkers),抗S-100蛋白单克隆抗体,二抗试剂盒,Western试剂盒。
3.设备 SW-CJ-ZC标准型超净工作台,二氧化碳培养箱,低温高速离心机,倒置相差显微镜,BH-2光学显微镜,SXP-1手术显微镜,恒温磁力搅拌器,计数板,分析天平,高压灭菌蒸汽锅,电烤箱,微量可调移液器,24孔培养板,48孔培养板,25ml培养瓶。
4.骨髓基质细胞的分离纯化和扩增大鼠用乙醚处死,75%乙醇浸泡10min,无菌条件下取双侧股骨和胫骨,将其两端干骺端切除,显露骨髓腔。用D-Hank′s溶液冲洗骨髓腔,100 目不锈钢细胞筛过滤,1 000r/min下离心5min,将上清液小心吸去,加入10ml DMEM完全培养液(添加15%胎牛血清,10mM HEPES,2mM L-谷氨酰胺,100U/ml青霉素,100mg/ml链霉素),接种于25cm2培养瓶,37℃,5%CO2,湿度95%条件下培养。72h后全量换液,去除未贴壁细胞。以后每隔72h换液1次。待贴壁细胞融合达80%~90%后,0.25%胰蛋白酶37℃下消化,进行传代、扩增培养。骨髓基质细胞可多次传代(图13-4,彩图33)。
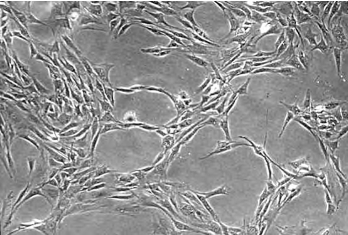
图13-4 培养出的大鼠的骨髓基质细胞
5.大鼠骨髓基质细胞的诱导实验 骨髓基质细胞达到亚融合后,去除培养液,加入预诱导液(DMEM培养基、1mMβ-巯基乙醇),37℃,5%CO2培养24h。去除预诱导液,0.01MPBS液(pH 7.4)清洗3次,加入预诱导液(DMEM培养基,10%FBS,35ng/ml全反式视黄酸)。37℃,5%CO2培养72h。去除预诱导液,0.01MPBS液(pH 7.4)清洗3次,加入诱导液(DMEM培养基,10%FBS,5μM Forskolin、10ng/ml bFGF、5ng/ml PDGF、200ng/ml HRG)37℃,5%CO2条件下进行诱导。诱导之后,0.01MPBS液(pH 7.4)清洗3次,4%多聚甲醛固定。观察诱导情况(图13-5,彩图34)。
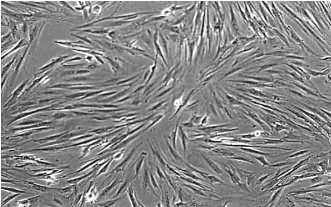
图13-5 从大鼠的骨髓基质细胞诱导成类施万细胞
(三)成年猴施万细胞的获取、分离、纯化
1.材料和试剂 食蟹猴2只;DMEM/F12、胰酶、胶原酶、M566、二甲基亚砜DMSO;抗S-100蛋白单克隆抗体。
2.施万细胞的培养 雄性2.5岁食蟹猴1只,0.4ml/kg盐酸氯胺酮肌注麻醉后,分别结扎两侧的腓肠神经和左腓总神经,1周后,取出结扎线远端的神经,置于15% DMEM/F12中,手术显微镜下剔除周围组织,从神经外膜抽出神经束,尽可能去除束膜,Hank液冲洗5次,剪成0.5mm3小的组织块。取1/3接种于涂有1%多聚赖氨酸的25cm2培养瓶,15%DMEM/F12“植块法”培养去除成纤维细胞。余2/3加入0.2%胶原酶2ml消化30min至丝絮状,再加入0.25%胰蛋白酶2ml消化20min,消化过程中每5min用吸管吹匀,15%DMEM/F12 4ml终止消化。400目滤器过滤,滤液1 000r/min离心5min后弃上清,加15%DMEM/F12制备成细胞悬液。滤网上残存的组织块用0.25%胰蛋白酶再消化10min,重复上述程序制成细胞悬液并与前混匀,等量接种于预涂有多聚赖氨酸等25cm2培养瓶。4d后换液,其中一瓶加入10-5 M终浓度的Ara-c,培养48h后换为正常15%DMEM/F12,以后隔2d换液,细胞铺满瓶底用0.25%胰酶传代培养(图13-6,彩图35)。

图13-6 猴的施万细胞
四、施万细胞与生物材料的生物
相容性的研究
(一)生物材料植入神经干内的研究
1.材料和方法
(1)主要试剂与仪器 0.1mol/L PBS,苏木精,伊红,甲苯胺蓝,手术显微镜(SXP-1B型),显微外科手术器械,福尔马林气体消毒柜,全封闭式脱水机,石蜡包埋机(EG1160型),组织切片机(SM2000R型),超薄切片机(651101型),光学显微镜(Axiotron),显微照相仪(MC-80型)。
(2)可降解高分子材料 聚乳酸(PLA)薄膜和壳聚糖(chitosan,CTS)薄膜。材料植入体内前剪成每块为10mm×3mm大小,在福尔马林气体消毒柜内熏蒸灭菌12h,然后用PBS漂洗3次,10min/次。
Vicryl可吸收编织缝线购自ETHICON公司,已灭菌包装。该缝线是由数百根直径为10μm的微丝编织而成,其成分是Polyglactin 910,即PLA和聚羟基乙酸(PGA)的共聚物——PLGA。植入体内前将缝线剪成每段10mm长,在手术显微镜下用显微器械打散成微丝。
2.实验动物手术方法 成年雄性SD大鼠,体重200~250g,10%水合氯醛腹腔注射麻醉(3ml/kg体重),无菌条件下做一侧大腿后正中切口分层切开,暴露坐骨神经,切开神经外膜,在神经束旁植入可降解高分子材料,分别植入Vicryl微丝、PLA薄膜和CTS薄膜,用9-0尼龙线将材料缝合固定在神经束膜上,分层缝合切口。
3.术后处理、观察与取材 麻醉苏醒后开始给予水和饲料,按常规喂养。观察动物的存活、饮食、步态和行为等一般情况以及足底溃疡、手术切口皮肤等局部情况。术后第6周,同法麻醉、暴露坐骨神经,肉眼观察植入部位神经外观的变化。切取植有可降解高分子材料的神经段分2份分别做石蜡切片和半薄切片。
4.石蜡切片标本的处理 10%中性福尔马林固定。梯度乙醇脱水:80%乙醇脱水40min;95%乙醇脱水3次,1h/次;无水乙醇脱水2次,40min/次。无水乙醇加二甲苯(1∶1)置换30min。二甲苯透明2次,30min/次。浸石蜡4次,40min/次。石蜡包埋,切片,片厚4μm。二甲苯脱蜡2次,5min/次。乙醇脱二甲苯:95%乙醇2次,5min/次;80%乙醇1次,5min;蒸馏水洗。
5.半薄切片标本的处理 预冷(4℃)的2.5%戊二醛前固定。PBS漂洗3次,15min/次。1%四氧化锇后固定90min。梯度乙醇脱水:50%、70%、85%、95%乙醇脱水各1次,15min/次;无水乙醇脱水2次,15min/次。丙酮脱水2次,15min/次。丙酮加环氧树脂Epon812(1∶1)包埋40min。纯环氧树脂Epon812在60℃下聚合48h。切片,片厚1μm。
6.切片苏木精-伊红(HE)染色、封片石蜡切片脱蜡水化后苏木精染色5min。蒸馏水洗10min。0.5%伊红染色3min。蒸馏水洗30s。脱水:95%乙醇和无水乙醇脱水各2次,30s/次二甲苯透明2次,3min/次。中性树胶封片(图13-7,彩图36)。

图13-7 PLA(左)、PLGA(中)和CTS(右)各组神经干内结缔组织轻度增生,外膜和束膜增厚,但无组织坏死或纤维化,未见神经纤维脱髓鞘或出现瓦勒变性
7.切片甲苯胺蓝染色、封片 半薄切片用1%甲苯胺蓝染色2~3s。蒸馏水洗30s。乙醇脱水,二甲苯透明,中性树脂封片。
(二)生物材料植入神经再生室的研究
此实验与“生物材料植入神经干内的研究”相似,只是生物材料植入的部位不同,前者是植入神经干里,神经束之间,直接观察神经对生物材料的生物反应。后者是把生物材料植入神经断端用硅胶管桥接的管腔里。观察新生的神经轴突在生长过程对生物材料的生物反应。所需的器材、试剂、手术方法和术后的观察指标相似。
施万细胞-材料复合支架的体外培养(用MTT法、显微分光光度和显微图像分析技术、单细胞凝胶电泳法检测)。
1.材料与试剂。直径约为10μm的PLGA微丝是由乙交酯和丙交酯联合组成的90∶10共聚物;直径约为10μm的GCC纤维;ECM凝胶;抗S-100蛋白单克隆抗体;MTT。
2.支架制备。
(1)消毒:将PLGA微丝和GCC纤维(对比组)置于75%乙醇中浸泡30min,再用消毒生理盐水冲洗3次,超净台上晾干待用。
(2)生物学修饰:种植施万细胞前,PLGA微丝和GCC纤维在30%的4℃ECM凝胶溶液中浸泡约1min。
3.施万细胞的分离和培养。见上述施万细胞的分离和培养部分。
4.施万细胞在人工神经支架材料上的三维培养。实验分组如下。
(1)PLGA组:把密度为1×106/ml的原代施万细胞悬液接种在铺满PLGA微丝支架的24孔板上,每孔约5 000根制备好的PLGA纤维支架,支架长10mm。
(2)GCC组:同法将施万细胞接种在铺满GCC纤维支架的24孔板上,GCC纤维的数量与长度同A组。
(3)NCG组:将细胞悬液直接接种在24孔培养板上。
接种施万细胞后,5%CO2,37℃培养箱内孵育24h,换为正常DMEM复合培养液培养7d,每2d换液1次。倒置显微镜下观察施万细胞在各组支架材料上的生长情况。
5.扫描电镜观察。取PLGA、GCC纤维与施万细胞复合培养7d的标本,用D-Hank′s液轻轻漂洗3次,2%戊二醛固定后,PBS漂洗,乙醇逐级脱水,临界点干燥,离子喷射仪喷金,日立S-450型扫描电镜观察。
6.MTT法测定施万细胞活性。见本章的“组织工程化周围神经的检测技术”部分。
7.显微分光光度和显微图像联合分析法评价施万细胞活性。见本章的“组织工程化周围神经的检测技术”部分。
8.单细胞凝胶电泳法测定施万细胞DNA受损程度(图13-8,彩图37)。见本章的“组织工程化周围神经的检测技术”部分。
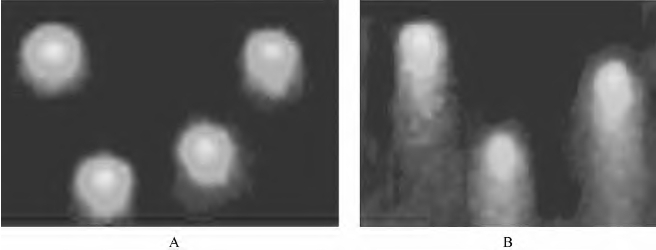
图13-8 单细胞凝胶电泳法及显微分光光度和显微图像联合法测定施万细胞在生物材料上的生长时,DNA是否有损害
注:A.PLGA组施万细胞彗星电泳图(无损害);B.GCC组(戊二醛交联甲壳糖)施万细胞彗星
电泳图(有损害)
五、施万细胞与生物材料的
黏附性的研究
(一)施万细胞与生物材料在普通细胞培养器的培养
见上述施万细胞的分离和培养部分。
(二)施万细胞与生物材料在微重力环境下的培养
微重力组织工程是近年来由美国空间生物技术研究人员开创的一个独特研究领域,其核心技术是建立动物细胞的三维培养体系,具体研究工作主要是利用转壁式生物反应器(Rotating Wall Vessel Bioreactor,RWVB)形成的模拟微重力环境来进行。本研究初步探讨模拟微重力对施万细胞在人工支架材料上三维培养的影响。
1.材料与试剂 RWVB及直径约为15μm的亲水性PLGA细丝支架。主要试剂:Laminin,CollagenaseⅡ,Trypsin-EDTA,DFBS,DMEM/F12。
2.方法
(1)支架材料的制备:①将PLGA细丝于75%乙醇中浸泡30min消毒灭菌,消毒生理盐水中过水三次洗去残留乙醇成分后放置超净台上晾干;②PLGA细丝完全浸入1mg/ml的Laminin溶液中,1min后取出于超净台上晾干备用。
(2)施万细胞的分离:见上述施万细胞的分离和培养部分。
(3)在普通重力条件下把1×105密度的施万细胞接种在PLGA细丝支架上培养3~14d,然后分别把贴附在支架上生长3、7、10和14d的施万细胞移入RWVB中旋转培养5d(旋转速度根据培养物的大小来调节,保证培养物长时间保持悬浮状态),每天取样观察,并同时换液约1/4量。取下的样本重新置于普通重力环境中,分开单独培养及与正常贴壁施万细胞共同培养二组继续培养3d,每天半量换液。另外,取旋转培养1d后的培养液,作为普通重力环境中在培养皿底部及支架上贴壁生长3d的施万细胞的培养液,继续培养3d,每天半量换液。
(4)把分离的原代施万细胞悬液与PLGA细丝直接加入RWVB,注满DMEM/F12培养液后测施万细胞密度为1×103,旋转培养5d,其中于第3天半量换液1次。每天取样观察,取下的样本也重新置于普通重力环境中继续培养3d(图13-9,彩图38)。
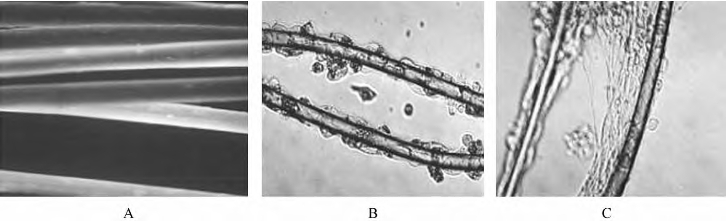
注:A.PLGA微丝外观;B.PLGA微丝经生物学修饰后施万细胞大量附着,排列成线状;C.在模拟微重力条件下培养。施万细胞的利用率更高,细胞在支架表面的分布更均匀
六、施万细胞与生物材料的
降解性的研究
(一)生物材料的体外降解性的研究
1.主要材料、试剂和仪器 PLGA微丝,0.1MPBS(pH=7.2~7.4),苏木精,伊红,电子恒温水浴箱(HH-W21-Cr420Ⅱ型),pH计(pHS-25型),手术显微镜(SXP-1B型),显微外科手术器械,福尔马林气体消毒柜,全封闭式脱水机,石蜡包埋机(EG1160型),组织切片机(SM2000R型),超薄切片机(651101型),光学显微镜(Axiotron),显微照相仪(MC-80型),透射电子显微镜(H-600型)。
2.微丝体外降解试验 将PLGA微丝放入6支中号试管,然后加入相当于微丝10倍体积的PBS(约20ml),静置在37℃的水浴中。每周用pH计测定1次降解介质(PBS)的pH值,更换新鲜的PBS。在第2、4、6、8、10、12周,每组各取出1支试管,用10倍手术显微镜观察微丝大体形貌的改变,并牵拉、折叠和用吸管吹打微丝,了解其力学性能变化。
(二)生物材料的体内降解性的研究
1.实验方法 20只成年雄性SD大鼠,体重200~250g,以10%水合氯醛(3ml/kg体重)腹腔内注射麻醉,无菌条件下作双侧大腿后正中切口分层切开暴露坐骨神经,切开神经外膜,随机选择一侧在神经束旁植入Vicryl微丝束,另一侧(对照侧)植入PLA微丝束,用9-0尼龙线将微丝束固定在神经束膜上,最后分层缝合切口。于术后第1、2、4、8、12周切取植有微丝的神经段分成2份,用光学显微镜和电子显微镜观察。
2.标本的处理 参照上述标本的处理切片和HE染色方法。电子显微镜检查标本的固定、脱手、包埋方法参照上述方法处理,组织块行超薄切片,片厚50nm,醋酸铀和柠檬酸铅双重染色后在透射电镜下观察(图13-10,彩图39)。

图13-10 PLA微丝与PLGA微丝的体内降解性的试验
七、天然的生物材料——化学萃取异体神经移植物
去除天然生物组织的细胞而保留其纤维性骨架,这是制备组织工程生物材料的另一途径。通过化学萃取方法,可制备大鼠和人的异体去细胞神经支架。
(一)化学萃取异体神经移植物所需的主要试剂和仪器
Triton X-100,脱氧胆酸钠,砂罗铬花青,硫酸铁铵,荧光桃红B,0.1MPBS,0.01M柠檬酸缓冲液(pH=6.0),鼠抗人S-100蛋白单克隆抗体(即用型),二步法免疫组化试剂盒,DAB显色剂,手术显微镜(SXP-1B型),显微外科手术器械,磁力搅拌器(81-2型),微波炉(W7022J型),全封闭式脱水机,石蜡包埋机(EG1160型),组织切片机(SM2000R型),光学显微镜(Axiotron),显微照相仪(MC-80型)。
(二)化学萃取人体异体神经支架的制备
人体神经取自一大腿截肢患者捐献的废弃肢体,切除其胫神经,自股骨髁至内踝全长40cm。将神经截成4段,每段10cm,取其中3段神经按下列步骤进行萃取,余下的新鲜神经作对照。
1.在10倍手术显微镜下剪去神经外的脂肪和部分神经外膜,保留神经束以及连接神经束的部分外膜。蒸馏水浸泡6h,每2h换液1次。放入3%Triton X-100溶液中,室温下静置12h。蒸馏水漂洗3遍,每次10min。放入4%脱氧胆酸钠溶液中,室温下震荡24h。蒸馏水漂洗3遍,10min/次。
2.取出1段神经保存在PBS中,标记为1号标本。余下2段神经重复萃取第2次,又取出1段神经保存在PBS中,标记为2号标本。最后1段神经标记为3号标本,同法萃取第3次。
3.标本的处理。切取1、2、3号标本中间一段长3cm的组织,另取1段新鲜胫神经作对照。用10%中性福尔马林固定标本,石蜡包埋,切片,脱蜡,水化。行HE染色。
4.砂罗铬花青染色。石蜡切片脱蜡、水化后砂罗铬花青染色15~20min。流水冲洗2min。10%硫酸铁铵水溶液分化3min左右,显微镜下控制,至胶原纤维接近无色,髓鞘呈清晰的蓝色。流水冲洗8min。荧光桃红染液复染数秒。稍水洗后乙醇脱水,二甲苯透明,中性树脂封片(图13-11,彩图40)。
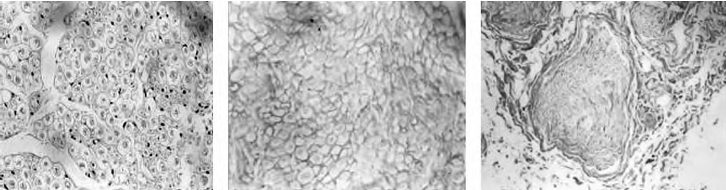
图13-11 左图是新鲜神经的横切面,见排列规则的神经纤维和施万细胞(HE,40×);中图是神经萃取后的横切面,神经纤维和施万细胞均已消失,仅见网络状纤维(HE,40×);右图是神经萃取后的横切面,神经束内未见蓝染的神经髓鞘(砂罗铬花青,10×)
5.S-100免疫组化染色。见第三节“组织工程化周围神经的检测技术”。
(三)人体化学萃取异体神经移植的组织学反应
1.人体神经的来源与处理 人体神经取自大腿截肢标本,无菌条件下取出胫神经长8cm,分成2段,每段长4cm。用显微器械在10倍手术显微镜下将萃取神经和新鲜神经分离出直径1mm左右,长20mm的神经小束,每组各12束。
2.动物分组与手术方法 SD大鼠雄性,体重200~250g,10%水合氯醛腹腔内注射麻醉(3ml/kg体重),无菌条件下作一侧大腿后正中切口,暴露并游离坐骨神经,切除20mm长一段神经,采用不同的神经移植体修复神经,在10倍手术显微镜下用9-0尼龙线作神经外膜缝合。用20mm长的人体萃取神经和新鲜神经移植修复,将切除的自体神经移植修复作对比。修复神经后分层缝合切口,按常规饲养动物(图13-12,彩图41)。

图13-12 神经萃取后的横切面
3.标本取材与检测 分别在术后第1、2、4周,切取神经移植体中段长5mm的标本,固定、包埋、切片和HE染色。在光学显微镜下观察移植体引起的组织反应。
(四)大鼠的化学萃取异体神经移植物的方法
1.萃取方法与人的异体神经处理相同,从略。
2.结论:PLGA微丝和化学萃取异体神经支架都是构建组织工程化周围神经移植物非常合适的生物材料。
八、组织工程化周围神经移植物构建的动物实验
(一)大鼠的组织工程化周围神经移植物构建的实验
1.材料 PLGA丝,胶原膜片:BME-10X型医用组织引导再生胶原膜采用从牛腱中提取、用酶消化法得到的胶原蛋白为主要原料,厚度0.20±0.05mm,呈网状结构的半透性膜,具有生物可吸收性。
2.组织工程化人工神经的构建
(1)施万细胞培养:按前文所述方法分离施万细胞,经双30min差速贴壁后制成1× 106/ml的细胞悬液。
(2)施万细胞和PLGA纤维复合培养构建人工神经:PLGA纤维经75%乙醇消毒后,在30%的ECM凝胶溶液中浸泡1min,将1×106/ml的施万细胞悬液种植在PLGA纤维上,5%CO2,37℃培养箱内孵育24h后,加入含5μg/ml阿糖胞苷的DMEM培养液孵育48h,再换成普通培养液孵育3~4d。倒置显微镜下观察施万细胞形态,当施万细胞变成双极梭形,两极伸出细长突起,几乎每根丝的各个部位均有单层或多层施万细胞黏附时,放入体内。放入体内前为防止施万细胞流失,吸出培养液,将50%的ECM凝胶滴加在PLGA纤维上,培养1~2h,使其呈凝胶状。
(3)实验:取雄性F344大鼠,体重120~170g。将胶原膜(长12mm,宽6mm)内放置约480根黏附有施万细胞的PLGA纤维,并用10-0的无损伤线缝合成管状,作为神经移植物备用。
(4)手术操作:10%水合氯醛(3ml/kg)腹腔麻醉后,剪毛,5%碘酒、75%乙醇消毒皮肤。无菌条件下,取鼠双侧大腿(每组5只,只对右侧进行步态分析)纵行切口,暴露坐骨神经全长,从梨状肌下缘起造成10mm神经缺损。用10-0无损伤线对端缝合神经移植物与神经断端缝合。缝合臀大肌与皮肤。术后观察局部伤口愈合及足底有无溃疡形成。
(5)评价方法:采用组织学测量法、神经电生理检测法、坐骨神经指数检测法评价其结果(图13-13)。
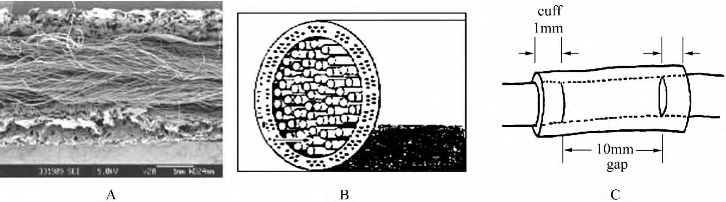
图13-13 预制的组织工程化周围神经移植物
注:A.电镜纵切面;B.示意简图;C.植入神经缺损示意图
(二)恒河猴的组织工程化周围神经移植物构建的实验
参见上述“大鼠的组织工程化周围神经移植物构建的实验”与“恒河猴的尺神经缺损修复手术”进行实验。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














