应用集合体进行物质的量的教学尝试
戴成明
一、存在问题
物质的量教学中很难克服知识容量大、在教学时段内难以完成教学任务的困难。而后续课程中涉及的物质的量部分知识又很全面,若教学过程进行得不扎实会影响后续课程的学习。为了解决这一困难,我尝试用“集合体”的思想进行教学。
二、教学设计
背景
![]()
为什么所取的反应物没有剩余?要说明这一原因,必须引入一新的物理量——物质的量。
1.集合体
(1)标准集合体
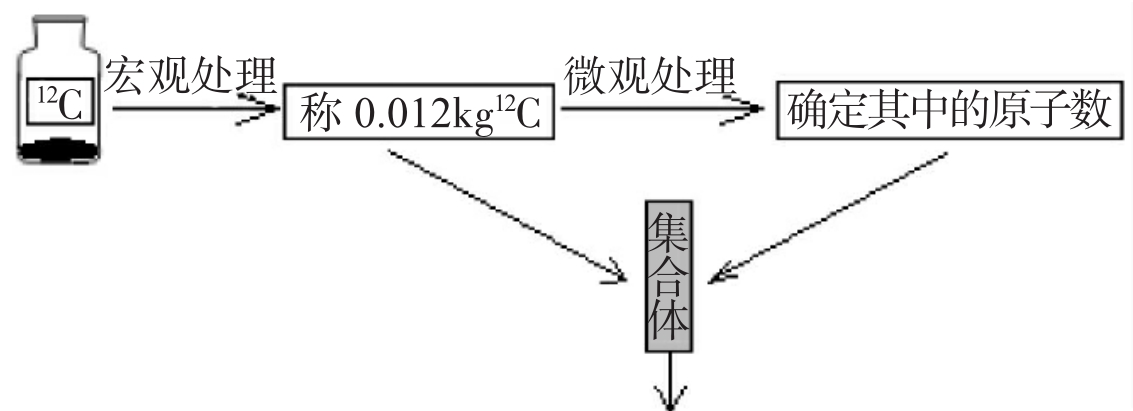
其中12c原子数=NA=6.02×1023
把任何含粒子数为NA个的物质都当作一个集合体,即标准集合体。
会定义其他集合体:Al、H2O、CH4、CH4和C2H4混合物、MgCl2、MgCl2和Na2CO3混合物。
(2)集合体的参数
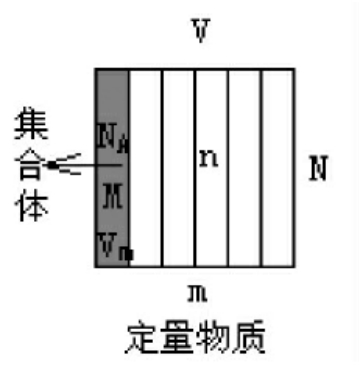
参数 集合体应为宏观量,是1单位物质的量的物质,即1摩尔物质,一般用质量、体积和微粒数NA(定义集合体参数)来描述如右图。
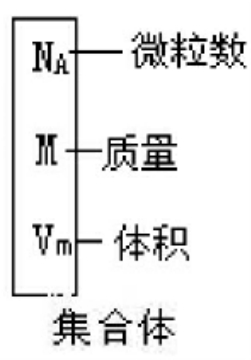
微粒数NA 集合体的粒子数(定义集合体参数),称做阿伏加德罗常数,约等于6.02×1023mol-1。
微粒类型AL——原子做H2O、CH4、和C2H4——分子,Mgcl2、Mgcl2和Na2CO3——形式分子。
质量M 称做摩尔质量,单位为:g/mol,数值:观察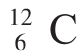 集合体的摩尔质量为12g/mol,推测,AL—27g/mol、H2O—18g/mol、CH4—16g/mol,且得M=粒子的相对质量+g/mol。
集合体的摩尔质量为12g/mol,推测,AL—27g/mol、H2O—18g/mol、CH4—16g/mol,且得M=粒子的相对质量+g/mol。
对于CH4和C2H4混合物、MgCl2和Na2CO3混合物,M不仅与粒子的相对质量有关,而且与两种粒子的个数有关,即与混合物的组成有关。
体积Vm称做摩尔体积,下面我们来探究摩尔体积的问题。
①完成教材中的科学探究,从宏观上认识固、液体的摩尔体积(集合体的体积),是一不定值气体的气摩尔体积当温度和压强一定时,基本是一定值。
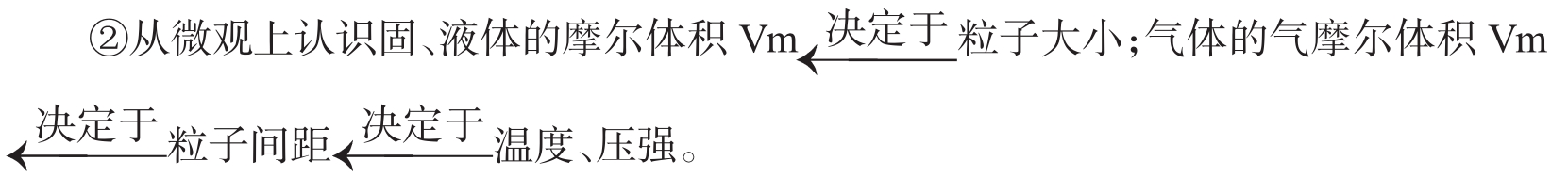
所以,固、液体的摩尔体积(集合体的体积)不定,没用。而气体的摩尔体积(集合体的体积)在温度、压强一定时可看成是一恒定值,有用。因此,摩尔体积我们只应运用气体的摩尔体积,即气体摩尔体积,且标准状况下为22.4mol/L,常温常压下为24.5mol/L。
结论:①气体摩尔体积决定于温度和压强,当温度和压强一定时,Vm是一恒定值。
②当然,气体体积决定于温度,压强、以及气体的物质的量。当气体的温度和压强一定时,气体的体积也就决定于气体的物质的量。
2.物质的量
(1)含义 取定量物质(如下图),想象可按粒子数分出好多个集合体,这集合体的总数就是物质的量。则有①N=NA·n②m=M·n③V=Vm·n(基本关系式),且有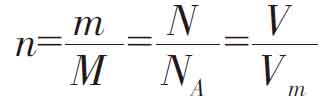 (万能公式),且同一物质密度相同
(万能公式),且同一物质密度相同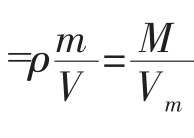 。
。

②集合体中的粒子类型:
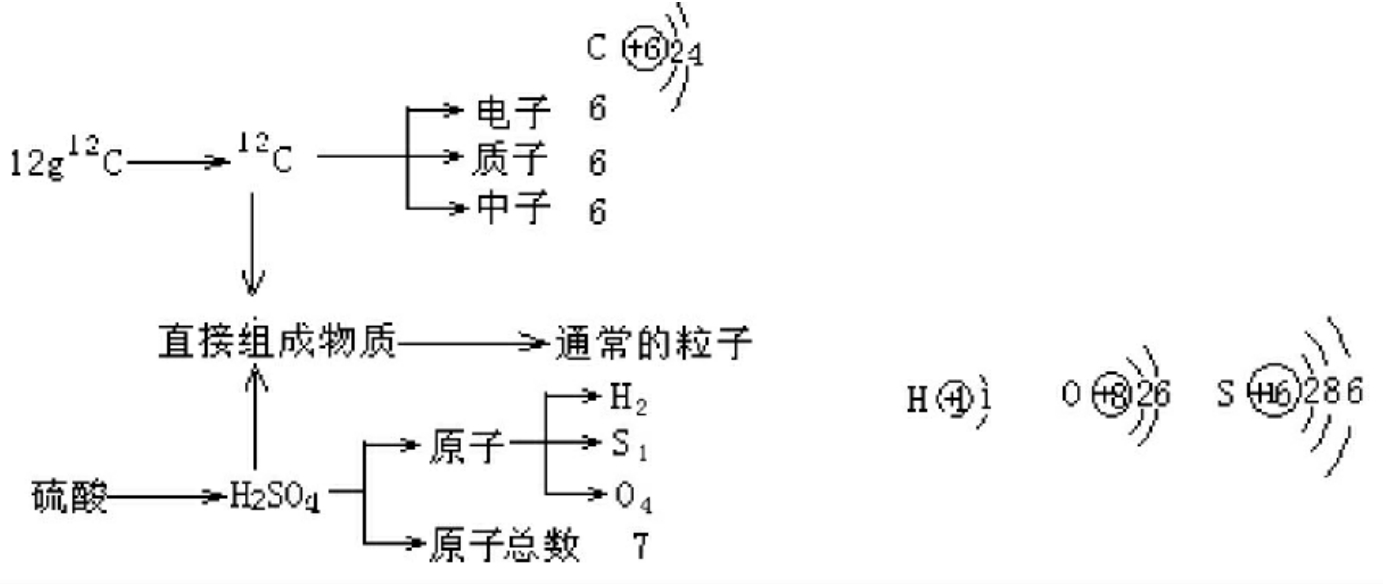
![]()
观察上图有:小微粒数=大微粒数×下标(大粒子直接形成物质,小粒子是物质中更小的粒子)即粒子形式N小=N大×下标(形式下标)
在上式两边同除NA得物质的量形式n小=nx×下标(形式下标)
(3)比例式:
 也可由n、m和M换成比得来,即将基本公式中的n、m和M字母直接换成比例字母,得
也可由n、m和M换成比得来,即将基本公式中的n、m和M字母直接换成比例字母,得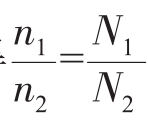 (NA为定值)
(NA为定值)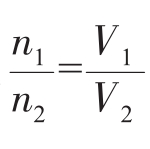 (同温同压下,因为在同温同压下Vm相同)
(同温同压下,因为在同温同压下Vm相同)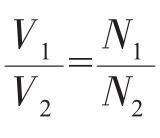 (同温同压下,因为在同温同压下Vm相同)这就是阿伏加德罗定律。n
(同温同压下,因为在同温同压下Vm相同)这就是阿伏加德罗定律。n
②同温同体积下,气体的压强与物质的量成正比。对于一反应体系(包括密闭体系),气体总的物质的量之比等于压强比,即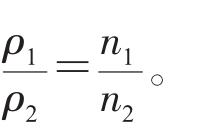
③同温同压下,同体积的任何气体的质量比等于摩尔质量之比,等于密度之比,即
④同温同压下,相同质量的任何气体的体积比等于摩尔质量之反比,即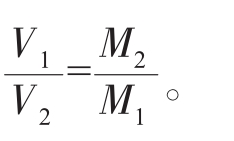
⑤同温同体积时,等质量的任何气体的压强之比等于摩尔质量的反比,即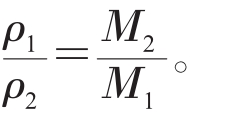
⑥当温度相同,物质的量也相同时,气体的体积与压强成反比,即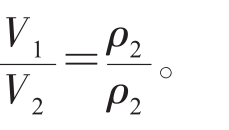
3.物质的量浓度
观察右图,溶质的物质的量浓度也是集合体的思想。以体积为1L的溶液作集合体,取集合体参数(溶质的物质的量)作溶质的物质的量浓度的数值,单位为:mol/L
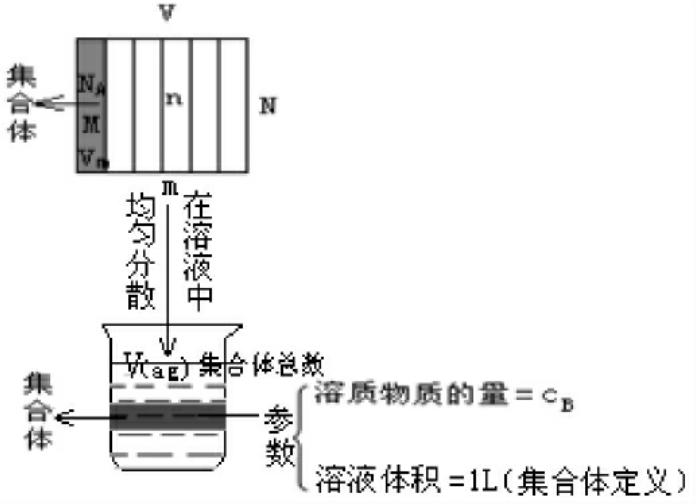
从图上得出: n=cB×V(ag)
投入到水中的溶质物理量间的关系如下:
![]()
在n小=n大×下标两边同除V(ag)得
物质的量浓度形式c小=c大×下标(形式下标)
三、教学体会
1.引入集合体的概念后,教学很省时,学生也很容易建立起基本关系式。
2.引入集合体参数的概念后,便于学生找出摩尔质量、阿伏加德罗常数、气体摩尔体积、物质的量浓度等概念间的共同点与差别,便于学生准确理解这些概念。
3.物质中微粒类型、大小粒子关系、万能公式及比例式的介绍和运用使学生既对物质的量的概念的理解层次得到了提升,又在知识的加工中提高了综合运用知识的能力,也体现了知识的全面性。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















