维持蛋白质特定空间构象的因素包括:氢键、盐键、疏水作用、金属配位键和二巯键等,分离纯化蛋白质的靶点正是这些因素。蛋白质分离纯化的方法主要有以溶解度为基础的分离方法,如盐析、有机溶剂分级、萃取、结晶等;以静电相互作用为基础的蛋白质的分离方法,如电泳、等点聚焦、离子交换层析和层析聚焦技术等;以分子大小为基础的蛋白质分离方法,如超离心、凝胶过滤、超滤等;以疏水作用为基础的蛋白质分离方法,如疏水层析、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)、染料结合层析等;以生物活性为基础的蛋白质分离方法;以配位键和二巯键为基础的蛋白质分离方法等。下面介绍几种常用的蛋白质分离方法。
(一)盐析
蛋白质在水溶液中以两性电解质的形式存在,蛋白质分子表面有一层溶剂化的水分子。当溶液中的离子强度比较低的时候,蛋白质的溶解度会随着盐浓度的增加而增加,这种现象叫做“盐溶”(salting in);当溶液中的离子强度比较高的时候,几乎所有的蛋白质溶解度都会随着盐浓度的增加而降低,更多的水分子从蛋白质表面转移到离子表面,使蛋白质分子相互作用的机会增多,进而导致蛋白质分子间的相互作用,使蛋白质沉淀,这种现象叫做“盐析”(salting out)。一定的盐浓度下,每种蛋白质都有一个不同的特异溶解度。这样,如果将溶液中盐的浓度调到某一值时,将有一组溶解度接近的蛋白质以沉淀的形式被盐析出来。经过大量实践比较,人们发现利用硫酸铵进行这种盐析时,效果最好。盐析一般用于对细胞抽提液的粗提纯。具体操作时,一般通过逐渐增加硫酸铵的浓度,并获得每一浓度下的沉淀,收集含有目标蛋白的那些沉淀,进行再溶解和透析后做进一步的纯化(图6-3)。
(二)离子交换柱层析
目前蛋白质化学中使用最广的分离方法之一是离子交换柱层析。其原理是利用物质的电荷和层析载体的电荷间的相互作用,达到分离纯化的目的。离子交换柱层析利用的是表面被带有正或负电荷基团修饰过的树脂均匀组装成的柱子。在一特定的pH条件下,某蛋白混合液体系中,每一种蛋白质所带正负电荷的净值是不同的。这样,当将蛋白混合液(所含盐的浓度不能高)流经在同样pH条件下也带电的树脂层析柱时,其中的部分蛋白质分子将不与树脂颗粒结合(如果在给定pH条件下蛋白与树脂都带相同电荷或蛋白质所带净电荷为零的话),而直接穿过层析柱跑出来;另外一部分表面所带净电荷与树脂颗粒表面所带电荷相反的蛋白质就被结合在树脂上而停止前进了。因为不同蛋白质所带电荷的净值是不同的,所以每一种蛋白质结合在树脂颗粒上的紧密程度也是有差异的。等到不结合的蛋白质全部跑出柱子(这一步需要一定的时间)、结合的蛋白质已经很好地结合了之后,如果再用盐浓度逐渐提高的溶液进行洗脱(elute)的话,结合在树脂颗粒上的蛋白质分子将根据各自结合的紧密程度依次分批地、在不同的盐浓度下被盐分子中与蛋白质所带静电荷相同的离子交换(和洗脱)下来:结合最松的最先被交换下来,结合最紧的最后被交换下来。
根据树脂表面所带电荷的不同,离子交换层析可分为两类。一类是树脂颗粒表面带正电荷,这类树脂可以结合带负电的蛋白质分子,结合之后的蛋白质分子被盐中的阴离子交换下来,这类离子交换层析称为阴离子交换层析(anion-exchange chromatography);另一类正好相反,树脂颗粒表面带负电荷,结合带正电荷的蛋白质,这类层析被称为阳离子交换层析(cationexchange chromatography)。
离子交换层析也有浓缩样本的作用,这种层析基本适用于亲水性的蛋白质的分离,由于从离子交换层析所选用的树脂类型以及样本洗脱的条件,可以得出样本带电行为的一些信息,再者,离子交换树脂价格低廉,因此广泛用于蛋白质等生物活性物质的制备(图6-4)。
(三)凝胶过滤层析
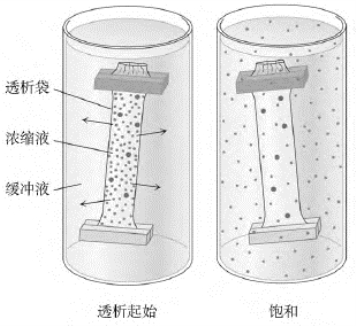
图6-3 盐析方法
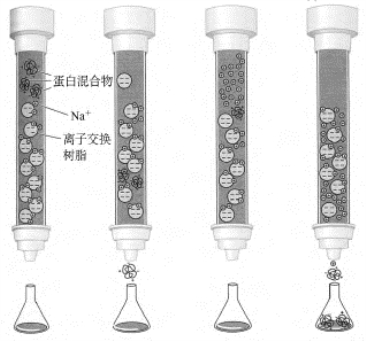
图6-4 离子交换柱层析方法
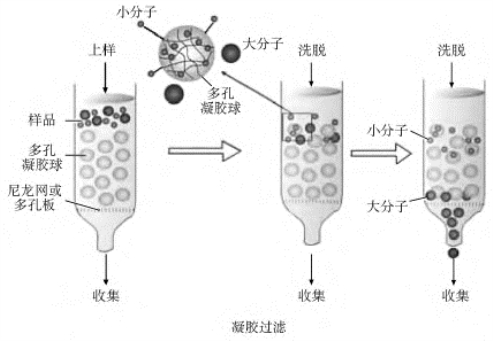
图6-5 凝胶过滤层析方法
凝胶过滤层析也称为体积排阻层析或分子筛层析(图6-5)。它依据的是多孔的载体对不同体积和不同形状分子的排阻能力的不同,从而对混合物进行分离。分离蛋白质混合溶液的凝胶过滤层析是根据天然(未经变性)蛋白质分子之间大小(球形蛋白的直径)的差异而进行分离的一种方法。主要利用的是用聚丙烯酰胺、葡聚糖或琼脂糖等制备的具有一定孔径的惰性有孔微珠。当蛋白混合液流经由这样的微珠组装而成的柱子的时候,那些直径大于微珠孔径的蛋白质分子将被排除在微珠上的小孔之外,而从微珠之间往下流;那些直径比微珠孔径小的蛋白质分子将可以进入这些小孔,并逗留一些时间。这样,蛋白分子的直径越大,“跑”得就越快,直径越小,“跑”得就越慢。基于以上的特征,这种层析技术被称为排阻层析(size-exclusion chromatography)或凝胶过滤层析(gel filtration chromatography)。
凝胶过滤最大的不足之处是,整个过程中样本非但不能浓缩,反而不断地在稀释,同时上样量又不能太大,否则分辨率变差。为此,进行凝胶过滤的样本的浓度越大越好。
(四)亲和层析
几乎所有的蛋白质都具有其特定的生物功能,因此可将和蛋白质相互作用的分子作为配基,固定在载体上,就可以通过亲和作用对蛋白质进行特异的非常有效的分离。能够与目标蛋白特异结合的配基分子通过共价键被固定在固体微珠上,当蛋白混合液穿过用这样的微珠组装而成的柱子的时候,只有目标蛋白会结合在微珠表面而停止前进,所有其他蛋白都会很快从柱子底部流出。等杂蛋白全部流出之后,再通过一定的尽可能温和的手段将目标蛋白从柱子中洗脱下来。如果这种配基与蛋白的相互作用是高效特异的,只需过一次这样的亲和层析柱就可把目标蛋白从含有成千上万种不同蛋白的混合液中分离出来。能够用作亲和层析的配基包括酶的底物、抗体、DNA片段以及其他能与蛋白特异结合的任何可固定在固体颗粒上的大小分子。
亲和层析最大的特点是高效简便,一旦固定化配基制备后,使用非常方便,通常情况下,只要在上样后洗去杂质,就可将所要的物质解吸下来,而且所得的物质具有较高的纯度。亲和层析的过程也是高度浓缩的过程(图6-6)。亲和层析还有另外两个优点,是其他分离方法所不能比拟的:一是可以从样本中除去大量的杂质,产率较高地获得少量的物质;二是可以在活性物质中除去理化性质几乎完全相同的但已失活了的“杂质”,这一点对提高酶或其他分子的比活特别有用。
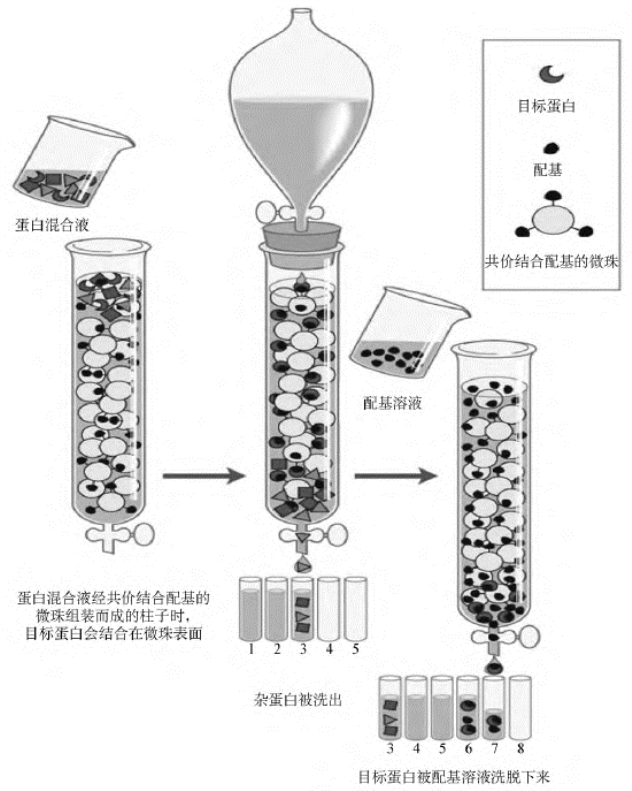
图6-6 亲和层析方法
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。

















