领会溶度积概念,掌握沉淀溶解平衡
一、本节主要知识概括
1.溶度积的一般表示式为:
AmBn(固 )mAn++nBm- Ksp=[An+]m·[Bm-]n
)mAn++nBm- Ksp=[An+]m·[Bm-]n
在一定温度下,Ksp是一个常数。它表示在难溶电解质的饱和溶液中,以系数为乘幂的离子浓度的乘积。
2.在一给定的难溶电解质溶液中,它们的离子浓度的乘积和溶度积之间存在三种可能情况。
⑴Qi=Ksp此时难溶电解质达到沉淀溶解平衡状态,溶液是饱和溶液。
⑵Qi>Ksp溶液中将析出沉淀,直到溶液中的Qi=Ksp为止。
⑶Qi<Ksp溶液为不饱和溶液,将足量的难溶电解质固体放入此溶液中,固体将溶解,直到溶液中Qi=Ksp时,溶液达到饱和。
二、本章知识的例题解析
例1.写出难溶电解质Fe(OH)3、Ca3(PO4)2的溶度积表达式
解析:根据溶度积的表示式,可得:

本题是溶度积的表示式在具体难溶电解质中的简单应用,需要记住公式代入既可。
例2.已知室温时AgBr的溶解度是8.8×10-7mol/L,MgNH4PO4溶解度是6.3×10-5mol/L,求AgBr、MgNH4PO4的溶度积?
解:AgBr(固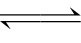 )Ag++Br-
)Ag++Br-
∵溶解的AgBr可认为完全电离
∴[Ag+]=[Br-]=8.8×10-7 mol/L
Ksp[AgBr]=[Ag+][Br-]=(8.8×10-7)2=7.7×10-13
同理MgNH4PO4(固) Mg2++NH4++PO43-,因为溶解的Mg(NH4)PO4可认为完全电离,
Mg2++NH4++PO43-,因为溶解的Mg(NH4)PO4可认为完全电离,
∴[Mg2+]=[ ]=6.3×10-5 mol/L
]=6.3×10-5 mol/L
∴Ksp[Mg(NH4)PO4]=[Mg2+][ ]
]
=(6.3×10-5)3=2.5×10-13
所以,AgBr的溶度积为7.7×10-13,Mg(NH4)PO4的溶度积为2.5×10-13。
本题是难溶电解质溶解度与溶度积的互换简单计算,实际上还是溶度积的表示式的综合运用。
例3.将5mL1×10-5mol/L的AgNO3溶液和15mL4×10-5 mol/L的K2CrO4溶液混合时,有无砖红色Ag2CrO4沉淀生成,已知Ag2CrO4的Ksp=9×10-12
解析:混合后溶液总体积为15+5=20(mL)
∴混和溶液中Ag+离子与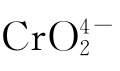 离子的浓度分别为:
离子的浓度分别为:
[Ag+]=1×10-5× =2.5×10-6(mol/L)
=2.5×10-6(mol/L)
[Cr ]=4×10-5×
]=4×10-5×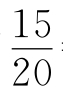 =3×10-5(mol/L)
=3×10-5(mol/L)
∴离子积Qi=[Ag+]2[]=(2.5×10-6)2(3×10-5) =1.9×10-16
=1.9×10-16
已知Ksp[Ag2CrO4]=9×10-12
∵Qi<Ksp,∴无Ag2CrO4沉淀生成
本题是离子浓度的乘积和溶度积知识的运用,Qi=Ksp此时难溶电解质达到沉淀溶解平衡状态,溶液是饱和溶液;Qi>Ksp溶液中将析出沉淀,直到溶液中的Qi=Ksp为止;Qi<Ksp溶液为不饱和溶液,将足量的难溶电解质固体放入此溶液中,固体将溶解,直到溶液中Qi=Ksp时,溶液达到饱和。
例5.取0.1mol/L的Pb(NO3)2溶液5mL,加入0.1mol/L的NaCl溶液10mL,观察现象弃去上层溶液,在沉淀中滴入0.1mol/L的Na2S溶液,有什么现象?为什么?
解析:现象是Pb2+离子与Cl-离子结合生成白色的PbCl2沉淀(Ksp[PbCl2]=1.6×10-5)。滴加Na2S后,白色沉淀消失,黑色的PbS沉淀生成(Ksp[PbS]=1×10-28)。
这种过程可表示为:
PbCl2(s )Pb2++2Cl-
)Pb2++2Cl-

PbCl2白色沉淀与溶液中的Pb2+、Cl-离子建立了溶解平衡,当加入Na2S溶液时,S2-离子与Pb2+离子生成黑色沉淀PbS,此时PbS与溶液中S2-离子、Pb2+离子又建立新的沉淀溶解平衡。由于PbS的Ksp(1×10-28)小于PbCl2的Ksp(1.6×10-5),PbS的沉淀溶解平衡破坏了PbCl2的沉淀溶解平衡。由于Pb2+离子浓度的降低,使得PbCl2的平衡不断向右移动,PbCl2不断溶解,PbS不断生成。
本题是应用溶度积对几种难溶电解质之间在溶液中转化情况进行定量分析,Ksp越小,这种难溶电解质越优先沉淀出来。
三、巩固练习
一定温度下,难溶电解质在饱和溶液中各离子浓度幂的乘积是一个常数,这个常数称为该难溶电解质的溶度积,用符号Ksp表示。
即:AmBn(s )mAn+(aq)+nBm-(aq)[An+]m·[Bm-]n=Ksp
)mAn+(aq)+nBm-(aq)[An+]m·[Bm-]n=Ksp
已知:某温度时,Ksp(AgCl)=[Ag+][Cl-]=1.8×10-10
Ksp(Ag2CrO4)=[Ag+]2[ ]=1.1×10-12
]=1.1×10-12
试求:
(1)此温度下AgCl饱和溶液和Ag2CrO4饱和溶液的物质的量浓度,并比较两者的大小。
(2)此温度下,在0.010mol·L-1的AgNO3溶液中,AgCl与Ag2CrO4分别能达到的最大物质的量浓度,并比较两者的大小。
参考答案:①AgCl(s )Ag+(aq)+Cl-(aq)
)Ag+(aq)+Cl-(aq)
c(AgCl)= =1.3×10-5 mol·L-1
=1.3×10-5 mol·L-1
Ag2CrO4(s )2Ag+(aq)+
)2Ag+(aq)+ -(aq)
-(aq)
2x x
(2x)2·x=Ksp
c(Ag2CrO4)= =6.5×10-5 mol·L-1
=6.5×10-5 mol·L-1
∴c(AgCl)<c(Ag2CrO4)
②在0.01mol·L-1 AgNO3溶液中,c(Ag+)=0.01mol·L-1
AgCl(s )Ag+(aq)+Cl-(aq)
)Ag+(aq)+Cl-(aq)
溶解平衡时: 0.010+x x
(0.010+x)·x=1.8×10-10 ∵x很小,∴0.010+x≈0.010
x=1.8×10-8(mol·L-1)
c(AgCl)=1.8×10-8(mol·L-1)
Ag2CrO4(s )2Ag+(aq)+CrO2-4(aq)
)2Ag+(aq)+CrO2-4(aq)
溶解平衡时: 0.010+x x
(0.010+2x)2·x=1.1×10-12∵x很小,∴0.010+2x≈0.010
x=1.1×10-8(mol·L-1)∴c(Ag2CrO4)=1.1×10-8(mol·L-1)
∴c(AgCl)>c(Ag2CrO4)
(本文在《中学生学习报·化学周刊》2005年第11期上发表)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















