解计算型选择题的方法
化学计算常分为三块:根据概念公式计算、根据物质内部有关量的关系计算、根据化学方程式计算,相对来说,根据化学方程式的计算是中学化学计算的重点及难点。根据化学方程式计算时,为数不少的同学都对化学方程式过分的产生依赖,把此类计算题的解题过程定势为三步曲:写化学方程式→列比例式→计算,殊不知,这样做不仅费时、易错,而且不利于掌握化学反应本质。因此,对此类化学题的计算,必须结合元素化合物知识进行,在计算中要充分挖掘化学变化中存在的各种有价值的量的关系,逐步消除学生对化学方程式的依赖,不断提高化学计算的能力。
一、粗略估量法
示例1:下列物质中含N量最高的是________,最低的是________。
(A)NH4HCO3 (B)(NH4)2SO4
(C)NH4NO3 (D)CO(NH2)2
此题也可以用N原子数和分子量之比来解答。
二、心算推断法
凡能心算的,应立即算出必要数据,并笔录结果,以便推断。
示例2:丁烷、甲烷、乙醛的混合气体,在同温同压下与CO2的密度相同,已知其中丁烷占总体积的25%,那么三种气体的体积比是( )
(A)5∶1∶3 (B)1∶2∶5
(C)5∶1∶5 (D)2∶1∶5
题意解析:题意给了丁烷的体积分量和平均分子量,所按常规求平均分子量的算法求出各种成分体积百分含量再比出结论,但不难从选题中心算出(D)中丁烷所含体积分量为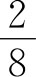 ,与题意相符。
,与题意相符。
解答:(D)
三、观察法
示例3:已知下列两个热化学方程式:
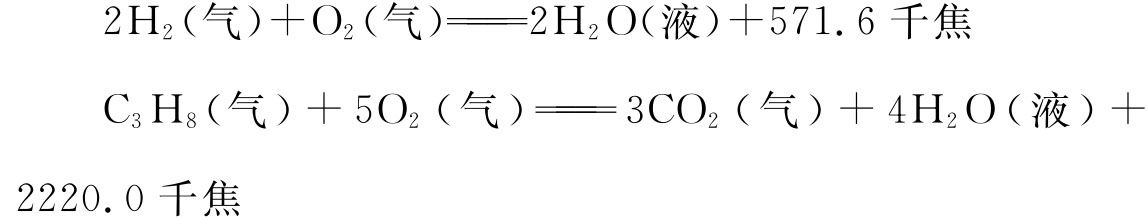
实验测得氢气和丙烷的混合物共5mol,完全燃烧时放热3847千焦,则混合气体中H2和C3H8的气体体积比( )
分析:按一般解法,根据阿氏定律H2与C3H8气体体积之比即为摩尔比,后二者物质的量分别为Xmol、ymol,按题意列方程:

解得:x=3.75,y=1.25。
∴二者体积之比为3∶1,应选(B)。此解法由于数较大,且不能整除,运算费时。若采用观察法眼看心算,便可以难化简,其思路为:按选项中(A)和(C)的摩尔比相混合并完全燃烧放出的热量,一看就可以看出大于3847千焦;按(D)的摩尔比混合,则明显小于3847千焦,这样仅进行简单计算就可以淘汰(A)、(C)、(D)、选出(B),这比列方程解答可以节约大量的时间。
四、间接求解法
这种解法是,把题目所要解决的某个问题转化为另一个容易解决的问题,就可以把繁杂的计算,化为简单计算或不经过计算而得出结论。
示例4:二硫化碳(CS2)能够在O2中完全燃烧生成CO2和SO2。现用0.228克CS2在448毫升O2(在标准状况)中完全燃烧,反应后气体混合物在标准状况下的体积是( )
(A)112毫升 (B)224毫升
(C)336毫升 (D)448毫升
(E)201.6毫升
解析:如按常规解法,需通过计算确定哪一种反应物过量,然后计算生成CO2和CS2的体积,最后加上剩余的O2的体积,才能得到反应后混合气体的总体积。这种解法既浪费时间,也容易出错误。如果分析这一反应的特点:CS2(液)+3O2(气)CO2(气)+2SO2(气),很容易看出同温同压下反应前后气体的体积不发生变化,所以反应前O2为448毫升,反应后混合气体也必然为448毫升,所以根本不需计算就可以得出答案(D)。
五、比较法
比较法就是找出所求量与它所依据的变量之间的关系转化为其他量,然后进行比较,选出最佳答案。
例:下列氮肥中,含氮量最高的是( )
(A)NH4NO3 (B)(NH4)2SO4
(C)(NH4)HCO3 (D)CO(NH2)2
(E)NH4CL
分析:这道题也要分别根据分子量的计算方法,求出各物质的含氮量,再进行比较,运算过程很繁琐。因此,我们可以把比较含氮高低,转化为分子量大小的运算就简单了。
化合物中某元素的含量,是由化合物的分子量以及分子中该元素的原子个数确定,知道分子量和原子个数,将五种质进行对比,根据含N原子数目可以分为两组,一组为A、B、D,均有两个N原子,D分子量最小,B分子量最大,因此含N量为D>A>B;另一组为CE,均含一个N原子,同理可知:E>C;D和E比较,D含N数目是E的2倍,而D的分子量小于E的分子量的2倍,故最高的含N量的是D。
六、推理法
示例6:一定条件下,40mlCO2、CO和O2的混合气体完全燃烧后,恢复到原来的条件,测得气体的体积为36ml,那么,O2的体积是_____。
(A)8ml (B)4ml
(C)36ml (D)10ml
(E)无法确定
分析:有的同学认为已知条件不足,无法计算。事实上根据化学方程式:
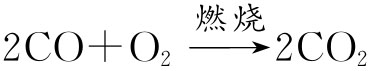 可知,反应前CO的体积等于反应后生成的CO的体积,减少的体积为40-36=4ml就是O2的体积。∴应选(B)。
可知,反应前CO的体积等于反应后生成的CO的体积,减少的体积为40-36=4ml就是O2的体积。∴应选(B)。
七、差量法
利用化学方程式进行有关质量的计算,一般步骤都很复杂,当题目如果提供混合物反应前后的量,只要反应前后的量相减,得出实际差值,再分析理论量差,就可以按比例式求解,这样可以简化。
示例7:把1克含有脉石(S2O)的黄铁矿试样在O2中灼烧后,得到残渣0.76克,此黄铁矿的纯度为( )
(A)52% (B)65%
(C)72% (D)78%
(E)85%
解析:矿样反应后变成残渣,质量减轻了。减轻的原因是FeS2转化为Fe2O3,便可列式,(设含FeS2的质量为x克)。
2FeS2─→Fe2O3
(反应前后质量差)(2FeS2─→Fe2O3)
(理论质量差)2×120=240 160
240-160=80
(实际量差) x 1-0.76=0.24
由此列出比例式:240∶80=x∶0.24,便可求出x=0.72克,即纯度为72%,选取答案C。
八、关系式法
示例8:在O2中灼烧0.4克S和Fe的化合物,待其中的S全都转化为SO2,把这些SO2氧化生成H2SO4,这些H2SO4可以用20ml 0.50mol NaOH浓液完全中和,求原化合物中S的百分含量
(A)18% (B)46%
(C)53% (D)73%
(E)40%
分析:由题意得关系式:
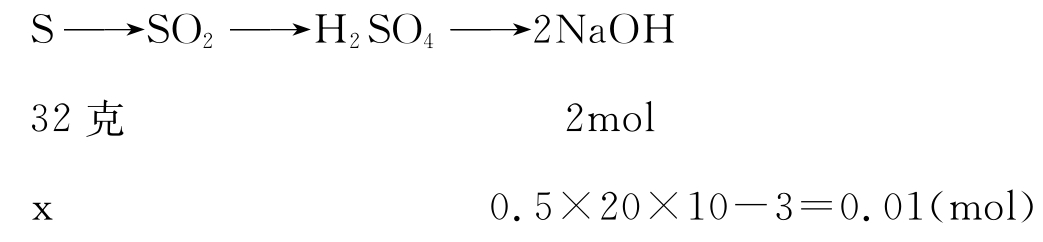
∴应选(E)
九、简化关系法
这是一类可以用化学方程式或关系式计算的题型借助于对反应式系数熟悉的基础,得出更简化的关系式。
示例9:在天平两端的两只烧杯中,各放同浓度,同体积的足量HCl,调节天平平衡后,往左边烧杯中加入3.6g铝粉,为使天平最终保持平衡,应该往右端烧杯中加入镁粉的质量是( )
(A)3.6g (B)3.93g
(C)3.49g (D)3.70g
题意分析:从心算知,每9gAl能置换出1gH2,3.6gAl置换出0.4gH2,而投入Mg与放出H2的差量关系:
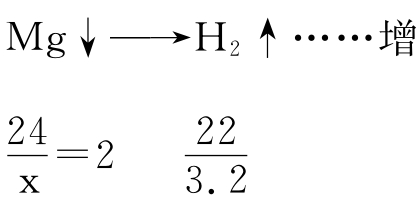
解答:(C)
十、筛选淘汰法
示例10:下列溶液pH>8的是_____。
(A)将pH=5的HAC溶液稀释100倍
(B)10ml0.2N的HAC中加入9.99ml 0.2N的NaOH溶液
(C)500ml水中加入0.05M的H2SO410ml
(D)pH=12的NaOH溶液稀释100倍
(E)pH=8的KOH溶液加水稀释100倍
分析:此题不必对A—E各项一一加以计算,只要根据题目所给条件,运用化学知识逐一进行筛选,淘汰不合题意的答案,就可以选出正确答案pH>8,说明溶液呈碱性。(A)为酸性,稀释后不可能变为碱性,B、C溶液呈酸性,∴(A)、(B)、(D)可以排除,(E)pH=8,该溶液稀释后碱性只能减弱,pH值不可能增加,故只能选(D)
十一、最小公倍数法
示例11:体积相同的NaCl、CaCl2、AlCl3溶液,把其中的Cl-全部沉淀出来,用去相同体积等摩尔浓度的AgNO3溶液,则三种溶液摩尔浓度之比为
(A)1∶1∶1 (B)1∶2∶3
(C)3∶2∶1 (D)6∶3∶2
(E)无法确定
分析:Ag++Cl-═══AgCl↓
1mol∶1mol
NaCl∶MV×1∶M1V0×1,
∴M1=MV/V0;
CaCl2:MV×1∶M2V0×2,
∴M2=MV/2V0;
AlCl3∶MV×1∶M3V0×3,
∴M3=MV/3V0。
∴应选(D)
十二、多反应式变换法
示例12:一定条件下,将等体积NO和O2的混合气体置于试管中,并把试管倒立于水槽中,充分反应后,剩余气体的体积约为总体积的_____。
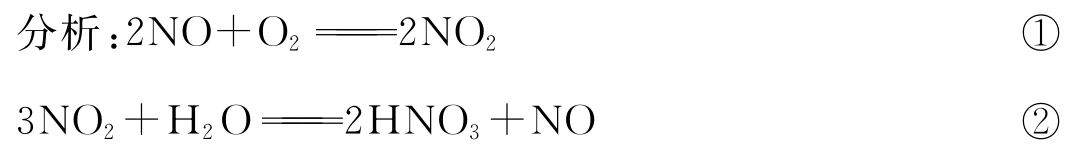
因NO不稳定被氧化后,最后完全被水吸收变成HNO3。
①×3+②×2得
![]()
根据③式可知:若NO与O2体积之比为4∶3,则无气体剩余,由于已知NO与O2体积之比为1∶1,所以剩余O2为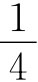 ,总体积为2,剩余气体为原总体积的
,总体积为2,剩余气体为原总体积的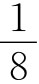 ,应选(C)。
,应选(C)。
参考文献:
《中学化学教学法》,西南师范学院化学系编
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















