(一)慢性肾病(CKD)的定义与分期
美国NKF-K/DOQI(Kidney Disease Outcome Quality Initiative,美国肾基金会慢性肾病及透析预后质量指南工作组)将慢性肾病(CKD)的定义为经过肾活检或检测损伤标志物的证实的肾损伤或肾小球滤过率GFR持续<60[ml/min·1.73m2)]≥3个月。肾损伤的标志物包括蛋白尿、尿试纸条或尿沉渣检查异常或肾影像学检查异常。
分期见表2-4。
表2-4 美国肾病基金会K-DOQI专家组对CKD分期的建议

(二)慢性肾衰竭的定义与分期
慢性肾衰竭(chronic renal failure)是指肾功能在各种病因作用下进行性恶化。一般常由原发性肾病及糖尿病、高血压病引起。分为4个阶段。
1.肾功能不全代偿期 肾小球滤过率(GFR)50~80ml/min,肾单位受损未超过正常的50%。血肌酐、血尿素氮维持正常,未有临床症状表现。成年人GFR简化公式[ml/(min·1.73m2)]=186×Cr-1.154×年龄-0.203×0.742(女性)×1.210(黑人)
2.肾功能不全失代偿期 GFR50~20ml/min,Cr186~442μmol/L,BUN>7.1mmol/L。临床出现乏力,轻度贫血,食欲减退等周身症状。
3.肾衰竭期 GFR 20~10ml/min,Cr 451~707μmol/L,BUN>17.9mmol/L。贫血、代谢性酸中毒、水电解质紊乱。
4.尿毒症期 GFR<10ml/min,Cr>707μmol/L,BUN>28.6mmol/L。各系统症状严重。
【临床表现】
1.水、电解质失衡
(1)水潴留:稀释尿、夜尿多、少尿。水潴留,全身水肿。血钾增高。血钙降低、血磷升高、高镁血症。失水或水过多:本病因肾浓缩尿液的功能减退而致夜尿增多,加上畏食、恶心、呕吐和腹泻等,如不适当利尿或不注意补充液体,则易引起失水而加重病情。同时,肾排水能力差,多饮水或补液不当,则易导致水潴留,表现为水肿、血容量过多、高血压、心力衰竭等,甚至产生肺水肿、脑水肿等严重后果。这种肾维持水平衡能力减退所致的对水耐受性降低,既易失水又易水过多,是尿毒症的重要特点。因此,维持水的平衡也就成为慢性肾衰竭重要治疗目标。
(2)钠平衡失调:肾衰竭时,残余肾单位排钠增加,其机制未明,可能与某些体液因子有关。①失钠:有些病人有失盐性肾病可造成钠的缺失、血容量减少及低血压。其基础疾病常为肾小管、间质疾病,主要是集合管受损,不能调节尿中氯化钠的排泄。②钠过多:许多肾衰竭病入对氯化钠的排泄不能随钠摄入的增加而增加。当体内钠过多时,细胞外液增加。引起体重增加、高血压、水肿、心力衰竭等。终末期肾衰竭病人的水、钠潴留大多与饮食控制不当有关,利尿药无效,需透析超滤脱水才能纠正。
(3)高钾血症:尿中的钾主要通过远曲小管排泄,和肾小管细胞内钾离子浓度有关,而其浓度受细胞膜上Na+-K+-ATP酶调节这种酶的活性受盐皮质激素控制。肾衰竭病人残余的每个肾单位排钾都能相对地增加。此外,肠道也能增加钾的排泄,这在本病调节钾代谢平衡中发挥一定作用。然而,虽有上述调节机制,病人仍易发生高钾血症,即使体内钾总量未增加也可有高钾血症发生。酸中毒、摄入钾增加(包括含钾的药物)、输入陈旧性血液、组织化脓性感染等均可加重高钾血症。高钾血症可导致严重心律失常,有时可无症状突然出现心搏骤停。部分病人有肌无力性麻痹。心电图是监测高钾血症快速而准确的方法,包括T波高尖、P-R间期延长及QRS波增宽。
(4)钙的平衡失调:本病血钙常降低,这是由于本病的肾组织不能生成1,25-(OH)2-D3,钙从肠道吸收减少引起。慢性肾衰竭时PTH虽然增加,但并不能有效地动员骨钙而升高血钙浓度,可能和活性维生素水平过低有关。病人可有抽搐或肌肉痉挛,尤其易发生在补碱后。
(5)高磷血症:血磷的浓度由肠道对磷的吸收及肾的排泄来调节,当GFR<25ml/min时,血磷升高。此时,肠道吸收钙减少,血钙随之降低,高磷、低钙血症刺激PTH分泌增加,导致继发性甲状旁腺功能亢进。防止血磷升高有利于防止甲状旁腺功能亢进。
(6)高镁血症:当GFR<20ml/min时,常有轻度高镁血症,这是由于肾排镁减少,而肠道对镁的吸收则仍正常。病人常无任何症状,然而仍不宜使用含镁的药物,如制酸药、泻药等。透析为最佳疗法。
2.酸碱失衡 根据阴离子间隙(AG)可区分为代谢性酸中毒或高氯血症酸中毒。AG=Na+-(Cl-+HCO-3)。正常AG10~12mmol/L,代谢性酸中毒时HCO-3<15mmol/L,AG高于正常。而高氯血症酸中毒时AG正常。酸中毒:其原因为①GFR<10ml/min时,代谢产物如磷酸、硫酸、乙酰乙酸等酸性物质由于肾的排泄障碍而潴留,血阴离子隙增加,而血浆碳酸氢盐浓度下降,这是尿毒症酸中毒的特征;②肾小管分泌氢离子的功能受损,氢、钠离子交换功能不全,因而碳酸氢钠不能重吸收而从尿中丢失;③肾小管细胞制造氨的能力降低,与尿中氢离子生成铵减少,因而不能很好地酸化尿。多数病人能耐受轻度慢性酸中毒,但如二氧化碳结合力<13.5mmol/L,则可有较明显症状,如深而长的呼吸;食欲缺乏、腹痛、恶心和呕吐;血管扩张,血压下降。上述症状可能和酸中毒时,体内多种酶的活性受抑制有关如能排除呼吸因素,二氧化碳结合力下降可作为酸中毒的简便诊断指标。酸中毒可导致中枢神经系统功能紊乱、意识障碍,呼吸中枢和血管运动中枢麻痹而致命,它是尿毒症病人常见的死因之一。
3.消化系统 此系统为最早出现的临床变化。食欲缺乏,恶心、呕吐。患者可自觉口中有尿味。伴有胃炎、十二指肠炎,多发性溃疡、黏膜出血。结肠炎性病变。血便,肠梗阻、穿孔。消化道症状的产生与本病时体内潴留和产生的毒性物质刺激胃肠黏膜,以及水、电解质、酸碱代谢紊乱等有关。
4.呼吸系统 肺活量降低、肺功能受损。代谢性酸中毒时二氧化碳潴留。肺过度换气。出现尿毒症肺。X线胸片检查于肺门处见对称蝴蝶状阴影。肺水肿、间质性肺炎和低蛋白血症,易引起心力衰竭。还可见胸膜炎、胸腔积液或者血胸。胸腔积液常为单侧,也可有双侧。积液量常为中等,多数为渗出液,蛋白质和乳酸脱氢酶含量较高。有时可为血性,淋巴细胞多于中性粒细胞。也透性增高,使胸膜对体液转运失衡。尿毒症容量负荷过多或血浆蛋白低下,已合并心功能不全,肺血管静水压增高使体液潴留,并渗出于胸腔。尿毒症时血小板功能不良、凝血障碍、出血倾向,而致胸腔内出血。血透时肝素应用也增加血性胸膜炎的发生。尿毒症病人免疫功能低下,结核的发生率甚高,而致结核性胸膜炎。此时,常有低热、血沉>100mm/h,胸腔积液PCR法结核杆菌DNA(+),抗感染治疗2周以上无效,则要考虑合并结核性胸膜炎。尿毒症肺炎:慢性肾衰竭多数伴有免疫功能降低,抗体产生减少,周围血淋巴细胞数减少,加上贫血、营养不良、代谢性酸中毒等使机体防御能力低下,容易并发各种感染,特别患糖尿病、结缔组织疾病,使用激素以及高龄者更易并发感染。常见的感染为肺炎、支气管炎、支气管肺炎,以革兰阴性杆菌感染为主,如治疗不及时会发展为严重感染,故应多次检查痰菌,选用有效抗生素。病原菌不明确时可选用广谱抗生素并根据肾功能和透析与否调整剂量,同时纠正贫血、低蛋白血症,改善营养状。
5.心血管系统
(1)高血压:为容量依赖性高血压与肾素依赖性高血压。血压长期增高可使心功能恶化,同时进一步加重肾功能损害。肾功能恶化后使血压进一步升高,重者可达26.7/17.3kPa(200/130mmHg),发展为高血压脑病。高血压可能与下列因素有关。①水钠潴留:本病的高血压大多为容量依赖型,由水钠潴留所致。这种类型高血压早期对利尿药,后期对充分透析反应良好。②肾素增高:即肾素升高型高血压,使用血管紧张素转换酶抑制药治疗有效。高血压可引起左心扩大、心力衰竭、动脉硬化并继续加重肾损害。有些病人可发生脑血管意外而导致死亡。
(2)心力衰竭:高血压为容量负荷增加,贫血、血液透析用的动静脉瘘、甲状旁腺功能亢进、电解质紊乱及酸中毒、心内膜感染都是心力衰竭的诱因。表现为心悸、气促、端坐样呼吸,颈静脉怒张,肝、脾大及全身水肿。重者为急性肺水肿。但有部分病人可能与尿毒症性心肌病变有关。透析病人透析不充分或透析间期体重增长过多、继发感染是诱发心力衰竭的常见原因。但有部分病人症状不典型,仅表现为尿量突然减少,或水肿加重,应予重视。
(3)心包炎:通常为尿毒症心包炎与透析后心包炎。可能尿毒症体内代谢毒素的潴留,血小板功能异常,水钠潴留,感染,免疫力低下等因素有关。表现为持续的心前区疼痛,随呼吸加重,伴有不同程度的发热。积液量少时可闻及心包摩擦音。大量心包积液时心包摩擦音消失,心音减弱。患者不能平卧,颈静脉怒张,心界扩大,脉压缩小。奇脉。心电图检查显示ST-T改变,低电压。心包积液达1L以上时可出现心脏压塞,出现血压下降,脉压差小,末梢循环不良,颈静脉压力增高等。尿毒症性心包炎常见于尿毒症晚期未透析或透析不充分者。血性心包积液为特征。而血性积液为毛细血管破裂所致。未透析病人的心包炎一般对透析治疗的反应较透析过程中发生的心包炎好,但后者经加强透析治疗后仍有效。当有可疑的心脏压塞征时,应立即做二维超声心动图,并做心包穿刺。
(4)心肌病:尿毒症性心肌病指在终末期肾衰竭时心脏扩大,持续性心动过速、奔马律、心律失常等。表现为心悸、气短。心前区不适感。严重者发展为心功不全。多是由于毒素蓄积对心肌造成损害。以及心脏负荷过重、贫血、营养不良等综合原因引起。体格检查心脏扩大,心率加快,节律紊乱。心电图显示心肌肥厚及劳损,心律失常,传导阻滞。心动超声示左室舒张末期容量增大。
(5)缺血性心脏病:频发心绞痛。它可以表现为心肌灌注不足而致的心绞痛,甚至心肌梗死。尿毒症病人常有高脂血症、高血压、转移性钙化等,为缺血性心脏病的发生提供了病理基础。年龄大,贫血严重,原有冠心病病人以及透析过程中发生的低血压、低血氧症及出血等,又可诱发心绞痛与心肌梗死尿毒症并发的缺血性心脏病,大多数是由动脉粥样硬化,冠心病引起的。但也有非粥样硬化性的疾病。对于此类病人,血透时应采用碳酸氢盐透析,血流量不宜过大,超滤量不宜过多,若心绞痛持续或发生心肌梗死时应中止透析,按心绞痛或心肌梗死处理。
(6)心律失常:多样表现,尿毒症时可出现心肌细胞兴奋性、应激性和传导性的改变,因此可产生各种律失常。可以产生心肌自律性增高而致的各种异位心律失常,如各类早搏、室上速、室速、房颤、房扑、室颤、室扑,或窦性心律失常。也可因心肌传导异常而致各类传导阻滞,如窦房阻滞、房室阻滞、室内阻滞等。易变表现:各种心律失常并非固定不变,随病因的去除而消失,故不像原发性器质性心脏病所伴有的心律失常顽固且相对比较固定。引起尿毒症心律失常的主要原因往往是综合性的,包括电解质紊乱、酸中毒,以及尿毒症毒素引起的心肌损害;继发性甲状旁腺功能亢进、转移性心肌钙化、冠状动脉钙化;贫血、营养不良,合并高血压、动脉硬化冠心病等。
6.血液系统
(1)贫血:是尿毒症病人几乎必有的症状。称为肾性贫血。早期主要表现乏力,面色苍白,食欲缺乏,贫血严重者可出现明显缺氧症状,心慌、气短。有冠心病者可因贫血而诱发心绞痛、心力衰竭等。血细胞压积明显下降,为正细胞正色素型贫血。血小板功能障碍。淋巴细胞功能异常。血清铁蛋白降低,叶酸水平降低。凝血机制异常。血肌酐>308μmol/L时可伴发贫血。贫血机制比较复杂,可能与下列因素有关:①促红素(EPO)绝对或相对分泌不足。EPO是由193个氨基酸组成的糖蛋白类物质。主要由肾产生(近曲小管、肾皮质与髓质小管的内皮细胞),只有10%由肝产生。其主要作用是促进原始红细胞的增生、分化和成熟;促进骨髓内质网红细胞释放入血,使红细胞生成增加;促进骨髓对铁的摄取和利用。正常人血浆EPO的平均值为10~20mU/ml,一般贫血时可达正常值的100倍以上。慢性肾衰竭时由于绝大部分肾单位的毁损,EPO的产生明显减少,故有EPO的绝对或相对不足,其血浆中EPO含量可以低于正常。②血浆中存在着红细胞生长的抑制因子。③尿毒症的毒素对红细胞的破坏,使红细胞的寿命缩短。某些中分子毒素,包括PTH对骨髓也有一定抑制作用。④尿毒症病人长期低蛋白饮食,营养不良,血浆蛋白质低下,造血原料不足,如铁剂、叶酸、维生素B12的缺乏,也是造成贫血的原因。⑤尿毒症时出血倾向,频繁抽血化验,长期血透时透析器内少量的剩血,也是慢性失血的因素。透析用水不纯,含有氯胺铜硝酸盐,以及消毒液甲醛冲洗不完善,透析液配伍的不当(低钠高温)等均可使病人溶血,而加重贫血。⑥铝中毒(或铝负荷过多):也是引起尿毒症(特别是长期血透病人)贫血的见原因,铝可与转铁蛋白结合,干扰了铁与血红蛋白的结合,影响血红蛋白的合成;铝还可抑制合成血红蛋白时某些酶的作用(如铁络合蛋白、尿卟啉脱羧酶等)而影响造血。铝中毒引起贫血的特点是小细胞低色素性贫血。⑦继发性甲状旁腺功能亢进:PT诱发肾性骨病,纤维性骨炎骨髓纤维化,使祖代红细胞数目减少。PTH又是中分子毒素,对骨髓祖代红细胞有直接的毒性作用;抑制红细胞膜钙泵活性,使红细胞内钙增加,脆性增加,红细胞寿命缩短。PTH还可降低对促红素的反应性。
(2)出血倾向:可表现为皮下出血、鼻出血、月经过多或外伤后严重出血。出血倾向可能与下列因素有关:出血时间延长;由于外周血小板破坏增多,血小板数降低;血小板功能异常,血小板聚集和黏附能力下降。透析常能纠正出血倾向。
(3)白细胞异常:白细胞计数多正常,部分病例可有粒细胞或淋巴细胞减少。中性粒细胞趋化、吞噬和杀菌的能力减弱,导致急性炎症反应减弱。故尿毒症病人容易发生感染。透析后可改善。
7.神经系统 尿毒症脑病:常出现于透析治疗前当GFR下降为正常人的10%时即有症状出现。大多数病人脑电图可有异常,表现为低频波(低于57Hz的波)明显增多,甚至可比正常高20倍。透析开始后临床上可见稳定或好转,但脑电图的变化可以继续,经6个月以上的充分透析或肾移植后脑病的症状可以好转。
(1)精神症状表现为:注意力不集中。表情淡漠或者易激动。记忆力、定向力减退,反应迟钝。重者出现精神错乱、幻觉、幻视和妄想,人格分离、嗜睡。
(2)意识障碍:嗜睡、谵妄、木僵。严重者昏迷、肌张力增高呈去皮质僵直或去大脑僵直。
(3)抽搐、不自主运动、扑翼样震颤和肌阵挛。
(4)偏瘫、截瘫、共济失调及脑神经病变。
(5)脑膜刺激征阳性。头痛、颈强。
(6)周围神经病变表现为下肢远端感觉异常分布,呈“袜子”样分布,或表现为“下肢不宁综合征”“烧灼足”。终末期肾衰竭病人约65%有不同程度、不同类型的周围神经病变,这种周围神经病变又有两种类型。①多神经炎、尿毒症周围神经炎:为双侧性、对称性、多发性神经病变。常是多发性的周围神经功能普遍丧失。其特征是从远端向近端发展,先下肢后上肢,先感觉后运动,以后混合性的功能丧失。可呈手套、袜子样分布的感觉异常,如蚁走感、刺痛感或瘙痒感,夜间尤甚,病人常有双下肢难以形容的不适难忍,称“下肢不宁综合征”。这类周围神经病变大多认为与尿毒症毒素潴留,尤其与中分子毒素的潴留有一定关系。其中PTH对周围神经的毒性作用已受到广泛关注。血中PTH的水平与运动传导速度相关,通过血液滤过等治疗措施,降低中分子毒素的浓度,周围神经炎的症状也有不同程度的改善。广泛的多发性神经炎,还与糖尿病、淀粉样变性、多发性骨髓瘤、遗传性多神经病、系统性红斑狼疮、结节性多动脉炎、肝衰竭等引起的神经毒性损害有关。②孤立的或单个的多个孤立的周围神经损伤:称单神经病变。它不具有多发性神经炎的特性,发生率较少。此外尿毒症病人也有脑神经损害,常见受累的脑神经为视神经、动眼神经、听神经和前庭神经,神经受累后表现为暂时性的眼震颤,瞳孔缩小,斜视,脸型不对称,有的还表现为耳聋等。
(7)自主神经系统:慢性肾衰竭病人也可发生自主神经功能的异常,包括汗腺功能缺陷、压力感受器敏感性降低、直立性低血压、持续性低血压、阳萎、心律失常、胃肠道蠕动功能异常等。机制较为复杂。尿毒症的毒素中血清甲状旁腺素水平升高可能在自主神经功能障碍中起一定的作用,它可引起压力感受器敏感性降低,心血管系统整体位相上的改变,交感、副交感通路的改变,末端器官对激动反应的改变等。
8.皮肤症状 是最常见的症状之一。表现为全身瘙痒或局部瘙庠以及皮肤色素沉着异常。某些瘙痒无皮肤的损害仅仅是一种主观感受,另外一些瘙庠可导致皮肤病变如丘疹角化或单纯苔藓。皮肤干燥、毒素刺激、PTH升可能是引起瘙痒的原因。PTH升高促使血钙升高,肥大细胞受刺激释放组胺。瘙痒病人切除甲状旁腺后瘙痒可消失。瘙痒的程度和血钙、磷浓度、甲状旁腺大小之间并无相关关系。尿毒症时皮肤呈灰黄色面色晦暗,是因为类胡萝卜素或尿胆原素沉积于皮肤或皮下脂肪组织中。贫血导致皮肤缺乏红润。尚有弥漫性褐色色素沉着,使皮肤色泽类似阳光曝晒。皮肤色素过多是由于促黑色素细胞激素过多,导致黑色素生成。尿毒症时,血中该激素水平与肌酐水平呈比例增加,透析不易清除。
9.内分泌系统障碍 钙、磷代谢紊乱在CKD中出现较早,表现为高磷血症、低钙血症、继发性甲状旁腺功能亢进及骨异常。
(1)肾性骨病:亦称肾性骨营养不良。是慢性肾功能不全伴随的代谢骨病,多由维生素D缺乏,甲状旁腺功能亢进和铝沉积引起。临床常见表现类型包括:纤维性骨炎、尿毒症性骨软化症、骨质疏松症和骨硬化症。分为以下几类:①甲状旁腺功能亢进骨病,PTH亢进、骨转化率增高;②低转化骨病,骨转化率和矿化率降低,包括软骨病和动力缺陷骨病;③混合性骨病则由甲状旁腺功能亢进和矿化缺陷引起铝性骨病;④骨外软组织钙化。对于长期透析病人肾性骨病已成为一个重要的问题,因为纤维性骨炎和骨软化症均可引起自发性、骨折的严重后果。
骨痛,近端肌无力。骨痛以下半身持重骨疼痛显著,运动受压时加重。还有骨折、皮肤瘙痒。患慢性肾功不全的儿童生长缓慢。X线片显示及同位素99mTc-MDP骨扫描为甲状旁旁功能亢进骨病,锁骨远端和指骨骨膜下受侵。
血液生化①血钙低于正常;②血磷升高;③反映甲状旁腺功能亢进程度的碱性磷酸酶AKP升高;④血PTH升高;⑤血1,25-(OH)2-D3下降;⑥非脱钙骨病理检查。
(2)糖和胰岛素代谢紊乱:糖类代谢障碍是CRF中常见的结果,胰岛素分泌减少和外周组织对胰岛素的抵抗促成了尿毒症病人对糖类的不耐受。胰岛B细胞对胰岛素抵抗的通常反应是增加胰岛素分泌,当B细胞由于各种原因不能相应增加胰岛素分泌时,就会发生糖耐量减退。CRF时胰岛素代谢紊乱可能与下列因素有关:①胰岛素的清除障碍。每日6~8U胰岛素被肾小球滤过并被近端小管重吸收。慢性肾衰竭病人中,肾和肾外组织(肝和肌肉等)对胰岛素清除的减少造成空腹高胰岛素血症,在糖负荷后血中胰岛素水平会更高,因而在CRF患者中易发生低血糖。在肾小球滤过率40ml/min时胰岛素清除率的开始下降。肾小球滤过率降低至20ml/min时胰岛素半衰期显著延长。尿毒症病人对胰岛素需要量减少。经透析治疗后,病人的胰岛素清除率显著提高,这是由于某些可透析的尿毒症毒素抑制了肾外组织对胰岛素的清除,这些毒素经透析被排出后,肝和肌肉对胰岛素的清除增加。②外周组织的胰岛素抵抗:胰岛素抵抗不是由于肝糖原产生增多或肝摄取糖减少造成,而是由于肌肉对糖的摄入利用减少所致。尿毒症病人累积于血液中的各种激素生长激素、胰高糖素、皮质醇和儿茶酚胺等,也有对抗胰岛素的作用。尿毒症病人的胰岛素抵抗并不是由于胰岛素与受体结合异常所造成,而可能与受体后缺陷有关。③胰岛素分泌减少:继发性甲状旁腺功能亢进会引起尿毒症病人胰岛素分泌减少,重度的甲状旁腺功能亢进病人常伴糖耐量减退。④糖尿病和非糖尿病的肾衰竭病人都可能发生自发性低血糖。在糖尿病病人中,治疗用胰岛素在体内降解减慢可造成血中较高的胰岛素水平,并促使低血糖发生。在使用经肾排泄的口服降糖药时,也需调整剂量以免发生低血糖。建议这类病人使用短效的口服降糖药。非糖尿病的尿毒症病人中自发性低血糖的机制尚不明确。当有高钾血症时,过量的PTH会抑制胰岛素分泌,并妨碍肾外组织对钾的处置。钾能刺激胰岛素分泌,而胰岛素在肾外组织对钾的调节中起重要作用。糖代谢和胰岛素分泌紊乱及继发性甲状旁腺功能亢进增加这些病人动脉粥样硬化发生的危险。尿毒症病人糖耐量降低而造成餐后高血糖是冠心病发生的一个危险因素。
(3)甲状腺功能减退或增强:正常情况下,肾参与甲状腺素在外周组织中的代谢。另外,肾可滤过、重吸收和排泌完整的甲状腺素,并且是无机碘排泄的主要途径。甲状腺素代谢紊乱的原因可以是下丘脑-垂体-甲状腺轴的原发病所致,也可能是一些非甲状腺损害造成,如慢性肾衰谒、肾病综合征、营养不良和分解代谢、并发的系统性疾病、药物以及透析治疗等。TT3和FT3水平的降低能减慢体内降解代谢的过程,是对营养不良和系统性疾患的一种适应。由于肾对碘的排泄减少,慢性肾衰竭病人血无机碘的水平较正常升高7倍以上,过量的碘会抑制甲状腺素的释放,并可能造成甲状腺肿或可逆性甲状腺功能减退及甲状腺功能亢进。甲状腺功能减退的临床表现与慢性肾衰竭的症状非常相似,并可为后者所掩盖,如疲劳、嗜睡、体重增加,皮肤干燥,便秘,听力下降,眼周和足部水肿,深部跟腱反射延迟,胸膜和心包积液等。甲状腺功能亢进发生较少,常见病因有:①格雷夫斯病;②多结节性毒性甲状腺肿或毒性腺瘤,③甲状腺炎;④服用了外源性甲状腺激素。甲状腺功能亢进的临床表现也会被尿毒症或其他所伴发的非甲状腺疾病掩盖,在年龄>60岁的患者中,只有1/4的人有典型的甲状腺功能亢进症状和体征,而余者之高代谢临床表现如体重减轻、怕热多汗及房颤、充血性心力衰竭症状并不明显。因此,慢性肾衰竭病人其甲状腺素过量还是缺乏的最后确诊要依靠检查,常用指标是TSH值和游离T指数。
(4)甲状旁腺功能亢进:可能与下列因素有关。①低钙血症。②磷潴留,高磷可抑制肾1α羟化酶活性,降低PTH对钙变化的反应,直接刺激PTHmRNA表达。③PTH对钙调节反应障碍。④维生素D代谢改变或对钙三醇抵抗,肾衰竭时1,25-(OH)2-D3产生减少。正常情况下,钙三醇通过和胞质受体结合而抑制PTHmRNA表达,CRF时低钙三醇导致这种抑制作用减弱,而有助于PTH分泌增加。甲状旁腺细胞的自主性过度增生。继发性甲状旁腺功能亢进的临床表现包括骨痛、病理性骨折、转移性钙化、血钙降低或正常或升高、AKP升高、iPTH升高、皮肤顽固性瘙痒、难治性贫血、甲状旁腺结节性或弥漫性增生。
(5)垂体-性功能失调:慢性肾衰竭及维持性血透病人的下丘脑-垂体-性腺轴功能紊乱,在性功能方面常表现出诸多异常。除性成熟延迟、性欲减退、性冷淡之外,女性病人易发生闭经、月经过多、妊娠困难、自发性流产;男性则多出现部分或完全性阳萎,男子乳房发育、精子减少、精子缺乏。在晚期CRF病人中,完全性或部分性阳萎很常见,透析治疗后,情况并不能改善。导致阳萎发生的机制可能是:①CRF的慢性疾病状态,精神因素如抑郁,锌的缺乏等。②尿毒症病人自主神经系统功能紊乱。③血管异常。CRF病人中高血压、高脂血症、动脉粥样硬化、转移性钙化等都会对阴茎的动脉造成不利影响,并妨碍其充盈勃起。④下丘脑-垂体-性腺轴的激素水平异常:多数尿毒症和血透病人的血睾酮水平降低,血FSH一般正常,对促性腺激素释放因子(Gn-RH)的反应增强而高峰延迟,血LH则多升高,对GnRH的反应同FSH,一些病人血催乳素水平上升,在使用抑制其分泌的药物溴隐停后,催乳素水平降低并伴有性功能的改善,这显示血催乳素水平的增高在阳萎的生中起了作用。⑤继发性甲状旁腺功能亢进:PTH通过以下途径影响性功能:PTH对中枢、自主及周围神经系统都产生有害作用;PTH增加钙进入各种组织,改变下丘脑、垂体或睾丸的钙含量并影响其分泌功能;PTH会增加催乳素的释放。⑥药物的使用:CRF病人常使用多种药物治疗,其中部分会影响勃起的过程并造成阳萎,如β受体阻滞药阿替洛尔、普萘洛尔、拉贝洛尔等,噻嗪类及螺内酯类利尿药,还有一些抗高血压药物如可乐定、甲基多巴、胍乙啶、利舍平、肼苯哒嗪等。维持性血透病人中常发生不同程度的乳房发育,而在未透析的病人中发生率要低一些。其机制还不明确,与病人血中及组织中雌激素的比例失调有关,如睾酮水平降低,而雌二醇水平增高等;另外与催乳素水平上升及透析后尿毒症病人的营养状况改善也有关。女性病人除性欲减退、性冷漠外,多有闭经或月经过多,不育及自发性流产率高等情况。少数病维持性透析后数年可成功妊娠。
(6)脂质代谢紊乱:CRI病人脂质代谢异常主要见于三酰甘油(TG)、极低密度脂蛋白(VLDL)、低密度脂蛋白(LDL)和载脂蛋白CⅡ(apo-CⅡ)、载脂蛋白CⅢ(apo-CⅢ)、显著升高,尤以VLDL升高为甚。一般GFR降至50ml/min左右时,TG及VLDL开始升高,随CRF进展高三酰甘油血症逐渐加重,而高密度脂蛋HDL及载脂蛋白A1(apo-A1)和载脂蛋白C1(apo-C1)显著降低,多价不饱和脂肪酸减少。这些变化,不仅见于未透析病人,也见于透析病人,腹透病人更加明显,其与吸收糖有关。CRF病人高脂血症可能与下列因素有关:①CRF病人体内肉毒碱和赖氨酸明显缺乏,赖氨酸是肉毒碱的合成原料,肉毒碱缺乏则导致自由脂肪酸的β氧化过程受抑制,三酰甘油产生增加。②三酰甘油又因脂肪酶活性降低,致使外周组织不能充分摄取和利用,透析和非透析病人三酰甘油的清除速度明显减慢。③高胰岛素血症促进脂质的合成,三酰甘油增加。④透析过程中长期应用肝素耗竭体内的脂肪酶及丢失肉毒碱和赖氨酸造成TG增多。⑤CRF病人存在着糖代谢异常,如做腹透糖吸收较多,糖合成内源性脂肪增多,VLDL升高。⑥多不饱和脂肪酸不能在体内合成,需要从饮食中摄取,其中亚油酸、亚油酸有促使胆固醇转变和排泄的作用,使血中胆固醇降低。临床所见多不饱和脂肪酸常不足,导致胆固醇升高。⑦体内多种尿毒症毒素抑制脂蛋白活性;含TG的脂蛋白清除减少。⑧某些药物如贫血使用睾酮,高血压使用普萘洛尔等均可加重高脂血症。高脂血症可造成进行性的肾系膜基质增多、系膜细胞增生、肾小管局灶性扩张和肾小球毛细血管塌陷。尤其对一侧肾切除的单个肾病人的影响更为严重,因而对CRF病人的肾损害起着关键作用。并且可造成肾小动脉硬化,心脑血管和周围血管的并发症增加和加重。
10.代谢失调
(1)体温过低:基础代谢率常下降,主要由于Na+-K+-ATP酶活性降低。此外,体温调节功能亦异常,故病人体温常过低,有些可低至35.5℃,这时,如病人的体温为37.5℃,就有可能是较严重的感染,体温与氮质血症程度呈负相关,可能是由于某些尿毒症毒素抑制Na+-K+-ATP酶的活性。透析后体温可恢复正常。
(2)高尿酸血症:尿酸主要由肾清除。氮质血症期时,由于远曲小管分泌尿酸代偿性增加,高尿酸血症可不显著。当GFR<20ml/min时,则有持续性高尿酸血症。但尿酸升高的速度较肌酐和尿素氮慢。少数高尿酸血症者可发生痛风性关节炎。
11.易于并发感染 为主要死因之一它与机体免疫功能低下、白细胞功能异常、抵抗力降低等因素有关。常见的是肺部和尿路感染。血透病人的金黄色葡萄球菌败血症常由动静脉瘘感染引起。多次输血易招致肝炎病毒感染,常见为乙型、丙型肝炎,特别是后者,在透析中心发生率相当高,但大多数为病毒携带者,可达10%~50%,亦可表现为无症状肝炎,偶可为重型肝炎。EPO的应用使通过输血而引起的肝炎减少。
【诊断】 慢性肾功能不全诊断的基本思路是:尽量找出原发病因和诱因;然后了解肾功能损害程度并且分期;找出并发症、合并症。
1.原发病的诊断 病因诊断非常关键。对治疗与预后都有意义。当病史不详,病因诊断较为困难时应可能根据病史推测病因。
2.寻找促使肾功能恶化的因素 肾有非常强大的储备与代偿功能。当肾小球滤过率为正常的25%~35%时,仍可无慢性肾衰竭的症状。但若有损害肾功能的因素,会立即出现慢性肾衰竭症状。当短期肾功能恶化,必须考虑加重肾衰竭进展的因素。
(1)低血容量:使肾小球滤过率下降。常见脱水,如大汗、呕吐、腹泻等;病人若无心力衰竭而有直立性低血压、心动过速等表现者,则提示有容量不足。
(2)感染:呼吸尿路感染及并发的败血症、感染性休克对肾功能下降有很大作用。而且感染时体内分解代谢增强,含氮质废物增加,尿素氮升高及食欲减退、补液量不足均可导致肾功能迅速恶化。
(3)慢性心力衰竭和严重心律失常等。易导致心源性休克,引起肾小球滤过率下降。
(4)急性应激状态:如严重创伤、大手术后。心、脑血管以外等。
(5)血压波动:高血压脑病或恶性高血压出现。长期高血压的治疗过程中降压过快过剧,导致肾小球血流与滤过下降。
(6)尿路梗阻:最常见为尿路结石、前列腺肥大。偶见由尿酸结晶或本周蛋白引起肾小管内梗阻,前者多见于骨髓增生性疾病化疗时,后者常见于多发性骨髓瘤。
(7)肾毒性药物的使用:最常见于氨基糖苷类抗生素和X线造影剂的使用。
(8)高钙血症、高磷血症或转移性钙化症等均可促进肾功能减退。
3.肾损害分期 可分为三期。
【鉴别诊断】 慢性肾衰竭时,既可以全身多系统多脏器受损害为表现,也可以非肾的某一系统受损害为表现。例如可以以贫血、胃肠道症状或高血压、神经系统症状为首要表现,这样会容易引起漏诊或误诊。而有的既往没有慢性肾病病史,发病时迅速,类似急性肾衰竭,因而需要仔细和下列疾病鉴别。
1.急性肾衰竭 慢性肾衰竭病人有多年病史,典型表现如蛋白尿、血尿、水肿、高血压、夜尿增多等。逐渐发展为慢性肾衰竭有一段过程。这种情形容易判定诊断。而某些平素自认为“健康”从未在医院就诊检查过的患者,在突然发生少尿、高钾、心功不全或高血压表现时,才发现血肌酐、血尿素氮明显升高。因此,需与急性肾衰竭相鉴别。
(1)病史:既往是否有慢性肾病,是否有损害到肾的全身疾病,是否有导致急性肾衰竭的肾前性、肾性或肾后性诱因。
(2)慢性肾衰竭的临床表现:夜尿增多,明显贫血是提供诊断慢性肾功能失代偿期的重要线索。急性肾衰竭鲜有此表现。
(3)肾形态:X线腹部平片或B超检查发现慢性肾衰竭者双肾形态缩小。急性肾衰竭时,肾形态正常或微增大。
(4)指甲肌酐测定:指甲肌酐代表2~3个月前血中肌酐的水平(指甲生长速度从根部到指缘为2~3个月)。当检测指甲肌酐与血肌酐同时升高,说明肾损害2~3个月前已存在,可诊为慢性肾衰竭。指甲肌酐与血肌酐不同步,则判为急性肾衰竭。
(5)肾穿刺活检:肾病变而以纤维化、硬化性病变为主者为慢性肾衰竭。肾小球、肾小管或肾间质活动性病变,以炎症细胞浸润、细胞增生、水肿、坏死、新月体形成、血栓形成为表现的则倾向急性肾衰竭。
2.消化系统疾病 消化系统症状是慢性肾衰竭病人首要和常见的临床表现,常在消化科首诊或急诊就诊。慢性肾衰竭消化道表现有:食欲缺乏、恶心、呕吐、腹胀、腹水、消化道出血、畏食、口渴、腹泻、呃逆、口腔溃疡、腮腺炎、胰腺炎、口腔金属味、口臭等,临床上常易误诊为胃炎、消化道溃疡、上消化道出血等一系列消化系统疾病。因此应和以下疾病相鉴别。
(1)胃炎、消化性溃疡:胃炎或消化性溃疡常反复出现上腹不适、腹胀、腹痛或反酸、嗳气等。贫血仅见于伴有消化道出血呕血、黑粪等。无水肿、夜尿增多、蛋白尿。慢性肾衰竭可合并胃炎或消化性溃疡,表现为恶心、呕吐、烧灼感、腹部胀痛。晨起刷牙时易诱发恶心、呕吐,不易缓解。胃镜见胃炎和十二指肠炎,复合性溃疡,出血性胃炎。内镜下示病变黏膜灰白色,黏膜皱襞增多伴炎症。低蛋白血症,体液潴留和肌层黏膜高张力引起黏膜水肿从而导致黏膜皱襞增多。尿素的反弥散和胆汁反流引起胃炎和十二指肠炎。对症治疗慢性肾衰竭引起的恶心、呕吐症状不易缓解,无腹痛。口中可有尿臭味。贫血,面色灰暗、水肿,血压高,夜尿增多或尿量减少,尿蛋白阳性或见肾衰竭管型,都提示诊断慢性肾衰竭。
(2)消化道出血:慢性肾衰竭因凝血机制障碍或合并消化性溃疡及肠壁的炎症等而出现消化道出血,也以黑粪、呕吐咖啡渣样物质为表现。与原发性消化系统疾病引起的消化道出血鉴别要点:原发消化系统疾病典型表现为反复发作的上腹痛、烧灼感、腹胀。肝硬化门脉高压者有黄疸、腹水、蜘蛛痣、低蛋白血症、转氨酶增高,肾功能可无变化。即使血尿素氮升高也与血肌酐水平升高不成比例(以尿素氮升高为主)。蛋白尿不明显,肾无明显缩小。急性失血者贫血程度常与出血量成正比,慢性肾衰竭者的贫血与失血量不成例。
(3)小肠和大肠疾病:原发性肠道疾病者,腹痛、腹泻症状明显,同时发热、腔包块、甚至肠瘘形成等。一般肾功能正常,无水肿、蛋白尿、少尿、夜尿增多。影像学检查肾大小正常。慢性肾衰竭蓄积的代谢终产物使小肠黏膜水肿、出血和溃疡,病理见肠绒毛缩短,隐窝变深和炎症细泡浸润。给予1,25-(OH)2-D3可纠正由于缺乏活性D引起的低钙。大肠病变为缺血性结肠炎,非特异性溃疡。非特异性溃疡单发、面积处在盲肠和升结肠。粪石嵌塞见于乙状结肠和直肠。这些病变都可致腹痛、腹泻或便秘等。
(4)肝病变:慢性肝病病人可有贫血、出血、肾功能损害,慢性肾衰竭也常见肝功受损,某些表现两者互相类似。因此常需鉴别:原发性肝损害首发且突出,肾损害仅在肝病变晚期(如肝硬化失代偿期)才合并出现。肾损害则是以蛋白尿、血尿、水肿、高血压、腰酸、腰痛、夜尿增多为表现。乙型肝炎或丙型肝炎病毒相关性肾炎,肝肾可同时受累。肝硬化所引起的肝肾综合征,肾损害为可逆性的,肾结构无破坏。尿毒症时,肾萎缩和纤维化,损害不可逆。
(5)胰腺病变:急性坏死性胰腺炎出现肾衰竭。腹痛剧烈不可忍受。并有腹膜炎、低血压、Cullen征、Grey-Turner征阳性等。暴饮暴食为诱因或存在胆囊炎、胆石症等。血淀粉酶升高大于正常值的3倍提示存在胰腺炎。尿毒症病变可累积胰腺。异常程度与CRF的病程相关,血淀粉酶可升高。但急腹症表现较少见,而肌酐清除率下降明显。因此两者易于鉴别。发生胰腺损害的原因可能与高三酰甘油血症、继发性甲状旁腺功能亢进、高钙血症、缩胆囊素和促胰液素水平升高等有关。透析时容量减少也易触发胰腺炎。甲状旁腺功能亢进时,血钙增加可加速胰腺自身消化。
(6)腹水:慢性肾衰竭的腹水称为肾性腹水或突发性腹水。腹水性质多为渗出液。是由于液体潴留,低蛋白血症,腹膜炎,病人常为长期透析不充分、存在营养不良等。和肝门脉高压、腹膜炎引起的腹水鉴别要点为:肝门脉高压有慢性肝病史,腹水伴脾大、脾功能亢进、蜘蛛痣、黄疸,腹壁可见静脉曲张。严重大量腹水引起的肾损害为肾前性,腹水减轻后肾功能能恢复,尿比重不降低。慢性肾衰竭合并腹水主要是晚期营养不良引起。病人少尿或无尿,可无明显黄疸或蜘蛛痣,无脾功能亢进。肾衰竭合并腹水治疗不易缓解。
3.肺部疾病 慢性肾衰竭引得病变的称为“尿毒症肺”。以呼吸困难、肺部感染、胸腔积液为主要表现。还合并心力衰竭、胸腔积液或严重酸中毒而引起,胸腔积液多为双侧,可为漏出液、也可为渗出液或混合性,有时甚至呈血性。呼吸困难因心力衰竭引起者病人呼吸急促、不能平卧、烦躁不安。而如为严重酸中毒引起者呼吸深大,可有精神抑制、球结膜充血水肿等。仔细查体在发现病人心脏扩大,或胸腔实变体征的同时,如发现病人同时存在严重贫血、精神障碍、水肿、面色灰暗并色素沉着,或皮肤有尿素霜、较多瘙痒抓痕等应想到慢性肾衰竭的可能。
4.心血管系统疾病
(1)高血压:关键是区分出谁为因谁为果。高血压者一般老年患病,单纯血压升高,无蛋白尿、血尿或水肿。出现蛋白尿时,常合并出现高血压所致的心、脑损害。蛋白尿多在高血压10年以后出现,且程度不重,很少有24h尿蛋白排泄量超过3g者,血尿不明显,罕见有肉眼血尿者,贫血出现较晚。慢性肾衰竭多青年起病,伴腰酸、腰痛、乏力。发病时可能有劳累、感染等诱发因素。血压升高的同时出现显著的蛋白尿、有些病人甚至呈现大量蛋白尿,表现为肾病综合征,可同时合并血尿。肾病理二者很容易区分。高血压主要表现为小动脉壁增厚、透明样变性;原发肾小球疾病者,则为肾小球系膜细胞增生和(或)基底膜增厚、炎症细胞浸润、局灶节段性硬化、小管间质病变等。
(2)心力衰竭:是慢性肾衰竭主要并发症。由钠、水潴留及高血压及尿毒症心肌病引起。为心脏扩大、持续性心动过速、奔马律、心律失常等。尿毒症晚期表现或透析过程中出现。当同时存在高血压、严重贫血、少尿、恶心、呕吐、口臭、皮肤瘙痒等可以明确诊断。尿毒症合并心力衰竭时常规强心利尿治疗效果差,主要应采取透析疗法,同时应注意严重贫血和高血压的治疗。
(3)心肌病:原发性心肌病以及风湿性心脏病病人除心脏扩大,发绀。尿量、肾无异常。无贫血。原发性心肌病者心电图可有广泛性病理性Q波及室内传导阻滞、各种心律失常。原发性心肌病以及风湿性心脏病病人由于心力衰竭导致肾有效灌注下降,肾滤过功能减退,也可引起BUN及Cr升高,但此时由于小管重吸收功能无明显障碍,故可引起BUN及Cr不成比例的升高,即BUN较Cr升高更明显。心力衰竭纠正后肾功能即改善。
(4)心包炎:尿毒症性心包炎常见于尿毒症晚期,病人有少尿、无尿、严重贫血、精神障碍、严重水肿、恶心呕吐、口中带有尿臭味等晚期症状。心包摩擦音可因心包积液形成而迅速消失,可有心脏压塞症状。多无发热,充分透析后,心包摩擦音可很快消失。心包炎合并贫血、水肿、血压高者应想到慢性肾衰竭。而感染、自身免疫性疾病或肿瘤浸润引起的心包炎未有尿量变化。无精神症状。感染引起者可有发热,心包积液可为渗出性,结核或肿瘤引起者可呈血性。
5.血液系统疾病 肾性贫血出现于慢性肾病晚期。主要由于促红细胞生成素(EPO)减少引起。贫血为正细胞、正色素性,骨髓增生活跃,体内无缺铁,或处于相对缺铁状态。EPO治疗有效。对所有贫血病人临床检查时均做尿常规和肾功能化验进行筛检。如果此两项指标正常,可以排除与慢性肾衰竭有关的贫血。慢性肾衰竭常有出血倾向,表现为皮肤瘀斑、鼻出血、月经过多、牙龈出血、外伤后严重出血、消化道出血等。尿毒症时出血表现为出血时间延长,血小板第3因子活力下降,血小板聚集和黏附能力异常等引起凝血障碍,透析常能迅速纠正出血倾向,说明出血倾向主要与尿毒症毒素有关。与出血性疾病鉴别:病人血中血小板数量不减少,溶血试验多阴性。病人贫血程度与出血程度不相平行也是尿毒症出血时的一个特点。慢性肾衰竭性贫血较严重,同时由于存在出、凝血机制及白细胞系统的异常就诊时常易误诊为血液系统疾病,如缺铁性贫血、再生障碍性贫血、出血性疾病等。
6.神经、精神系统疾病 慢性肾衰竭早期常有疲乏、失眠、注意力不集中。肾衰竭后期会出现性格改变、抑郁、记忆力减退、判断错误、对外界反应淡漠,精神异常谵妄、幻觉、昏迷等。因神经肌肉兴奋性增强,出现顽固呃逆,肌肉痛性痉挛、抽搐等。肾衰竭晚期还会有周围神经病变,感觉神经较运动神经显著,最常侵犯的是下肢远端,病人可诉肢体麻木,有时为烧灼感或疼痛感,下肢不宁综合征、深腱反射迟钝或消失、肌肉无力、感觉障碍。易误诊为神经衰弱、抑郁症、精神分裂症、多发性神经炎等。昏迷病人易误诊为脑血管意外、糖尿病酮症酸中毒或高渗性昏迷。鉴别诊断时,应仔细追问病史。特别注意慢性肾病史(如水肿、蛋白尿、少尿、无尿、夜尿增多、血尿、高血压等),仔细查体,观察是否有肾衰竭面容、贫血、皮下淤血、瘀点、皮肤尿素霜、瘙痒抓痕等各种有可能提示慢性肾衰竭的症状和体征。及时进行肾功能的检查。
7.内分泌紊乱与代谢性疾病 与内分泌紊乱有关的疾病鉴别:原发性甲状旁腺功能亢进与继发性甲状旁腺功能亢进鉴别要点是前者没有肾病史,除表现为骨痛、多发性结石、多发性骨折、血钙升高、精神症状如情绪不稳定,肾小管浓缩功能减退而表现为多尿、夜尿、口渴等。而继发性甲状旁腺功能亢进多继发于慢性肾衰竭发以后,故有慢性肾衰竭的临床表现,如水肿、血压高、夜尿增多,或尿量减少、蛋白尿,尿沉渣可见肾衰竭管型。BUN及Cr明显升高。
8.皮肤病变 慢性肾衰竭皮肤症状仅为全身症状的一部分,以顽固性皮肤瘙痒、皮肤色素沉着、皮肤干燥、皮下出血等为表现。还合并其他系统症状,如恶心、呕吐、贫血、水肿、面色萎黄、血压增高、夜尿增多或尿量减少等。与单纯性皮炎、皮癣、皮疹等鉴别:单纯性皮肤损害,病人无慢性肾衰竭的其他表现。常规进行尿液和肾功能检查则可判断病情真相。
【治疗】
(一)对慢性肾病的筛查、防治与评估
1.筛查 大多数CKD病人往往早期没有症状或症状较轻,因此,定期筛查对提高诊断率是十分重要的。对普通者的筛查主要包括:
(1)CKD发病危险因素、肾损害的表现、类型、病情程度、进展危险因素及并发症等。常用检测项目有:尿常规、尿微量白蛋白定量、24h尿蛋白定量、肾功能、血糖、血尿酸、血脂等。此外,医生还可根据患者具体情况,选择是否进行尿红细胞形态、低分子蛋白及肾影像学检查等。
肾小球滤过功能检查是评估肾功能的主要方法,必要时还可检测肾小管功能,如尿低分子蛋白、糖类、氨基酸以及尿比重、渗透压等。肾小球滤过率(GFR)的主要检测方法有血清肌酐浓度(Cr)、肌酐清除率(Ccr),也可采用同位素法或根据Cr应用公式计算出GFR。不同人群Cr与Ccr值可能有显著差别,临床医生应根据具体情况作出判断。
尿蛋白量的多少,往往反映CKD的程度。尿白蛋白定量,即尿白蛋白排出率(UAE)检查能灵敏地测定尿中微量白蛋白,是判断早期肾损害的敏感指标之一。对于高血压、糖尿病、反复长期尿路感染、药物中毒等患者,应定期检测尿微量白蛋白,以便尽早发现疾病损害。必要时可检测24h尿蛋白定量。血尿和尿红细胞形态的检测,可初步筛查泌尿系疾病或反映某些肾病变有无活动,但一般与肾病的预后无明显关系。
(2)即便个体既往健康或没有症状,也应每年进行1次CKD筛查。如果其已患有高血压、糖尿病等慢性疾病,则应每年定期检查尿常规、肾功能等项目2次或2次以上,如果已经出现某些症状,则应尽早到医院做全面检查。
(3)影像学检查在筛查CKD中也很重要,一般情况下可做B型超声检查,以除外结石、肾结核等疾病。某些特殊情况下,可能需要进行静脉肾盂造影、肾CT与磁共振成像等检查。
2.防治 CKD的早期防治包括:防止健康人群和高危人群发生CKD(一级预防),以及延缓或逆转CKD患者肾功能恶化(二级预防)。
(1)一级预防的具体措施:包括减少盐摄入,平衡膳食;每天进行体育活动,控制体重;避免感冒;戒烟;避免酗酒;避免药物滥用;每年定期进行尿常规和肾功能等项检查,并了解疾病家族史。对于CKD的高危人群,除上述措施外,还应积极控制危险因素,如糖尿病、高血压、高尿酸、肥胖和高血脂等,并至少每半年进行1次尿常规、尿微量白蛋白和肾功能检查,以便发现早期肾损害。
(2)CKD二级预防:主要目的是延缓或逆转肾疾病进展,保护已经受损的肾功能。首先,要避免或纠正慢性肾病急性加重的危险因素,包括累及肾的疾病的复发或加重、血容量不足、肾局部血供急剧减少、组织创伤或大出血、严重感染、肾毒性药物致肾损伤、严重高血压未能控制或血压急剧波动、泌尿道梗阻、其他器官功能衰竭及严重营养不良等。其次,应及时纠正慢性肾病渐进性或进行性加重的危险因素,如蛋白尿、高血压、高血糖、感染和贫血等,并给予低蛋白饮食,纠正代谢性酸中毒和电解质紊乱,调整血脂水平,避免使用肾毒性药物等。
3.评估 当诊断为CKD时应该对病人进行全面评估。
(1)在每个健康中心均应测量血压。有以下指征的的CKD病人可考率使用自动血压监测进行检测:可疑“白大衣”高血压,顽固性高血压,服用降压药时出现低血压症状,阵发性高血压,自主神经功能异常。
(2)初始评估:对CKD的描述、类型、GFR水平、蛋白尿水平。GFR降低的并发症。肾病进展的危险因素。心血管疾病(CVD)的表现和危险因素,合并疾病。在自我管理、适应饮食和其他生活方式的调整以及适应药物治疗方面存在的问题。药物治疗的并发症。按照CKD分期对每个病人应建立临床治疗实施计划。对顽固性高血压的病人按照病因不同进行额外的评估。
蛋白尿和血压应当定期监测,以评价病人对抗高血压制剂的反应。在CKD,蛋白尿是CVD的危险因素。对于点时间尿总蛋白/肌酐比值>500~1 000mg/g的病人,应当考虑修改抗高血压治疗目标。更低的收缩压目标值。开始抗高血压治疗或者增加抗高血压药物剂量以减少蛋白尿
与一般人群相比药物治疗更容易引起CKD病人发生药物不良反应,应当更频繁的监测。应当在开始治疗前测量血压、GFR和血钾,治疗开始后12周内重复监测,或者在更改ACEI或ARB剂量后重复监测。
对于下列病人应当在4周内测量血压、GFR和血钾。收缩压<16kPa(120mmHg)或者≥18.7kPa(140mmHg),GFR<60ml/(min·1.73m2),2个月内GFR改变>15%。血钾>4.5mmol/l(如果使用ACEI或者ARB),或者血钾<4.0mmol/L(如果使用利尿药)。
(3)对自我治疗行为进行教育:降压治疗中应将自我治疗原则列入治疗计划,对患者及家庭进行高血压治疗教育应考虑到文化背景、经济状况及患者理解力的影响。
(4)成年患者的饮食及其他治疗性生活方式调整:钠应<100mmol/d(2.4g/d),对于失盐性的患者不推荐。CKD1~4期,钠<2.4g/d,总脂肪(占热量)<30%,饱和脂肪酸(占热量)<10%,胆固醇(mg/d)<200,糖类(占热量)<50%~60%。在CKD1~2期:蛋白质1.4g/(kg·d),占热量(18%);磷1.7g/d,钾>4g/d。在CKD3~4期:蛋白质0.6~0.8g/(kg·d),占热量的10%,磷0.8~1.0g/d,钾2~4g/d。生活方式调整:若BMI<25kg/m2,维持目前体重,均衡饮食以保持理想体重。若超重或肥胖BMI>25kg/m2,减轻体重,限制热量,均衡饮食。锻炼或体力活动,中等强度(运动时间为30min/d,每周多日)。减少乙醇摄入,男性每日≤2杯,女性每日≤1杯。通过辅导戒烟或尼古丁替代品。
(5)评价肾动脉疾病:肾动脉疾病(RAD)可导致CKD与高血压,亦可见于其他病因所致的CKD(如糖尿病或高血压性肾硬化)以及移植肾的CKD。对于临床怀疑RAD的患者医师通过临床表现计算预测指数评价RAD的可能性,进行RAD的无创性筛查。
(6)在CKD患者中应用降压药物:抗高血压的治疗目标是降低血压,减慢肾病的进展和减少CVD危险(表2-5)。50%~70% CKD病人有高血压。在CKD,高血压是肾病进展和发生的CVD的危险因素。在CKD,抗高血压治疗可以减慢CVD进展和减少CVD的危险。抗高血压制剂可以减慢慢性肾病进展,尤其是有高血压的CKD病人。不论CKD的病因为何,都应将CKD患者视为CVD的最高人群,并按照建议予以药物治疗。为了降低CKD患者CVD危险性,降压的靶目标值应为<17.3/10.7kPa(130/80mmHg)。应按照如下方案给予降压治疗(表2-6):首选应用CKD患者的推荐药物,对于多数患者应考虑使用利尿药,根据不同心血管疾病适应证选择药物已达防治并防止副作用与相互作用的目的,尽量简化降压治疗方案。尽量应用长效药物每日服用1次。根据CKD分期及CVD危险因素,对于SBP超出靶目标值2.7kPa(20mmHg)的患者可能需要2种药物。(单独应用复方制剂)。在确定降压治疗方案后,在维持治疗中可能需要应用固定剂量的联合药。
血压<17.3/10.7kPa(130/80mmHg)适合所有类型的CKD病人。CKD病人是CVD的高危人群。对于大多数CKD病人为了达到血压控制目标,需要使用2种以上降压药。收缩压达到<17.3kPa(130mmHg)时舒张压也能达到目标值<10.7kPa(80mmHg)。
表2-5 CKD病人降压治疗的策略和靶目标(K-DOQI推荐)
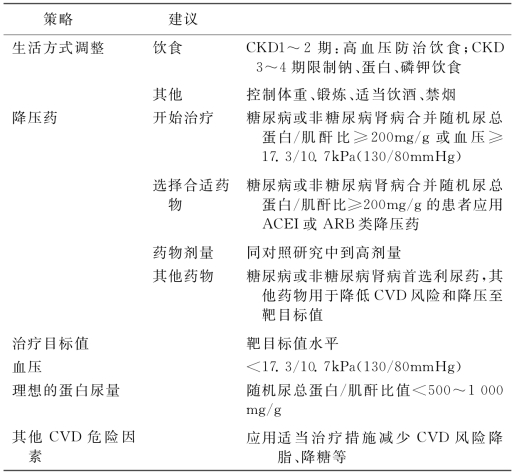
表2-6 在CKD中高血压和降压药物的推荐意见总结(K-DOQI推荐)

关于首选制剂和其他制剂(表2-7):CKD首选制剂指不能依赖于血压的减慢肾病进展的制剂,对于血压正常的病人也应当使用。如果没有首选制剂,可以选用其他制剂,80%~90%的CKD需要同时使用多种制剂,选择时应根据疾病类型并个体化治疗以减少CKD治疗和CVD治疗之间的矛盾。
大多数CKD病人可以安全使用ACEI和ARB。如果没有首选种类,ACEI和ARB可相互替代,ACEI和ARB可以联合应用以降低血压或减少尿蛋白。应用ACEI或ARB的病人应监测低血压、GFR下降和高钾血症。大多数病人如果出现下面情况,ACEI或ARB仍可继续应用:超过4个月的时间中,GFR较基线水平下降<30%;血钾≤5.5mmol/L。当存在怀孕、有血管性水肿的病史、由ACEI引起的咳嗽、对ACEI或过敏ARB过敏此两种药物禁忌。当双侧肾动脉狭窄、未避孕的妇女、药物导致的高血钾时此两种药物慎用。
ACEI和ARB可使用中到大剂量。对于不能耐受ACEI的可选用ARB代替,不能耐受ARB的可选用ACEI代替。对于肾动脉疾病ACEI的人使用ACEI及ARB可能导致GFR大幅度下降。
表2-7 CVD患者优先选择的降压药物(K-DOQI推荐)

(7)利尿药在慢性肾病中的应用:利尿药在大多数慢性肾病的治疗中十分有效。它可以减少细胞外液的容量,降低血压,增强ACEI及ARB及其他抗高血压药物的治疗疗效,降低CKD患者发生CVD的危险。利尿药的选择是由肾小球滤过率水平和需要减少的细胞外液容量决定的。绝大多数CKD应使用利尿药治疗。
推荐GFR≥30ml/[(min·1.73m2)CKD1~3期]的患者使用噻嗪类利尿药每日1次。推荐GFR<30ml[(min·1.73m2)CKD4~5期]的患者使用襻利尿药,1~2/d。襻利尿药每日1~2次与噻嗪类利尿药合用可用于细胞外液容量过多和水肿的患者。保钾利尿药慎用于GFR<30ml[(min·1.73m2)CKD4~5期]、接受ACEI或ARB治疗的患者及有其他发生高血钾危险因素的患者。
利用利尿药治疗的患者应密切监测低血钾和电解质紊乱,容量缺失以低血压或GFR下降为表现。监测的间隔时间取决于血压、GFR和血钾浓度的基础值。
可以考虑应用长效利尿药和含有其他降压药的复方利尿药以提高患者的依从性。
大多数CKD病人需要使用利尿药。对于GFR>30ml[(min/1.73m2)CKD1~3期]的病人噻嗪类利尿药有效。对于GFR<30ml[(min·1.73m2)CKD4~5期]的病人往往需要使用襻利尿药。应当加用其他制剂以达到目标血压例如β受体阻滞药、钙通道阻断药。
(8)糖尿病肾病的药物治疗:糖尿病肾病的血压靶目标应该是<17.3/10.7kPa(130/80mmHg),糖尿病肾病患者无论伴有或不伴有高血压均应当应用ACEI或ARB。当血压≥17.3/10.7kPa(130/80mmHg),CKD首选ACEI或ARB,减少CVD风险达到目标血压的其他用药时利尿药首选,其次β受体阻滞药或钙离子拮抗药关于糖尿病肾病:ACEI及ARB均适合尿蛋白/肌酐比值>30~300mg/g的1型和2型糖尿病病人使用。ACEI适用于尿蛋白/肌酐比值>300mg/g的(临床蛋白尿)1型糖尿病病人,ARB适用于尿蛋白/肌酐比值>300mg/g(临床蛋白尿)2型糖尿病病人。
(9)非糖尿病肾病的药物治疗:非糖尿病肾病包括糖尿病以外的肾小球疾病、肾动脉疾病以外的血管疾病小管间质疾病和囊肿性疾病。在这些疾病中,蛋白尿水平对于诊断和预后的判定非常有用。与其他肾病相比,肾小球疾病的特点是蛋白尿水平比较高。较高水平的蛋白尿往往与肾功能的快速进展有关,而且出现心血管疾病的危险性也明显增加。
非糖尿病肾病血压靶目标应该是<17.3/10.7kPa(130/80mmHg)。对于非糖尿病肾病伴有点时间尿总蛋白/肌酐比值>200mg/g的患者无论伴有或不伴有高血压均应当应用ACEI或ARB。当出现下列4种情况是分别用药:血压≥17.3/10.7kPa(130/80mmHg)和点时间尿总蛋白/肌酐比值≥200mg/g时,首选ACEI或ARB减少CVD风险达到目标血压的其他用药时利尿药首选,其次β受体阻滞药或钙离子拮抗药;血压≥17.3/10.7kPa(130/80mmHg)和点时间尿总蛋白/肌酐比值<200mg/g时,无特殊用药;血压<17.3/10.7kPa(130/80mmHg)和点时间尿总蛋白/肌酐比值≥200mg/g时,首选ACEI或ARB减少CVD风险达到目标血压的其他用药时利尿药首选,然后ACEI或ARB及β受体阻滞药或钙离子拮抗药;血压<17.3/10.7kPa(130/80mmHg)和点时间尿总蛋白/肌酐比值<200mg/g时,减少CVD风险达到目标血压的其他用药时利尿药首选,其次β受体阻滞药或钙离子拮抗药。
关于非糖尿病肾病:蛋白尿用点时间尿总蛋白/肌酐比值表示。肾小球疾病往往尿蛋白>200mg/g。肾小管间质疾病、高血压肾硬化和囊肿性肾病尿蛋白往往较少。
(10)除蛋白尿和高血压外,高脂血症是促进CKD进展的第三大重要因素。在CKD发病机制中,高三酰甘油血症和高胆固醇血症导致的肾损伤已被大量动物实验证实,同时显示脂代谢紊乱与血肌酐进展密切相关。他汀类降脂药通过减低血胆固醇水平改善肾损伤。他汀类药物改善肾病变的机制与直接减少尿蛋白,改善肾间质炎症反应等作用有关。目前认为,合并脂代谢紊乱可导致肾功能降低更快,他汀类药物除能改善脂代谢紊乱外还能有效保护肾功能,与ACEI/ARB联合使用可能疗效更好。但4~5级CKD患者接受他汀类药物治疗的心血管系统获益目前尚没有确切结论
(11)肾移植受者肾疾病的药物治疗:肾移植受者的靶目标应该是<17.3/10.7kPa(130/80mmHg),肾移植受者中患CKD的病人可以应用下列任何药物以达到血压靶目标:钙离子拮抗药、利尿药、ACEI或ARB或β受体阻滞药。关于移植肾肾病:非二氢吡啶类钙阻断药可以升高血环孢素、他克莫司、西罗司水平。ACEI及ARB可能加重环孢素和他克莫司引起的高血钾。
(二)对慢性肾衰竭的非透析治疗
1.维持水、电解质平衡,纠正酸中毒 每日入水量=前一日尿量+500ml。这样可以避免输入过多额外液体量。当出现水钠潴留时给与呋塞米治疗,排出过多体液。同时每日食盐摄入少于3g。血钾增高者的处理可以参考急性肾功能不全治疗方法。经常口服碳酸氢钠片3~10g/d。磷的摄入量<600~800mg或以下,口服碳酸钙降低血磷同时提升血钙浓度。同时加用1,25-(OH)2-D3口服。
2.营养疗法 CKD可造成很多不良结局,其中营养不良对预后具有决定性影响。CKD患者发生营养不良的原因:代谢性酸中毒、对蛋白质合成激素胰岛素与生长激素的抵抗、多种趋炎性因子水平的升高刺激瘦素过度表达。因而采用营养疗法。合适的饮食治疗方案,是治疗慢性肾衰竭的重要措施,可以缓解中毒症状及延缓残余肾单位的破坏。
(1)充足的热量摄入:热量保证为30~40kcal/(kg·d)。摄入足够的糖类和脂肪,以供给人体足够热量,可减少体内蛋白质供能,保证低蛋白饮食的氮得到充分的利用,减少体内蛋白的消耗。消瘦或肥胖者宜酌情予以加减。此外,钠的摄入:除有水肿、高血压和少尿者要严格限制食盐外,一般不宜过严限制钠的摄入。在氮质血症期,就应给予低磷饮食,每日不超过600mg。
(2)低蛋白饮食(LPD)法:蛋白0.6g/(kg·d)。适当减少饮食中蛋白质含量不仅能使BUN水平下降,尿毒症症状减轻,降低血磷和减轻酸中毒,还可以延缓慢性肾衰进展。GFR 30~50ml/min者,饮食中蛋白质含量为0.6~0.8g/(kg·d),GFR为10~20ml/min者,饮食中蛋白质含量宜为0.5~0.6g/(kg·d)。蛋白质应选用富含必需氨基酸的动物蛋白(即高生物价优质蛋白),如鸡蛋、瘦肉和牛奶等。减少饮食中不必要的蛋白质可减少尿素生成,降低血清尿素氮水平,减轻肾小球滤过负荷;减少炎症和氧化反应,从而起到减少蛋白尿的作用。有学这发现,LPD在不改变机体脂肪含量的情况下,可降低瘦素和肿瘤坏死因子(TNF)-α等炎症相关因子水平,证明了LPD具有改善CKD慢性炎症状态的作用。当出现下列情况禁忌:终末期肾衰竭、消化道症状严重无法保证热量摄入及不能耐受;出现严重合并症例如心包炎、高血压、水钠严重潴留、大量蛋白尿。
LPD法+必需氨基酸(EAA)法:是在LPD基础上予以足够热量加用必需氨基酸。加用EAA后可任选食物蛋白质来源。EAA可以口服或者静脉给药。
LPD法+复方α-酮酸(开同)法:疗效与EAA相似。可纠正各种代谢障碍,改善营养不良状况。显著改善精神、体力、食欲、皮肤瘙痒、骨痛等多方面症状。这一疗法对中枢神经系统、瘦素、α-促黑色素细胞激素(α-MSH)受体等可导致营养不良的因素都有调节作用。可使BMI趋向正常,BMI过高与肥胖、胰岛素抵抗有关,因此,这种疗法可能对脂质代谢有一定的改善作用。还可以增加胰岛素清除率。还可使尿素下降,降低血磷血AKP和血PTH水平。纠正酸中毒延缓肾功恶化。
充分证据表明,LPD可有效减少肾死亡,显著延缓患者进入透析的时间,节约医疗花费,是对目前肾保护策略的重要补充。
可以应用维生素比如小量叶酸、维生素C及维生素B6等。
3.贫血治疗 肾性贫血的治疗靶目标是血红蛋白(Hb)上限不要超过130g/L,当前治疗不达标者众多。糖尿病肾病患者贫血发生早而且多见,约1/3肾移植者存在贫血,且治疗情况很不理想。
(1)红细胞生成素(EPO):现在常规应用EPO,每次3 000~5 000U,每周2~3次。
(2)长效红系生成刺激因子:短效红系生成刺激因子(ESA)治疗贫血,Hb波动不易控制,长效ESA在此方面显示出优势。持续性红细胞生成素受体激动药(CERA)是一种长效新制剂,其半衰期达130h,每个月1次,可皮下注射或静脉注射。CERA可使Hb稳定在靶目标范围内,减少剂量调整。所有年龄的患者均可每月使用1次CERA,包括年龄>65岁的老年人。
(3)EPO受体激动药:EPO抵抗是临床重要难题,是终末期肾病患者预后不良的危险因素。如果患者产生抗EPO抗体而致EPO抵抗,可出现难以控制的贫血,大多需要输血维持,激素及免疫抑制药疗效也欠佳。Hematide是一种新合成的与EPO肽序列不相似的EPO受体激动药,可改善CKD患者的贫血状况,具有良好药物作用及耐受性,能够每4周给药1次,可用于治疗抗EPO抗体所致的纯红细胞再性障碍性贫血,效果明显,几乎未发生不良事件。新型铁制剂分别有望克服EPO抵抗和传统铁制剂的副作用。
(4)新型静脉铁剂:现有静脉铁剂引起的不良反应主要包括过敏反应以及自由铁所致的组织损伤,前者为免疫原性,大分子量铁剂容易引起,后者与自由铁量有关。过敏反应包括过敏性休克、荨麻疹、血管性水肿等。自由铁所致组织损伤可产生炎症反应,增加心血管事件的发生。铁剂尚有EPO抵抗作用。
Ferric carboxymaltose是一种新型静脉铁剂,临床前期研究及初步临床研究显示其有良好疗效,相关不良反应少,可大剂量、短时间内输注(1g,15min内输注),有望克服现有铁剂的不足。
4.降低肠道代谢产生的毒物 给予口服氧化淀粉或活性炭。中成药可选尿毒清或者肾衰宁口服。肠道也可予以含中药大黄的制剂灌肠。
5.控制血压 减少食盐的摄入,降压药选择血管紧张素转换酶抑制药、钙离子拮抗药、血管扩张药等。详细见前述内容。
6.针对肾性骨病的治疗
(1)控制磷酸盐代谢:维持血磷浓度在1.4~2.4mmol/L。限制含磷饮食。应用必需氨基酸和α酮酸控制血磷。必要时采取透析治疗。治疗CKD钙、磷代谢紊乱新的手段:如钙模拟剂(calcimemetics),维生素D的同类药物——帕立骨化醇(pari-calcitol),新型磷结合剂,如碳酸镧、非钙非铝磷结合剂、盐酸多聚丙烯酰胺renagel(含司维拉姆)、开同等。开同是一种含钙的磷结合剂,可纠正低钙高磷血症,每日剂量为1片/5kg体重。在没有饮食限制、维持先前用药剂量时,开同可显著降低血磷和甲状旁腺激素(PTH)水平,达到了纠正钙磷代谢紊乱、sHPT及肾性骨病的目的。碳酸钙+开同不受pH影响,因此,服其他含钙磷结合剂导致高钙血症者可换用开同。拟钙剂cinacalcet可用于治疗接受透析治疗的慢性肾疾病患者的继发性甲状旁腺功能亢进(SHPT),改善其钙磷代谢。
(2)控制钙代谢:血钙1.5~1.75mmol/L。大剂量碳酸钙可以升高血钙抑制甲状旁腺功能亢进、改善软骨病。
(3)维生素D治疗:当已经形成甲状旁腺功能亢进骨病时给予骨化三醇0.25~1.0μg/d口服。
(4)甲状旁腺切除术:对继发性甲状旁腺功能亢进的终末期肾病患者实施甲状旁腺切除术,可以显著提高患者血红蛋白水平,改善骨矿盐代谢。
(5)控制铝的代谢。
7.针对基础疾病治疗 有针对性的对原发病及时治疗可以延缓肾功能的恶化。如止痛药肾病停止服用止痛药后,肾功能会有不同程度的好转;狼疮性肾炎诱发肾功能不全,当发病迅速,处于活动期,双侧肾未有形态学改变,用激素和细毒性药物治疗会使肾功能恢复至不全代偿期。
(三)血液透析
血液透析疗法是利用半透膜原理。将患者血液与透析液同时引进透析器中,二者在透析器的半透膜两侧呈反向流动,借助膜两侧的溶质梯度、渗透梯度和水压梯度通过扩散、对流、吸附清除毒素;同时也补充需要的物质,纠正水、电解质和酸碱平衡紊乱。血液透析装置由透析器、透析液供给装置、电子监测装置三部分组成。
1.建立血管通路 血管通路将动脉血引入透析器,经净化后由静脉端回体内。血流量达到100~300ml/min才能保证有效透析。血管通路分为两种。
(1)紧急透析用的血管通路:分为外瘘、留置中心静脉插管、直接穿刺动、静脉。
(2)慢性透析用的血管通路:分为自体皮下动、静脉吻合内瘘、钛轮钉吻合内瘘、外瘘改内瘘、血管移植建造的动静脉内瘘。
2.血液透析治疗中的抗凝疗法 使用抗凝药防止透析器和血管通路凝血。透析过程中需要监测全血部分凝血活酶时间(WBPTT),活化凝血时间(ACT)。抗凝药常采用肝素。
(1)常规肝素抗凝重复大剂量注入法:首剂4 000U,每小时测一次凝血时间。假如凝血时间仅仅延长50%,则再重复1 000~2 000U。
(2)常规肝素持续输注法:首先给予肝素2 000U,每小时追加1 000~2 000U。
(3)低分子肝素法(LMWH):首剂3 000~2 000U,维持量为每小时750抗XaU/ml,或者单剂5 000抗XaU/ml。抑制凝血酶保存抗Xa因子可以使血液透析4h不发生凝血。
(4)无肝素透析:先用肝素冲洗透析器与管路,在透析过程中维持高血流速250~300ml/min。每15~20分钟由动脉端输注生理盐水100~200ml,并加大跨膜压或超滤液使输入的生理盐水脱出。此办法适用于高危出血倾向患者。
3.血液透析治疗方案与充分性 常规的透析疗法是每次4h,每周3次。然后具体患者根据其具体情况进行调整。以血尿素氮为衡量透析充分与否的小分子溶质清除指标;以尿素动力模型、血β2-微球蛋白的清除来评价大分子溶质清除指标;用监测干体重的方法使脱水适量。
4.多种血液透析技术
(1)短时高效透析疗法:每次透析时间≤3h。每周3次。血流量>300ml/min,尿素清除率>210ml/min。
(2)血液滤过(HF):此方法是模仿肾小球滤过原理。将动脉血液引入血滤器,水及溶质被滤过出来。以对流原理清除水分及大、中小分子溶质。此法清除大、中小分子由于血液透析。最近研究者认为联机血液滤过能够提高长期慢性透析患者的存活率,降低β2-微球蛋白水平同时增加透析患者BMI。
(3)连续动静脉血液滤过(CAVH):是血液滤过的一个类型。适用于心力衰竭、低血压伴有多脏器功能衰竭者。也适用于创伤后高分解型急性肾小管坏死者,以及对常规血液透析或腹膜透析不能耐受患者。
(4)血浆置换:将血浆分离出的血细胞和相应置换液混合后重新输回体内。
5.血液透患者发生的心性猝死 HD患者是全因死亡的高危人群。易感因素为:①缺血性心脏病——“动脉阻塞性冠心病”;②心肌超微结构和功能异常,包括内皮功能异常、间质纤维化、心脏灌注储备能力下降、对缺血耐受性降低等;③高血压;④左心室肥厚,这是患者因心律失常死亡的基础,贫血和血管顺应性下降又可加重左心室肥大;⑤心脏扩大;⑥主动脉僵硬度增加,这是透析患者死亡的独立预测因素;⑦电解质变化,血钾的变化会导致心律失常;⑧患者的自身特点,如年龄、性别、种族等,HD患者心源性猝死发生率随年龄增长而增高;⑨存在一些合并症,如营养不良、糖尿病、贫血、甲状旁腺功能亢进等。血透是一种间断治疗方法,其间患者有大量液体和电解质的变化。Bleyer等研究发现,HD患者心源性猝死的发生与血透时间有一定相关性。
治疗:对于血透患者,需进一步治疗以降低其高心源性猝死发生率。一些研究显示,合并冠心病、充血性心力衰竭和心肌病的血透患者及糖尿病透析患者服用β受体阻滞药可降病低死率。使用预防性置入式除颤器对非缺血性心肌病和左室射血分数低于35%的患者有保护作用。对于那些血钾过低的患者,调整透析液钾离子浓度可降低心室异搏性。此外,增加患者基础血钾水平,也可降低透析中QT间期和QT离散度,这均有利于降低猝死发生率。由于透析过程中患者死亡率高,因此所有透析中心均应备有除颤器。充血性心力衰竭合并低白蛋白血症和贫血也与高病死率相关,纠正这些因素也有利于改善患者存活率。另外,可增加透析频率至每周4次或每日透析,以避免长透析间期。总之,心源性猝死是血透患者死亡的最主要原因。但近年来,心源性猝死发生率并未显著降低。由于血透患者本身的特点,一些证明对普通人群有益的治疗可能不会对透析患者产生同样的疗效,因此,需更加重视血透患者发生的心源性猝死,并开展前瞻性预防透析患者猝死的临床研究。
6.血清透析患者发生的腕管综合征 腕管综合征(carpal tunnel syndrome)指腕骨内正中神经受到压迫所引起的手指麻木等神经症状。腕管综合征是血液透析病人常见的神经损害。病变多见于造口手且透析过程中加重,可能和缺血有关,淀粉样变是一个重要原因。据估计透析时间超过5年的病人35%有此并发症。
腕管有一定容积,指屈肌浅腱在腕骨内滑动,不会妨碍正中神经,但当局部骨折脱位,韧带增厚时,就引起腕管狭窄。屈浅深肌腱炎变时,由于肌腱的肿胀,膨大可致腕管相对狭窄,此时腕管内的正中神经即被挤压而发生神经压迫症状。
(1)临床表现与特殊体征:以正中神经受压迫为主要表现。手桡侧3个半手指有感觉异常,麻木或刺痛。感觉异常的位置恰恰和尺神经受压迫出现的感觉异常部位组成整个手掌。当手局部温度升高或夜间时症状加重。气温下降时手指发冷、发绀、手指活动笨拙,尤其是拇指外展肌力差。严重者鱼际肌萎缩,皮肤发亮,指甲增厚,患侧手指溃疡有神经营养障碍。
特殊体征有①叩诊试验:轻叩腕部正中神经部位,正中神经支配处会有触电样尖锐刺痛感;②屈腕试验:腕关节掌屈90°,40s后症状加重;③压脉带试验,压脉带使患手充血,1min后加重症状;④出汗试验:患侧手各指按压于茚三酮纸上,有纸液手指呈蓝紫色,病变正中神经支配手指出汗减少;⑤肌电图检查:大鱼际出现神经变性;⑥X线检查:是否有肥大性关节炎、桡骨下端陈旧性骨折、腕骨骨折脱位。
(2)治疗:推拿、针刺疗法,理疗等常可缓解症状。早期发现的腕管综合征可行外科手术,解除正中神经受压。透析病人腕管综合征,应合理安排及适当调整血透次数和时间,早期充分透析是治疗尿毒症腕管综合征最根本措施。
(四)腹膜透析
向腹腔内注入透析液,然后利用腹膜半透膜原理通过弥散和渗透清除机体代谢废物,潴留的水分。腹膜透析装置包括:腹膜透析导管、腹膜透析液、连接管及消毒装置、腹膜透析机。腹膜透析的主要并发症是腹膜炎。
腹膜透析方式选择:
1.间歇性腹膜透析 每次腹腔保留透析液1h。每日交换10~20次。每周透析时间不少于36~42h。急性肾功能不全或慢性肾功能不全者做腹膜透析治疗初始为3~10d。
2.持续性不卧床腹膜透析(CAPD) 每日交换4次。每次交换液为2 000ml。
3.持续性环式腹膜透析(CCPD) 在夜晚睡眠时应用循环自动式腹膜透析机交换腹透液4~6次。白天腹腔内留置2 000ml腹透液。
(五)纠正透析患者的营养不良
导致透析患者营养不良主要有三方面因素:营养物质摄入减低、高分解代谢异常和透析过程中引起的营养物质丢失。解决透析患者营养不良主要有以下方法:保证透析充分、防治感染、个体化饮食治疗和保护残余肾功能(RRF)。透析患者营养状态与RRF相互影响。通过RAS及前列腺素及交感神经系统的参与,营养不良可使GFR和肾血流量下降,RRF下降又将进一步导致HD或CAPD患者营养不良。
LPD+开同在纠正透析患者营养不良、钙磷代谢紊乱和保护RRF方面可能具有一定疗效。2006年国际专家顾问委员会共识建议透析患者:蛋白摄入:HD患者1.2g/(kg·d),CAPD患者1.0g/(kg·d);能量摄入:125.5~146.4kJ/(kg·d)[30~35kcal/(kg·d)];同时补充开同,推荐剂量:1片/(5~8kg·d)。短期应用LPD[0.8g/(kg·d)+开同(12片/d)]是治疗维持性HD患者难治性高磷血症的安全方法。
(六)透析患者猝死预防与治疗
主要包括药物预防、使用埋藏式电复律除颤器(ICD)两方面内容,可分为一级预防和二级预防。
1.药物预防
(1)胺碘酮。胺碘酮可作用于钠、钾和钙离子通道,对α和β受体也有阻滞作用,可用于房性和室性心律失常,对心脏停搏患者,如有持续性室颤或室速,在连续3次电除颤和应用肾上腺素无效后,建议使用胺碘酮。用法为即刻用胺碘酮300mg,然后再次除颤,如仍无效,于15min后重复使用150mg(速度15mg/min),最大剂量2 100mg/24h,室颤转复后予维持量720mg/24h(0.5mg/min)。
(2)β受体阻滞药:不仅可降低室性早搏及室性心动过速所导致的心源性猝死发生率,而且可降低儿茶酚胺对血压、心率及心肌收缩力的影响,有助于防止冠状动脉血栓形成,改善冠状动脉循环。透析患者充血性心力衰竭(CHF),尤其是与扩张性心肌病变有关的心衰是心脏病死亡的独立危险因素。有证据表明,卡维地洛作为第三代β受体阻滞药可降低心力衰竭病死率。此外,与安慰剂组比较还显著降低全因病死率、住院率、致死性心梗和卒中发生率。
(3)血管紧张素转换酶抑制药:肾素-血管紧张素系统阻滞药除能有效治疗高血压、保护肾外,还可通过对不同靶点的阻滞防止心肌重构,改善心力衰竭,降低心源性病死率。
2.埋藏式电复律除颤器 近10年来,数项大型随机对照研究显示,ICD治疗恶性心律失常、预防心源性猝死的效果优于抗心律失常药,ICD的应用日益受到重视,它已成为心源性猝死高危人群的首选治疗方法。ICD治疗可简单地分为一级预防和二级预防。如果患者发生过室性快速心律失常(包括VF和VT)所致的心搏骤停、确证有过VT或VF等重大事件或伴有明显器质性心脏病并可诱发室性心律失常的晕厥,ICD的应用为二级预防。相反,对于没有发生过上述心脏事件,但存在发生致死性室性心律失常危险的患者,这类ICD的应用属于一级预防。
与非CKD患者一样,ICD治疗可对终末期肾病患者预防猝死带来益处,但由于可能担心ICD置入后影响患者的整体生活质量,感染、血栓等并发症和(或)医师对终末期肾疾病患者置入ICD认识不足等多种原因使ICD应用不足。
(张琪琦)
(七)肾移植
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














