1.胚胎 妊娠18d人胚前肠前壁增厚发生肝芽,分化为肝胚母细胞,表达细胞角蛋白(cytokeratin,CK)8、18和19,是双潜能的先祖细胞,可分化为肝细胞和肝内胆小管细胞。肝芽尾部发生胆总管和胆囊;顶部发生横膈膜。
(1)肝细胞系:肝胚母细胞在内皮细胞围绕的空间生长,这一空间与脐肠系膜静脉的毛细血管丛连接,从而形成肝板与血窦相间的肝实质架构。大多肝先祖细胞逐渐消失,细胞角蛋白19而分化为肝细胞,以合成甲胎蛋白(AFP)和白蛋白为特征,妊娠12周人肝细胞合成胆汁酸。
(2)胆小管细胞系:小部分肝胚细胞分化为胆小管细胞,表达专有的CK7,在围绕门静脉的间质中发育,随门静脉向肝内伸展。胚胎期的肝内胆小管相当于成年期的Hering小管和末端胆小管,形成汇管区中的结构,出生后数周肝内胆管树才能发育完全。
(3)血窦壁细胞:内皮细胞排列成最初的肝血窦,妊娠3个月才有其他细胞,包括肝星状细胞参与。Kupffer细胞来自卵黄囊衍生的巨噬细胞(Mφ),在肝内聚集;也可由造血干细胞在肝内发育。
2.干细胞
(1)干细胞:胚胎干细胞是多功能或全能的,能无限地自行复制和更新;并在适当的条件能分化为任一种细胞系。胚胎干细胞有特征的表面标志,含有高水平的端粒末端转移酶活性,提示其永生性。
造血干细胞可以横向分化为肝细胞。损伤肝组织产生的因子刺激干细胞的横向分化。
(2)肝先祖细胞:成年体内的绝大多数脏器也有多能干细胞,是脏器组织周期性细胞转换的先祖细胞,用以置换凋亡的细胞。在周期性的组织转换中,仅置换需要数量的细胞,为此,先祖细胞不对称地分裂为一个能进行分化的子细胞和一个能自行复制的先祖细胞;而在组织损伤时打破了这一平衡,迅速提供修复需要的先祖细胞。先祖细胞隐藏在肝闰管中。小管始于小叶内,部分排列为肝细胞、部分为胆小管细胞,自胆小管引流胆汁至汇管区的终末胆管。常规组织染色不很明显,CK19和CK7染色才易见。肝闰管是肝细胞和胆管的真正界面是肝先祖细胞所在的“壁龛”。
(3)卵圆细胞:肝先祖细胞增生而生成卵圆细胞,同样,肝组织融合性坏死时由小胆管反应产生一种小多角肝细胞,都是上皮细胞的前体细胞(图1-2),是肝细胞再生的一个重要来源。
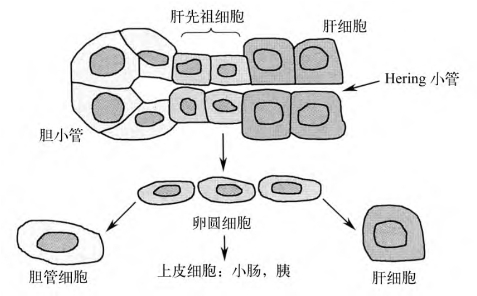
图1-2 Hering小管中的肝先祖细胞
由多能的肝干细胞衍生卵圆细胞,再发育为胆管细胞,肝细胞或肠、胰上皮细胞
(引自:骆抗先.乙型肝炎基础和临床.3版.北京:人民卫生出版社,2006.)
在慢性病毒性肝炎,炎症激活肝先祖细胞,其数量与实质的炎症一致,明显散在分布,向小叶中心移位,附近可见过渡型的卵圆细胞,提示其向肝细胞系发展。汇管区的胆小管反应和肝先祖细胞与界面性炎症的程度一致。由多能的肝干细胞衍生卵圆细胞,再发育为胆管细胞、肝细胞或肠、胰上皮细胞。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。













