上面我们讨论过,抽吸的脂肪组织中祖细胞所占成熟细胞的比例明显降低。由于脂肪组织衍生干细胞主要负责脂肪组织的重新构建,并且通过子代脂肪细胞取代衰老细胞的方式而完成脂肪组织的更新,这一脂肪组织衍生干细胞/脂肪细胞的低比率可能是移植脂肪组织长期萎缩的主要原因。在当前发现和假设的基础上,我们设计了一个新的治疗方法,称为细胞辅助的吸脂-脂肪移植疗法(cell assisted liposuction,CAL)。这一方法通过提供新鲜分离的含有脂肪组织衍生干细胞的基质血管碎片,将低祖细胞含量的脂肪组织转化为祖细胞含量丰富的脂肪组织(图7-11)。至少有三个以上的实验研究证实了补充脂肪祖细胞可以增加成活脂肪组织的重量和体积。在细胞辅助的吸脂-脂肪移植疗法里,我们将新鲜分离的基质血管碎片细胞加入到作为活性生物支架的脂肪抽吸物中(图7-5)。

图7-8 在GFP和野生型小鼠之间进行脂肪交替移植的组织学分析。将GFP小鼠的腹股沟脂肪(绿色)移植至野生型小鼠皮下,反之亦然。4周后,将移植脂肪组织收获后行周脂素(活性脂肪细胞,红色)和赫斯特染色(细胞核,蓝色)。组织学分析提示,大多数活性脂肪细胞是二代脂肪细胞,由供体衍生。而其他细胞,例如毛细血管和油脂囊周围的浸润细胞由受体衍生

图7-9 脂肪组织移植3周后的组织学分析。脂肪移植3周后的组织切片,经周脂素(活性脂肪细胞,红色)和赫斯特染色(细胞核,蓝色)后发现,大量脂肪细胞已经死亡(周脂素阴性),即它们已经成为脂肪滴(部分死细胞由星号标记)。同时,小的新生脂肪细胞(周脂素阳性)出现并取代油脂滴。这一结构重组过程非常缓慢。脂肪滴可以存留很长时间而不被清除和吸收,从而保持移植脂肪的体积不变。这一现象无法在HE染色中观测到,因为后者难以将活性脂肪细胞从死亡细胞中区别开来

图7-10 脂肪组织移植8周后的组织学分析。脂肪移植8周后的组织切片,经周脂素(活性脂肪细胞,红色)和赫斯特染色(细胞核,蓝色)后发现,小的新生脂肪细胞(周脂素阳性)和死亡的脂肪细胞(周脂素阴性)都已消失,只剩下再生的活性脂肪细胞和更大的油脂囊。这些油脂囊周围被Ki67阳性染色的增殖细胞环绕,后者主要是浸润的巨噬细胞
脂肪组织衍生干细胞在细胞辅助的吸脂-脂肪移植治疗中的作用可能有四种,部分作用已经在之前的研究中得到证实。首先,脂肪组织衍生干细胞可以分化为脂肪细胞参与到脂肪组织的再生中。其次,脂肪组织衍生干细胞可以分化为血管内皮细胞,也可能直接分化为血管壁细胞,从而促进新生血管形成和移植物存活。第三,脂肪组织衍生干细胞可以在创伤、缺氧以及其他情况下释放肝细胞生长因子和基质细胞衍生因子(stromal cell derived factor-1,SDF-1),这些因子影响周围的受区组织。第四,脂肪组织衍生干细胞在未分化状态存活下来,参与生理性的组织更新和重建。尽管脂肪细胞的寿命很长(2~10年),但是大多数脂肪细胞在脂肪移植后迅速死亡,或者导致移植失败或者由脂肪组织衍生干细胞衍生的新生脂肪细胞取代。
从超过600例的临床病例中得到的结果应该说是振奋人心的。尽管存在着个体差异,但是相比于传统的脂肪移植,该项治疗具有超强的移植脂肪体积维持结果。补充脂肪组织衍生干细胞可以控制移植后的脂肪萎缩,使在传统脂肪移植3个月后出现的组织体积减小在这里可达到最小化。
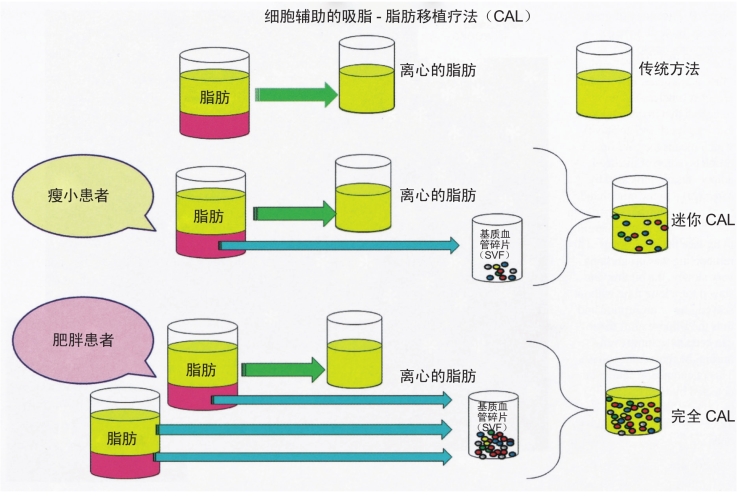
图7-11 细胞辅助的吸脂-脂肪移植疗法(CAL)的概念。在传统的脂肪移植中,脂肪抽吸物中的脂肪部分经离心后用于注射。而CAL在祖细胞含量相对较少抽吸脂肪中加入基质血管碎片(SVF),使其成为富含祖细胞的脂肪组织。将新鲜分离的SVF附着在作为支架的抽吸脂肪上。通过胶原酶消化所得的SVF中含有10%~40%的脂肪祖细胞(ADSCs)(CD34+CD31-CD45-),其中的部分细胞具有多向分化潜能,可以在体外分化为几种不同的细胞系。在瘦小患者中应用迷你CAL时,只需应用抽吸脂肪的液体部分来分离SVF,而在肥胖患者上应用完全CAL时,还需要再额外抽吸一份脂肪以供提取SVF。大量的基础和转化医学研究证明脂肪衍生干细胞具有与骨髓衍生干细胞相似的潜能,前者已经成为细胞治疗工具的兴趣所在
在临床试验中,注射了基质血管碎片细胞的患者中有2例出现异位纤维发生。在细胞疗法中应用附壁的间充质干细胞,有时可见一些细胞的异常行为,例如细胞分化为肌成纤维细胞。尽管这些细胞是从成年人组织衍生而来,并未经过大量的人工操作,我们还是应该将这些发生意外细胞行为的可能性考虑在内。通常我们提倡在移植之前,应该将脂肪组织衍生干细胞与细胞、组织、细胞外基质或者生物支架附着在一起,以避免细胞的意外迁移和分化。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。

















