第一节 皮质醇增多症
皮质醇增多症(hypercortisonism)是指任何原因引起以皮质醇分泌增多为主的肾上腺皮质功能亢进症,亦称库欣综合征(Cushing′s syndrone)。临床是以向心性肥胖、满月脸、多血质面容、皮肤紫纹、痤疮、高血压、低血钾、糖尿病、骨质疏松等表现为特征的一组综合征。因是美国外科医师Cushing Haivey(1869-1939年)首先提出(1932年),故称之为库欣(Cushing)综合征。
一、病因及分类
按照皮质醇分泌过多是否依赖于ACTH的作用可将库欣综合征分为两大类。
1.ACTH依赖性皮质醇增多症
(1)下丘脑垂体性皮质醇增多症:亦称为库欣病。此型为皮质醇增多症中最常见的一种,据不同资料报道,占60%~70%,最高达78.1%,主要是因垂体促肾上腺皮质激素(ACTH)分泌过多,从而引起肾上腺皮质增生,分泌过多皮质醇(F)。尸检和手术证实,其中约90%存在垂体腺瘤,除少数为大腺瘤外,绝大多数(80%~90%)为<10mm的微腺瘤。另有小部分为垂体嗜碱细胞增生,目前研究认为,与下丘脑促肾上腺皮质激素释放激素(CRH)分泌过多有关。
(2)异源性ACTH综合征:占皮质醇增多症的10%~15%。因垂体、肾上腺以外的肿瘤产生具有ACTH活性的物质(极少数为CRH活性的物质),促使肾上腺皮质增生所致。肺燕麦细胞癌是异源性ACTH综合征中最常见的病因,约占50%或以上,其次为胸腺瘤(15%),胰岛细胞瘤(15%),类癌(肺、肠、胰腺、卵巢等),甲状腺髓样癌,嗜铬细胞瘤,恶性黑色素结肠癌,肝癌和卵巢无性母细胞癌,甲状旁腺癌,肾母细胞癌及鼻咽癌等。这类肿瘤细胞多来自胚胎神经脊APUD系统分化的组织。
2.非ACTH依赖性皮质醇增多症
(1)肾上腺皮脂腺瘤:占皮质醇增多症的10%~15%,多为单侧、孤立性腺瘤,极少双侧、多个腺瘤(图16-1)。
(2)肾上腺结节样增生:少见,多为双侧多结节(图16-2A)。
(3)肾上腺皮脂腺癌:发病率报道不一,约占库欣综合征的10%,常为单侧病变(图16-2B)。
(4)医源性皮质醇增多症:见于长期应用糖皮质激素治疗的患者,肾上腺多萎缩呈条索状。

图16-1 CT腹部扫描
A.右侧肾上腺腺瘤;B.双侧肾上腺腺瘤;C.左侧肾上腺腺瘤(箭头所示)

图16-2 CT腹部扫描
A.双侧肾上腺大节结增生;B.双侧肾上腺皮质癌(箭头所示)
二、病理学
1.肾上腺皮质病理学
(1)皮质增生:多为双侧性,极少数为单侧,对侧可缩小。肾上腺重量可较正常(8~12g)增大2~3倍,尤以异源性ACTH综合征为甚,可达24~50g。表现为弥漫性增生和结节性增生两种形式,前者多见,增生的肾上腺厚实、饱满、表面光滑、切面可见黄色斑点,镜下皮质束状带细胞肥大,胞核小,圆形、染色中等,胞质内充满伊红颗粒,脂质很少,与网状带细胞不易区别。少部分患者为束状带和网状带细胞同时增生。双侧结节性增生约占皮质增生的20%,肉眼可见肾上腺皮质内有许多黄色结节,镜下结节内为分类正常的束状带细胞,内含脂质多,清亮透明;结节外为增生的束状带细胞,胞核致密。球状带常不受影响。
(2)皮质腺瘤:均有完整包膜,直径1~6cm,多为3~4cm,呈圆形、椭圆或异形,重量10~70g,切面呈淡黄色或粉红色,质地致密。镜下多数细胞质内有伊红色颗粒,部分细胞呈空泡状。肿瘤周围及肿瘤对侧的肾上腺皮质萎缩变薄,包膜增厚。
(3)皮脂腺癌:多>100g,重量可达数千克,多数肿瘤有包膜,少数包膜不完整,肿瘤切面为粉红色或软鱼肉状组织,血管丰富,常有坏死、出血、囊性变或部分钙化。镜下癌细胞可类似良性肿瘤或呈多形性,排列成片状或巢状,胞核深染,胞质成伊红色颗粒或空泡状。瘤细胞可浸润包膜、血管或周围脏器,也可转移至肝、淋巴结、肺等处。
2.垂体病理
(1)垂体腺瘤:80%~90%的腺瘤为微腺瘤,直径<10mm,以单个腺瘤为多数,蝶鞍常不扩大;只有约10%的腺瘤直径>10mm,可使蝶鞍扩大,甚至扩展到鞍外。腺瘤位于垂体前叶,没有包膜,腺瘤周围是被压迫的正常垂体前叶细胞。常规组织学染色可见微腺瘤多由嗜碱细胞组成,大腺瘤则多为嫌色细胞瘤,亦有嫌色细胞和嗜碱细胞组成的混合性腺瘤。电镜下可见细胞内有直径为200~700nm的分泌颗粒,免疫细胞化学检查显示细胞的分泌颗粒内富含ACTH等肽类物质。
(2)ACTH细胞增生:极少数库欣病患者表现为垂体嗜碱细胞增生,增生的细胞内富含ACTH及其他有关多肽的分泌颗粒。
(3)Crooke变性:无论是何种原因引起的皮质醇增多症患者,垂体分泌ACTH的细胞瘤(群)中细胞和周围的透明变性处会由平均直径为7mm的微丝状物质组成。电镜检查显示这些腺瘤中均可见到继发于过多皮质醇分泌所引起的细胞透明变性(Crooke变性),即细胞核周围的透明变性。
三、病理生理和临床表现
1.脂肪代谢紊乱 皮质醇分泌过多对脂肪代谢的影响是促进脂肪动员(三酰甘油分解为甘油及脂肪酸)和抑制脂肪合成(阻碍葡萄糖进入脂肪细胞);但皮质醇的升糖作用则刺激胰岛素(INS)分泌增多,从而促进脂肪的合成。故在库欣综合征患者,脂肪的分解和合成都被促进,其中合成代谢相对旺盛,至体脂总量增加。由于体内各部分脂肪组织对皮质醇的敏感性不同,引起脂肪的重新分布,主要表现为四肢脂肪移向躯干部,形成特征性的向心性肥胖。患者面、颈、躯干部皮下及腹腔内网膜组织脂肪过多沉淀,出现满月脸、水牛背、锁骨上窝脂肪垫和悬垂腹等典型症状(图16-3)。

图16-3 库欣综合征典型表现
患儿,女性,11岁,表现为向心性肥胖、满月脸和水牛背
2.糖代谢紊乱 过量皮质醇促进肝糖原异生,拮抗INS对糖代谢的作用,减少葡萄糖被肌肉及脂肪组织的利用,引起不同程度的血糖升高。60%~90%的患者为IGT,10%~30%的患者出现类固醇性糖尿病,该类糖尿病患者很少出现酮症或酮症酸中毒。
3.蛋白质代谢紊乱 大量皮质醇不仅抑制肝外组织摄取氨基酸合成蛋白质,也促进这些组织的蛋白质分解引起负氮平衡,从而影响皮肤、肌肉、骨骼等组织的生长和修复。表现为:①皮肤菲薄,易损伤发生瘀斑,腹部、臀部、腹股沟、腘窝、腋下甚至四肢皮肤宽大紫纹(图16-4),毛细血管扩张,多血质面容。②全身肌肉萎缩,尤以四肢为著,肌无力。③久病常影响骨骼,骨基质的蛋白质分解,引起骨质疏松,皮质醇对维生素D的拮抗作用可引起骨钙的丢失;临床表现为腰痛、胸肋骨痛,可发生脊柱压缩性骨折及楔状畸形,身高缩短,胸骨隆起,肋骨等多处病理性骨折。④儿童患者骨骺生长发育障碍。
4.电解质代谢紊乱 除皮质醇分泌过多外,11-去氧皮质酮和皮质酮分泌也增加,可引起体内水、钠潴留,钾氯排出增多,严重者发生低钾低氯性碱中毒。以肾上腺严重增生,癌肿或异位ACTH综合征患者为常见,可伴有夜尿增多。

图16-4 皮肤紫纹
5.高血压 由于过多皮质醇和盐皮质激素引起的水、钠潴留及皮质醇加强了去钾肾上腺素和血管紧张素的升压作用,90%的患者中有中等程度以上的高血压,一般高于150/100mm Hg(20/14kPa),多数为持续性,常有动脉硬化。患者主诉头痛、头晕、胸闷等,长期高血压可并发左心室肥大、心律失常,心力衰竭、脑血管意外和肾衰竭。
6.性腺功能障碍 皮质醇增多将影响下丘脑及垂体功能(抑制LH分泌),生殖年龄的女性患者多有月经减少或闭经、不孕,只有少数(<25%)病情轻者月经可正常且能生育。男性患者多有性欲减退或阳萎,睾丸小而软。肾上腺增生累及网状带分泌较多脱氢表雄酮、雄烯二酮等活性较低的雄激素,在男性不足以补偿睾酮的减少,但可引起毳毛增多、痤疮、皮脂腺分泌旺盛;女性亦可出现痤疮、多毛,如出现乳房萎缩,眉毛、阴毛增多,阴蒂肥大,应警惕肾上腺皮质腺癌。
7.皮肤色素沉着 ACTH依赖性皮质醇增多症患者可有不同程度的皮肤色素沉着,常为均一性,以齿龈、舌系带、指掌纹、甲床及乳晕等非暴露部位色素沉着为特征性改变,尤以异位ACTH分泌及行双侧肾上腺切除术治疗后的患者为主。主因ACTH及β-促黑素(β-MSH)分泌过多所致。亦有少数同类患者无色素沉着,所谓的“白库欣”。可能与皮肤色素细胞自身功能(对ACTH和β-MSH的敏感性)的个体差异有关。
8.其他
(1)过多皮质醇对骨髓的刺激作用,导致细胞增多,中性粒细胞及血小板也增多,嗜酸粒细胞和淋巴细胞则常减少。
(2)皮质醇对大脑皮质的兴奋作用致使本病者常有不同程度的精神、神经异常,轻者可有失眠、欣快感、情绪不稳定、易躁易怒;重者可引起精神分裂症或忧郁症。
(3)长期高皮质醇血症抑制机体的免疫功能,降低对感染的抵抗能力,患者常易患皮肤、呼吸道、泌尿系统等处感染,且不易控制,迁延不愈,尤以皮肤(指甲)真菌感染最常见。
(4)腺瘤和腺癌所致者常可有肿瘤局部压迫的症状,如垂体大腺瘤可伴有蝶鞍扩大,压迫视神经则出现视野缺损,亦可影响其他脑神经。
(5)肾上腺皮脂腺癌癌肿多很大,常因发现腹部包块就诊,异位ACTH综合征的原发病灶及转移灶可有其相应的临床改变。
四、实验室检查
1.常规检查
(1)血常规:部分患者红细胞计数及血红蛋白在正常高限或略高于正常,血细胞比容多正常。白细胞总数常轻度增高,中性粒细胞比例增加,嗜酸粒细胞则显著减少。
(2)电解质:皮质醇分泌过多者可有低血钾、低血氯性碱中毒,血钠含量多正常。血钙正常,血磷在正常低限或稍降低,约40%的患者尿钙增多。
(3)血糖:约70%的患者有不同程度的葡萄糖耐量异常,仅10%~15%的患者有空腹高血糖。糖耐量异常者可伴有高胰岛素血症。
2.激素水平测定
(1)血皮质醇(F)及尿游离皮质醇(UFC)测定:正常人血ACTH及F水平以上午8~9时最高,午夜0~1时最低(正常值参照本地检验常规),具有明显的昼夜节律。库欣综合征患者,8时及0时F水平均可升高,尤以0时水平升高最为显著,可与8时水平持平,甚至高于8时水平,失去昼夜节律,有诊断特异性(表16-1)。UFC水平的升高程度不一,以肾上腺瘤、异位ACTH综合征患者升高更明显。尿17-羟皮质类固醇(17-OH)、17-生酮皮质类固醇(17-KGS)作为皮质醇的代谢产物排出量也相应升高。
表16-1 121例库欣综合征ACTH和皮质醇测定水平分布

(2)血浆ACTH测定:ACTH依赖性库欣综合征患者血浆ACTH水平轻度升高,或在正常高限,失去昼夜节律,其中0时的ACTH水平变化更有特异性(表16-1),ACTH依赖型库欣病约95%均高于正常,而肾上腺来源的腺瘤或结节样增生则均在正常范围。N-POMC作为ACTH的前体物,其血中含量变化与ACTH平衡相关,肾上腺腺瘤和癌因肾上腺皮质激素的自主高分泌,抑制垂体ACTH及下丘脑CRH的分泌,血中ACTH和N-POMC水平降至正常低限或低于正常水平。
(3)其他垂体激素:少数垂体大腺瘤患者因肿瘤压迫垂体柄,减少泌乳素抑制因子(PIF)对泌乳素(PRL)的抑制作用,使血中PRL轻中度升高;血黄体生成素(LH)、卵泡刺激素(FSH)有不同程度下降,促甲状腺激素(TSH)及生长激素(GH)多正常。
3.特殊试验
(1)午夜一次法地塞米松抑制试验:主要作为库欣综合征的筛选试验,方法为午夜12时口服地塞米松0.75~2mg(可参考体重,多采用1~1.5mg),于服药后晨8时抽血测定皮质醇,正常人服药后血皮质醇应抑制到低于正常值以下水平,如达不到此水平,提示有皮质醇自主分泌。此试验有一定假阳性。
(2)小剂量地塞米松抑制试验:为是否库欣综合征的定性试验。方法:口服地塞米松0.5mg,每6h 1次×2d,分别于服药前一天及服药2d后(第3天晨)8AM抽血测定皮质醇,并留取服药前一天及服药第2天的全天尿液测定UFC。正常人服药后血F(8AM)和UFC应降至正常低值以下水平,如不能则提示皮质醇有自主性高分泌。美国库欣综合征临床指南中将小剂量地塞米松抑制后血F值定为低于50nmol/L(1.8μg/dl),诊断敏感性可达98%~100%,假阳性率较低。我院邹效漫等总结285例库欣综合征的小剂量地塞米松抑制试验结果,抑制后血F的ROC曲线的最佳切点是146.5nmol/L,假阳性率低1.1%,假阴性率3%。如按美国指标抑制后血F 50nmol/L的标准,假阴性率0.4%,假阳性率11%。
(3)大剂量地塞米松抑制试验:用于库欣综合征的定位、定性试验。方法:口服地塞米松2mg每6h 1次×2d,分别于服药前一天及服药2d后(第3天晨)8AM抽血测定血F,并留取服药前一天及服药第2天的全天尿测定UFC。绝大多数库欣综合征服药后血F或UFC可降至服药前水平的50%以下(抑制前水平——抑制后水平/抑制前水平=抑制率,<50%),而原发肾上腺的皮质腺瘤或癌则往往在50%以上。
(4)氨基导眠能和甲吡酮试验:主要用于鉴别库欣综合征的病因,氨基导眠能和甲吡酮均能在不同环节抑制胆固醇向皮质醇的转变,从而减少皮质醇合成,使皮质醇对ACTH的反馈抑制减弱,ACTH分泌增多,又促进F的合成。故正常人服用氨基导眠能或甲吡酮后不仅ACTH升高,血F及UFC均升高。方法:氨基导眠能试验,口服氨基导眠能0.25mg,每6h 1次×2d,分别于服药前及2d后8AM测定血ACTH和F,并留取服药前后和服药后第2天24h尿测定UFC,正常人服氨基导眠能后血ACTH升高可达对照值的3~4倍,血F和UFC也有不同程度的增加。垂体ACTH腺瘤患者服药后血F、UFC轻度下降,血ACTH轻度升高,远低于正常人升高幅度。肾上腺腺瘤和癌及异位ACTH分泌肿瘤服药后反应更低于垂体腺瘤患者。甲吡酮试验:口服甲吡酮(我国目前无此药)0.75mg,每6h 1次×2d,留尿及抽血时间和检测项目同氨基导眠能试验,结果评价亦相似。
五、定位检查
随着计算机在医疗仪器方面的广泛应用,库欣综合征定位检查的手段也有很大改观,以往的气脑造影,腹膜后充气造影均已淘汰,代之以超声、CT、MRI等无创而先进的诊查方法,一次检查定位率明显提高,必要时还可使用传统的静脉分段取血测定激素水平。在检查方法及检查部位的选择上应注意以下问题。
1.应结合临床表现及生化结果选择检查部位及方法(表16-2)。
表16-2 库欣综合征临床表现与定位检查选择
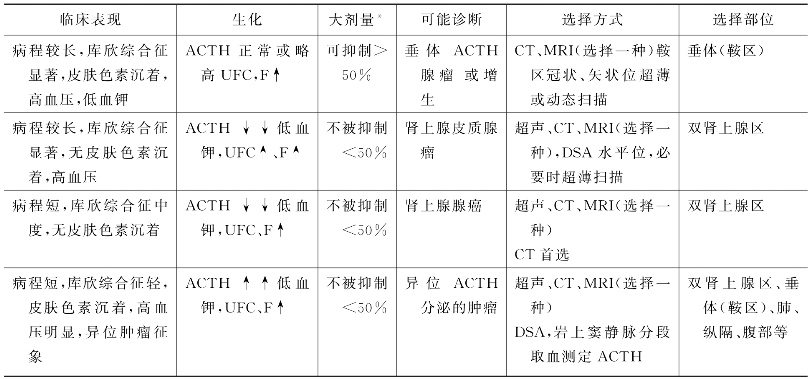
∗.大剂量地塞米松抑制试验
2.由于垂体ACTH腺瘤多<10mm,故需选择有冠状位或矢状位重建功能的CT扫描机型,扫描范围局限在鞍区,必要时做动态扫描。全脑水平位CT扫描对垂体ACTH腺瘤无诊断价值。当前,增强垂体MRI检查是垂体病变首选的影像学检查方法,如需行垂体微腺瘤γ刀(χ刀、质子刀)治疗者需行CT扫描定位。
3.如肾上腺发现单个或多个结节、肿瘤征象,但其余部分肾上腺不萎缩,且为增生饱满状,应高度怀疑病变主要为垂体ACTH分泌过多。少数大结节样肾上腺皮质增生,亦需除外依赖于ACTH分泌的因素。
六、诊断
1.典型临床表现,结合病史、实验室检查,影像检查结果,确诊并不困难。常规的检查步骤,见图16-5。

图16-5 库欣综合征常规的检查步骤
2.除常见皮质醇增多症临床检查外,诊断时尚需注意以下几点。
(1)库欣病:因垂体ACTH腺瘤多较小,在未能检测血浆ACTH或N-POMC的医院,定位诊断常较困难,如存在皮肤色素沉着、影像学显示双侧肾上腺饱满,仍支持病灶位于垂体,治疗以去除垂体病灶为妥,勿急于行肾上腺切除术,以免Nelson综合征或病变反复。
(2)周期性库欣综合征:已有病例报道,库欣病呈周期发作。临床症状为间断发生的向心性肥胖、紫纹、痤疮等库欣征象,可自行缓解,间隔一段时间后再发。症状出现时多无高血压、低钾血症,血ACTH多正常,F和UFC高于正常,不能被小剂量地塞米松试验所抑制。症状缓解期则均恢复正常人水平,影像学检查无异常。我院曾遇到1例类似病例,未行治疗,仅临床随诊。
(3)库欣综合征合并类固醇结合球蛋白(CBG)缺乏:F在血中的运输常有CBG伴行,故平时检测血中F的总值中约75%是与CBG结合形成,15%与白蛋白结合,仅10%为游离有活性的F,UFC则反映游离F的水平。血中CBG的含量对F的测定值影响较大。日本已报道2例CBG缺乏合并库欣综合征的病例,特点为临床明显“库欣”征象,血F不高(因血中CBG浓度低于正常人1/2以下),尿UFC高,易误诊,如遇类似病例,需注意鉴别。
(4)亚临床库欣综合征(subclinical Cushing′s syndrome):随着影像学研究的进展,肾上腺偶发瘤的检出率增高,对肾上腺偶发瘤的研究发现,约有10%的腺瘤存在糖皮质激素的异常分泌,这些人多伴有高血压、糖耐量异常和腹型肥胖,但无库欣综合征的临床表现。血浆ACTH、F节律及UFC可正常,亦可轻度升高,主要是2mg地塞米松抑制试验F(8AM)不能被抑制到正常值以下。如能发现肾上腺占位,则需行手术切除。
(5)葡萄糖依赖性胰岛素样多肽(glucose-dependent insulinotropic polypeptide,GIP)依赖性库欣综合征:临床多无典型的库欣综合征体征,可有多毛,常因影像学检查发现肾上腺单侧或双侧巨结节性增生而就诊。实验室检查的特点:雄激素水平增高;空腹血浆皮质醇正常或降低,ACTH明显降低或测不到,CRH可兴奋ACTH升高;尿UFC排出增加;进餐或OGTT糖负荷后血浆皮质醇升高,不能被大剂量地塞米松抑制,但能被奥曲肽抑制。病理检查显示肾上腺网状带多发腺瘤样结节。符合上述条件可确诊,治疗主要是异常肾上腺的手术切除,预后较好。
七、治疗
1.垂体ACTH瘤的治疗
(1)垂体瘤切除术:为首选疗法。无论是经生化及影像学定位明确的垂体ACTH腺瘤,抑或临床生化检查提示垂体ACTH腺瘤,影像学定位尚不确定的均以手术为首选,前者直接行垂体腺瘤切除术,后者行垂体探查术,多数能找到腺瘤切除,如未发现腺瘤,则可切除垂体中黏液组织(富含ACTH细胞),其有效率可达60%。根据腺瘤大小及对周围组织压迫情况选择经蝶或经颅手术途径。由于手术技术的改进,一次手术的治愈率已明显提高,据不同报道可达50%~80%。评价手术后预期疗效的方法,为测定术后次日晨8AM血ACTH、F,如均降至低于正常水平,则提示疗效佳(预后良好)。如因病程长,影响心肺功能耐受手术或严重骨质疏松,可先行药物改善一般情况,择期手术。
(2)肾上腺切除术:此为既往治疗库欣病的经典方法。分为双肾上腺全切除术及一侧全切加另一侧大部分切除(80%~90%)术。该方法缺点较多,首先,其为非病因治疗,尤其是后种术式,有病情复发的可能性,此外术后需终身用糖皮质激素替代治疗,另有15%~20%病人出现Nelson′s综合征。故目前仅限于那些垂体手术治疗未成功或有手术禁忌证的患者,多行双侧肾上腺全切术,术后用氢化可的松或醋酸可的松替代治疗。
(3)垂体放射治疗:适用于垂体手术治疗未能治愈者或有手术禁忌证者,随着放疗仪器的研究发展,照射剂量率高,均匀性好,时间短且稳定,照射野集中,半影小,治疗反映轻的新型仪器逐渐应运而生,目前我国大省市医院已较多地采用了加速器代替了60 Co照射,还由计算机控制的立体定向放射治疗(χ刀、γ刀、质子刀),为提高放射治疗的疗效减少不良反应提供了有利条件。一个疗程的照射量为45~50Gy,放疗起效时间6个月至1年,在起效前可辅以药物治疗。
(4)药物治疗:目前用于抑制垂体ACTH分泌的药物有两种。①赛庚啶(cyproheptadine)为5-羟色胺拮抗药,剂量为24mg/d口服;②溴隐亭(bromocriptine),为多巴胺能增效剂,剂量10~15mg/d口服。据目前临床观察,两种药单用的疗效均不稳定,需合用抑制肾上腺皮质功能的药物。多用于放疗后初期或术前准备。
2.肾上腺瘤或腺癌的治疗
(1)肾上腺瘤或腺癌切除术:一旦确诊,且无严重心血管、肺功能异常不能耐受手术者应行腺瘤或腺癌切除术,也可根据病情先行药物治疗,择期手术。
(2)放射治疗:仅用于肾上腺腺癌,可采取术中或术后癌床局部照射,不能耐受或失去手术机会的腺癌患者需联合药物治疗。
(3)药物治疗:适用于手术前准备及腺癌患者。作用于肾上腺水平的药物:①氨基导眠能(amiogluthimide),主要抑制胆固醇转变为孕烯醇酮,治疗剂量为0.75~1.5g/d,口服,其抑制皮质醇分泌的作用出现快,一般在1~2周可出现肾上腺皮质功能低下,故服药1周内即应加用地塞米松0.75mg/d,一方面补充皮质醇分泌不足,另则抑制ACTH分泌;部分患者服药后可出现雄激素分泌增多的临床表现,与该药对11-羟化酶有一定抑制作用有关。因服药并非为长期治疗,故多不做特殊处置,停药后症状自然缓解。②甲吡酮(mytyrapone),主要抑制11-β羟化酶的活性,治疗剂量为0.75~1g/d,口服,服药治疗注意事项同氨基导眠能。③密妥坦(OP′-DDD),作用于皮质醇合成的多个环节,且对肾上腺皮质束状带、网状代肿瘤细胞有杀伤作用,毒性较大,用于皮质腺瘤,可致瘤细胞坏死,初始剂量为2~6g/d,口服,疗效不显著者可在1个月后增至8~10g/d,亦需伍用地塞米松。④曲洛司坦(trilostane,WIN24540),为3β羟-类固醇脱氢酶的竞争性抑制药,可抑制皮质醇、醛固酮和雄烯二酮的生物合成,治疗剂量为150~200mg/d,口服。
3.异源性ACTH综合征的治疗
(1)异源性ACTH分泌灶的治疗。依据定位检查结果及肿瘤性质选择手术或放疗、化疗的方法。
(2)如难以查明病灶或未能清除病灶则采用抑制皮质醇合成的药物治疗。
八、预后
单个肾上腺糖皮质激素腺瘤手术切除多可治愈。ACTH腺瘤或增生所致库欣病的预后取决于腺瘤大小、治疗方法及治疗者的技能。有经验的医生对微腺瘤行经蝶径路手术切除多能一次性治愈。大腺瘤手术切除后多需追加鞍区放疗,也可治愈,但复发率较高,少数患者还需行肾上腺大部切除术,甚至肾上腺全切后糖皮质激素替代治疗。大结节性肾上腺增生需行肾上腺切除后糖皮质激素替代治疗。以上良性病变仅极个别垂体ACTH腺瘤患者因病变组织进犯海绵窦难以去除彻底,病变反复合并严重感染、糖尿病等其他疾病导致死亡。肾上腺皮质癌预后差,异位ACTH综合征的预后取决于原发病。
九、典型病例
1.病例资料 患者,女性,25岁。因“反复头痛3年”入院。患者于3年前无明显诱因出现头痛,呈持续性钝痛,无恶心、呕吐、头晕、面色苍白,无心慌、大汗、视物旋转、跌倒等。到当地诊所测血压150/110mm Hg,给予“硝苯地平缓释片10mg,每日2次”,血压控制在140/100mm Hg左右,头痛缓解。4个月前,患者出现脸变圆、腹围增大、体重增加,伴皮肤变薄、瘀斑、毛孔粗大、毳毛增多、痤疮,另有双膝关节疼痛,月经量减少、间期延长。到“吉林市人民医院”就诊,肾脏超声检查:右肾上腺区低回声包块,未予特殊处理。3d前来我院,门诊行肾上腺CT:右侧肾上腺结节,考虑为良性肿瘤,肾上腺皮质腺瘤可能性大;给予“盐酸特拉唑嗪1mg,每日1次”降压治疗后收入院进一步检查及治疗。病程中患者无心悸、胸闷、夜间阵发性呼吸困难,无口干、多饮,无肢体乏力、软瘫,无皮肤色素沉着等。患者目前精神状态良好,体力一般,食欲尚可,睡眠佳,近4个月来体重增加约5kg,大便无异常,夜尿每晚2~3次。6年前在“北京大学附属第三医院”诊断为“Ig A肾病”,经中药治疗6个月(具体不详)后好转,未再复发。个人史无特殊。父亲患高血压病、糖尿病、冠心病,母亲健康,无兄弟姐妹,家族中无传染病及遗传病史。入院查体:血压140/96mm Hg,身高166.5cm,体重64kg,BMI 23.08kg/㎡,脸稍圆,颜面、颈部毳毛增多,腹部未见紫纹,双侧胫前可见大小约2cm×3cm紫斑,甲状腺I度肿大,质软,未及结节,心肺腹未见明显异常。入院后检验结果:Hb A1c 5.4%。血液生化检查:血钾4.65mmol/L,CO2 CP 28.5mmol/L,余未见异常。甲状腺功能检查:TT4 90.5nmol/L(55.34~160.88nmol/L)、TT3 1.28nmol/L(1.01~2.95nmol/L)、FT3 3.27pmol/L(2.76~6.3pmol/L)、FT4 13.82pmol/L(10.42~24.32pmol/L)、TSH 0.17m U/L(0.35~5.50m U/L),性腺五项:LH 2.51m U/ml(男20~70岁1.5~9.3mU/ml;>70岁3.1~24.6m U/ml;女成年人0.5~76.3mU/ml;绝经期15.9~54.0m U/ml)、FSH 6.48U/L、T 2.72nmol/L(男19~70岁8.4~28.7nmol/L;女15~75岁0.5~2.6nmol/L)、E2 1 059.17pmol/L(男,成年人≤353.1pmol/L;女,成年人48.2~1 531.8pmol/L;绝经期<283.7pmol/L)、PRL 35.57μg/L(男2.1~17.7μg/L;女2.8~29.2μg/L)、P 1.84nmol/L,24h尿蛋白定量测定0.061g/24h(<0.15g/24h),GH 0.495μg/L(0.06~5.0)、IGF-I 244。肾上腺CT平扫+增强(图16-6)示:右侧肾上腺结节,考虑为良性肿瘤,肾上腺皮质腺瘤可能性大。卧、立位试验(表16-3)提示ARR 5.8。盐水输注试验(表16-4)提示患者基础血清醛固酮不高,盐水输注后血清醛固酮被抑制到277pmol/L以下。地塞米松抑制试验(表16-5)提示该患者基础血清皮质醇水平高,ACTH被抑制,小剂量地塞米松抑制试验血皮质醇未被抑制,大剂量地塞米松抑制试验尿UFC、血清皮质醇均未被抑制。诊断:①库欣综合征;②右侧肾上腺皮质腺瘤。转泌尿外科手术治疗,术后病理诊断(图16-7):肾上腺皮质腺瘤。

图16-6 患者CT平扫+增强
A.CT平扫;B.CT增强(箭头所示为病变部位)
表16-3 卧、立位试验结果

表16-4 盐水输注试验结果

表16-5 地塞米松抑制试验结果

病理检查所见:灰红色肿物一枚,大小3.5cm×2cm×1.5cm,临床已切开,切面灰红色,质软,部分包膜。
病理诊断:肾上腺皮质腺瘤(图16-7),肿瘤大小为3.5cm×2cm×1.5cm。

图16-7 患者术后病理检查
2.病例点评
(1)关于诊断:库欣综合征分为垂体、下丘脑来源的库欣病(占65%~75%)和肾上腺来源的肾上腺瘤(结节)。本例因缓慢进展的高血压及相关症状就诊,有毳毛增多、皮肤变薄、紫斑等体征,无典型的腹型肥胖和痤疮。存在中等程度高血压,无低血钾。各时点血清皮质醇均高于正常,且0AM和8AM节律倒置;小剂量和大剂量地塞米松抑制试验血皮质醇不能被抑制。各时点血清ACTH均明显低于正常。尿游离皮质醇高于正常,也不能被大、小剂量地塞米松抑制。腹部CT显示右侧肾上腺占位,支持来源于右侧肾上腺的皮质醇腺瘤。肾素-血管紧张素-醛固酮测定及相关动态试验结果为正常反应,可除外醛固酮增多症。
(2)关于治疗:库欣综合征99%以上均是良性病变,糖皮质激素过多分泌导致的全身多系统功能受损在去除病因后基本能够恢复正常,故定性、定位明确后,治疗以手术切除病灶为首选。本例患者经手术切除右侧肾上腺腺瘤,病理也予以确认,诊断正确。有些患者病程长,全身骨质疏松明显,继发糖尿病、高血压控制欠佳,需用抑制皮质醇分泌的药物(氨基导眠能)纠正代谢异常再行手术。
(田 慧 李 虹)
参考文献
[1]廖二元,莫朝晖主编.内分泌学.(2版),北京:人民卫生出版社,2007.
[2]汪寅章,闫双通,宗文漪.136例库欣综合征病人垂体-肾上腺皮质激素分泌特征分析.解放军医学杂志,2003,28(6):537-539.
[3]巴建明,席文琪,陆菊明,等.ACTH非依赖性大结节样肾上腺增生症7例报告并文献复习.解放军医学杂志,2007,32(3):245-247.
[4]Guignat L,Bertherat J.The diagnosis of Cushing′s syndrome:an Endocrine Society Clinical Practice Guideline:commentary from a European perspective.Eur J Endocrinol,2010,163(1):9-13.
[5]Nieman LK,Biller BM,Findling JW,et al.The diagnosis of Cushing′s syndrome:an Endocrine Society Clinical Practice Guideline.J Clin Endocrinol Metab.2008,93(5):1526-1540.
[6]Newell-Price J.Diagnosis/differential diagnosis of Cushing′s syndrome:a review of best practice.Best Pract Res Clin Endocrinol Metab,2009,23 Suppl 1:S5-S14.
[7]Murakami H,Nigawara T,Sakihara S,et al.The frequency of type 2 diabetic patients who meet the endocrinological screening criteria of subclinical Cushing′s disease.Endocr J,2010,57(3):267-272.
[8]Watanobe H,Nigawara T,Nasushita R,et al.A case of cyclical Cushing′s disease associated with corticosteroid-binding globulin deficiency:a rare pitfall in the diagnosis of Cushing′s disease.Eur J Endocrinol,1995,133(3):317-319.
[9]Nieman LK,Biller BM,Findling JW,et al.The diagnosis of Cushing′s syndrome:an Endocrine Society Clinical Practice Guideline.J Clin Endocrinol Metab,2008,93(5):1526-1540.
[10]高明,谷伟军,邹效漫,等.小剂量地塞米松抑制试验对库欣综合征诊断价值探讨.军医进修学院学报,2012,33(6):577-580.
第二节 原发性醛固酮增多症
原发性醛固酮增多症(简称原醛)是指由于肾上腺皮质分泌过多的醛固酮,而引起潴钠排钾,血容量增多而抑制了肾素活性的一种病症,临床表现为高血压和低血钾综合征。与正常及高血浆肾素活性的高血压病人相比,原醛症曾被认为是伴有较低的血管并发症发生率的一种相对良性的高血压,但近年来先后有报道,在原醛症病人中,心血管并发症的发生率可高达14%~35%;蛋白尿的发生在原醛症病人中也多于原发性高血压病人,国内文献报道,分别有22.3%~40.1%和2.7%~9.2%的醛固酮瘤患者发生蛋白尿和慢性肾功能不全。既往认为,原醛发生率占同期高血压患者的1%~2%,但近年报道采用敏感的血浆醛固酮与肾素活性比值(aldosterone/renin activity ratio,ARR)筛查,原醛在高血压患者中的比例可高达5%~13%。
一、醛固酮分泌的调节
肾素-血管紧张素系统是醛固酮分泌的主要调节因素,当有效血容量减少,血压下降。钠离子浓度减低等刺激时,肾小球旁细胞释放肾素增加,进而刺激血管紧张素Ⅱ增加,血管紧张素Ⅱ可刺激醛固酮的合成和分泌。钾离子是调节醛固酮分泌的另一重要因素,高钾刺激醛固酮分泌,低钾则抑制醛固酮分泌。ACTH亦能调节醛固酮的合成和释放,但对长期维持醛固酮的释放并非主要因素。
二、病因及病理亚型
原醛最常见的两种类型包括肾上腺皮质分泌醛固酮的腺瘤(醛固酮瘤,aldosterone producing adenoma,APA)及双侧(极少数可为单侧)肾上腺皮质增生(特发性醛固酮增多症,IHA)。其他少见的类型包括糖皮质激素可抑制型醛固酮增多症(glucocorticoid-remediable aldosteronism,GRA)、原发性肾上腺皮质增生(PAH)、产生醛固酮的肾上腺癌或异位肿瘤等。既往临床上醛固酮瘤为原醛的主要亚型,但近年来随着采用敏感的ARR比值筛查,多数早期及较轻的原醛得以获得诊断,这些患者多数是IHA。各种亚型在原醛中所占的比例,见表16-6。
表16-6 原发性醛固酮增多症的亚型

1.肾上腺醛固酮瘤(APA) 又称Conn综合征,女性多见,占原醛的35%左右。以单一腺瘤最为常见,双侧或多发性腺瘤仅占10%,个别患者可为一侧腺瘤,另一侧增生。醛固酮瘤体积一般较小,直径多<2.0cm,边界清楚,切面呈金黄色。
醛固酮瘤患者生化异常及临床症状较其他类型明显,其血醛固酮浓度与ACTH的昼夜节律相平行。
2.特发性醛固酮增多症(IHA) 特醛症在成年人原醛中比例约占原醛总数的60%左右,居第1位,病理特征为双侧肾上腺球状带增生(弥漫性或局灶性)。有学者认为,特醛症的发生可能是由于一种异常的醛固酮刺激因子所致或由于肾上腺对血管紧张素Ⅱ的敏感性作用增强所致,其升高的醛固酮水平可被ACEI及血清素拮抗药抑制。
3.原发性肾上腺增生 原发性肾上腺增生是原醛症中的一种特殊类型,其病理改变类似特醛症患者,可为双侧或单侧肾上腺结节样增生,但其临床及生化表现与醛固酮瘤相似,高血压及生化异常较特醛症更重,一般对螺内酯治疗有良好反应,单侧病变者需要手术治疗。
4.糖皮质激素可抑制性醛固酮增多症(GRA)多见于儿童,明显家族发病倾向,属常染色体显性遗传,正常情况下,球状带有醛固酮合成酶,束状带分泌11β-羟化酶;醛固酮合成酶和11β-羟化酶基因同在第8号染色体。DNA编码区有95%相同。GRA患者上述同源染色体之间遗传物质发生不对等交换。醛固酮合成酶基因与11β-羟化酶基因5′端调控序列(均在8号染色体)的编码序列融合形成嵌合体。其基因产物具有醛固酮合成酶活性,在束状带表达且受ACTH控制。该类患者血醛固酮水平轻度升高,血钾常正常,血醛固酮分泌受ACTH调节,可被小剂量地塞米松抑制,因此GRA可采用小剂量糖皮质激素治疗。
5.肾上腺皮质癌 多见于中年人,无显著性别差异,常因腹部占位或转移性病变就诊而被发现。除醛固酮外,常同时分泌糖皮质激素及性激素,血、尿醛固酮升高明显,低血钾明显,肿瘤常>5cm。病理学检查有时也难以明确诊断,如患者有肿瘤局部侵犯和远处转移表现可确诊。
6.产生醛固酮的异位肿瘤或癌 非常少见。
三、临床表现
1.高血压 高血压是原醛患者主要和早期的表现。随着病程进展,血压可逐渐增高,呈中度及重度高血压,且对一般降压药物治疗抵抗。据上海瑞金医院一组201例原醛患者统计,普食条件下平均血压在164±18/104±11mm Hg。美国Mayo临床中心对1957-1986年期间诊断的262例原醛患者统计,血压最高为260/155mm Hg;平均值(±SD)为184/112±28/16mm Hg,醛固酮瘤患者血压较特醛症者更高。
高血压的发病原理与醛固酮分泌增多引起水钠潴留和血管壁对去甲肾上腺素反应性增高有关。但长期的高醛固酮作用有“盐皮质激素逃逸”现象,因此原醛患者血钠并不会明显升高,多在正常或正常高限水平,多无水肿发生。在高血压病程较长的晚期病例,由于有肾小动脉及外周动脉硬化等因素加入,致使醛固酮肿瘤摘除后血压仍不易完全恢复正常。高血压病史久者常引起心脏扩大甚至心力衰竭。
2.低血钾 部分病例由于大量醛固酮的作用导致尿中钾排出增加,造成血钾降低。早期患者血钾可正常或在正常低限,仅在使用利尿药、呕吐、腹泻等情况时出现低血钾。随着疾病进展可表现出持续低血钾,常在3.0mmol/L以下。并出现低血钾相关症状。
(1)神经肌肉功能障碍:可表现为肌肉软弱无力或典型的周期性麻痹,常见于下肢,可累及四肢,重者可有呼吸困难。有周期性麻痹者在西方白种人中非常少见,但在亚裔中并不少见。阵发性手足搐搦及肌肉痉挛可见于约1/3的患者,伴有束臂加压征(Trousseau征)及面神经叩击征(Chvostek征)阳性。该症状与失钾、失氯使细胞外液及血循环中氢离子减低(碱中毒)后钙离子浓度降低、镁负平衡有关。严重低钾血症时,神经肌肉应激性降低,手足搐搦不明显,补钾后反而可加重。
(2)肾脏表现:慢性失钾可导致肾小管上皮细胞空泡变性,肾脏浓缩功能下降,表现为多尿、夜尿增加,在男性,有时易与前列腺炎导致的症状所混淆。
(3)心脏表现:伴有低血钾的原醛患者可有如下心脏改变。
①心电图为低血钾表现:QT延长、T波增宽、减低、倒置,U波明显。
②心律失常:可见期前收缩(室性期前收缩多见)、室上性心动过速。
(4)糖代谢异常:低血钾可致胰岛B细胞释放胰岛素减少,引起糖耐量减低,这种异常可通过补钾得到纠正。
3.碱血症 部分原醛患者由于醛固酮的保钠排钾作用,在肾小管内钠-氢离子交换加强,氢离子丢失增多,导致代谢性碱中毒,血p H、剩余碱和CO 2为正常高限或高于正常,尿液p H为中性或偏碱性。
四、诊断
原醛诊断步骤分3步:①在有原醛高危因素的高血压患者中筛查可能的原醛患者;②进行原醛的确诊试验;③进行原醛的亚型分型及定位诊断。
1.病例筛查试验 原醛的诊断应具备高血压、血和尿醛固酮增高且不被抑制,血浆肾素活性降低且不被兴奋等条件。既往将低血钾作为原醛症的诊断条件之一,但近年研究发现仅有9%~37%的原醛患者有低血钾,因此,低血钾可能只存在于较严重的病例中;只有50%的腺瘤和17%的增生病人血钾<3.5mmol/L,因此,低血钾作为诊断原醛症的敏感性、特异性和诊断阳性率均很低。
目前由欧洲内分泌学会及高血压学会、国际内分泌学会及高血压学会共同制定的“原发性醛固酮增多症病人诊断治疗指南”推荐应用ARR筛查高血压患者中可疑的原醛症病人,包括:①对药物抵抗性高血压;②高血压伴有持续性或利尿药引起的低血钾;③高血压伴肾上腺意外瘤;④早发高血压或40岁前发生脑血管意外家族史的高血压病人;⑤原醛症患者一级亲属的所有高血压病人。但目前ARR上升至何水平(切点)可以诊断为原醛尚有争议,况且临床检验相关激素受影响因素较多,其仅可作为一项筛查指标。目前各家报道关于ARR的切点多在20~50。比值大于该数值应怀疑原醛症,应行进一步检查。
由于许多药物和激素可影响肾素-血管紧张素系统的调节,进行检查时尽可能停用所有药物,特别是螺内酯、血管转化酶抑制药(ACEI)、血管紧张素受体拮抗药(ARB)类降压药及雌激素,应停用4~6周或以上,利尿药、β受体阻滞药、钙拮抗药等停用2周。药物对醛固酮及ARR的影响见表16-7。如血压过高,为确保患者安全,可选用α受体阻滞药如盐酸哌唑嗪、多沙唑嗪、特拉唑嗪或非二氢吡啶类钙离子拮抗药如维拉帕米缓释药等。
2.证实原醛的存在 影响血浆醛固酮的因素很多,基础醛固酮水平测定的意义有限。当醛固酮水平升高时,ARR比值升高仅仅是筛查出高度怀疑原醛的患者,确诊尚需要行醛固酮抑制试验以证实醛固酮不适当分泌增多。目前常用的确诊试验包括盐水负荷试验、高钠负荷试验、氟氢可的松抑制试验和卡托普利抑制试验。
表16-7 药物对醛固酮及ARR的可能影响

(1)盐水负荷试验:盐水负荷试验是确诊原醛症的常用检查方法之一(图16-8)。生理情况下细胞外液容量扩张或肾小管腔内钠离子浓度升高时,肾素分泌受抑制,醛固酮分泌减少,肾脏排钠增多,从而使高钠及高容量状况得以纠正,体内代谢维持平衡;原醛症患者醛固酮分泌呈自主性,不受高钠摄入的抑制。该试验广泛应用于临床原醛的诊断,试验方法为患者取卧位,给予静脉滴注生理盐水2 000ml,4h内输完,输注前后测定血浆醛固酮。结果显示正常人血浆醛固酮水平下降至138pmol/L(5ng/dl)以下,原醛症者不被抑制。试验的敏感性和特异性均为88%左右。该试验可加重生化异常,严重低血钾,高血压及充血性心力衰竭患者不宜进行。
(2)高钠试验:在高血压及低血钾得到控制后,每日摄入高钠饮食,钠218mmol/d(≈NaCl 12.8g),连续3d,在高钠饮食的第3天留取24h尿测定醛固酮、钠及肌酐,24h尿钠>200mmol/L说明钠摄入充足,24h醛固酮>12mg/24h应考虑自主性醛固酮分泌。该试验的敏感性和特异性分别为96%和93%。严重高血压患者进行该试验时应仔细评估其风险,该项试验进行过程中可增加尿钾排泄,导致低血钾加重,因此试验过程中应加强补钾,并密切监测血钾水平。
(3)氟氢可的松抑制试验:患者口服0.1mg氟氢可的松,每6h 1次,共4d,同时应用k Cl缓释片进行补充(每6h 1次,使血钾保持接近4.0mmol/L),应用缓释NaCl(30mmol,每日3次与餐同服),以及保持足够的食物盐摄取,以保证尿钠排泄率至少为3mmol/kg体重。第4天上午10时取血醛固酮和PRA,患者应取坐位,血浆皮质醇应测上午7时和10时值。第4天晨10时立位血浆醛固酮>6ng/dl同时PRA<1ng/(ml·h),血浆皮质醇在10时的值小于7时的值(排除ACTH混杂的影响)则可确诊原醛。该试验目前在临床已较少使用。
(4)卡托普利试验:卡托普利为ACE抑制药,可降低肾素调节的醛固酮分泌。方法:清晨卧位抽血测醛固酮及PRA,给予卡托普利(巯甲丙脯酸)50mg口服,2h后予坐位抽血测醛固酮和PRA。正常人服卡托普利后血醛固酮水平降低,通常降低>30%,或<416pmol/L(15ng/dl),而PRA增加,原醛症患者无明显变化。该试验敏感性为90%~100%,特异性为50%~80%。
血钾<3mmol/L时可抑制醛固酮水平(1/3原醛症患者醛固酮正常),因此,应补充血钾至3mmol/L以上再行上述试验较为可靠。
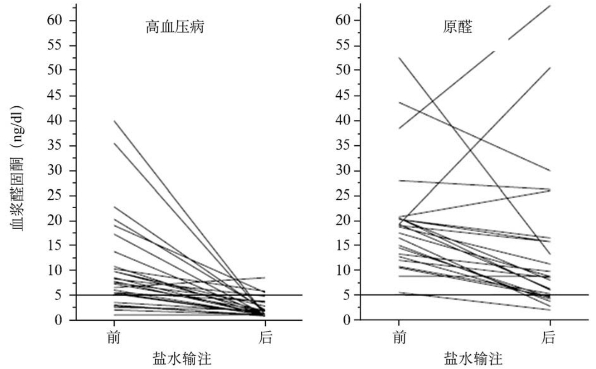
图16-8 盐水输注试验对原醛的诊断价值,原发性高血压患者(左侧),盐水输注后血浆醛固酮水平绝大部分可被抑制至5ng/dI(133pmoI/L)以下,而原醛患者(右侧)多数不被抑制
3.原醛病理亚型的确定 原醛亚型主要包括APA和IHA及其他少见类型,亚型鉴别的主要意义在于根据分型可确定不同的治疗方案。
(1)卧、立位试验:正常人血浆醛固酮受体位及ACTH昼夜节律调节。卧位醛固酮为50~250pmol/L,至12AM醛固酮下降;与皮质醇水平波动一致。立位(4h)可刺激肾素-血管紧张素系统,使血管紧张素Ⅱ增加,醛固酮上升。为增加刺激强度也可加用呋塞米,方法为肌内注射呋塞米0.70mg/kg,总量<40mg,立位时间可缩短至2h。试验前后测定血浆肾素活性、血管紧张素Ⅱ及醛固酮。
结果:正常人立位或加呋塞米刺激后PRA和醛固酮水平明显升高。原醛患者卧位时PRA受抑制,醛固酮升高,立位时醛固酮瘤者醛固酮水平大多无明显升高甚至反而下降,而特醛症者醛固酮水平上升明显,并超过正常人。
(2)地塞米松抑制醛固酮试验:原醛症者如发病年龄小,有高血压、低血钾家族史,体位试验中立位醛固酮无升高或反常性下降,肾上腺CT、MRI阴性应考虑GRA,可行该试验。目前有条件的单位对怀疑GRA的患者可做相关嵌合基因检测以证实。
方法:每日口服地塞米松2mg,共3~4周,GRA者血醛固酮在服药后可被抑制80%以上。特醛症和APA者服药后不受抑制或可呈一过性抑制(2周后复又升高)。
(3)影像学检查:可协助鉴别肾上腺腺瘤与增生并确定腺瘤部位及影像特征。
超声检查:可显示直径>1.3cm腺瘤,超声检查对于肾上腺较小病变不敏感,仅作为临床常规筛查。
肾上腺CT和磁共振显像(MRI):高分辨CT及MRI可显示直径>0.5cm的腺瘤,IHA扫描时可表现为正常或双侧肾上腺弥漫性增大或结节状增生。醛固酮瘤患者CT检查常表现为圆形低密度影,直径多<2cm,切除后大体病理检查呈金黄色。肾上腺皮质癌CT多表现为密度不均质占位,直径多>4cm。近年来,随着ARR筛查的应用,更多早期、较轻的原醛症患者被诊断,这些患者中CT检查区别APA和IHA并不准确,如在一个研究中发现,瘤体较小(<1cm)的APA患者CT检出率不到25%,不典型APA单从影像学特点判断可能被诊断为结节状增生(IHA),此时需结合其他功能试验综合判断。
磁共振(MRI)对肾上腺病变的诊断作用相对较差,因为大部分腺瘤直径不超过1cm,MRI只用于对CT造影剂敏感病人。
放射性碘化胆固醇肾上腺扫描照相:可发现直径在1.3cm以上的腺瘤,可靠性更差,结果常常含糊不清,目前多不采用。
(4)双侧肾上脉静脉取血(AVS):近年国内外广泛采用双侧肾上腺静脉分段取血测定醛固酮,以判断体内高醛固酮的来源。操作前30min开始及在整个采血过程中需连续输入ACTH(5U/h或50mg/h),以减少因应激诱发的ACTH释放。插管成功后分别从双侧肾上腺静脉及下腔静脉(IVC)取血,同时测定醛固酮及皮质醇,肾上腺静脉与IVC血标本皮质醇比值>10∶1提示操作成功。如一侧肾上腺静脉醛固酮/皮质醇比值大于对侧4倍以上有意义,证明醛固酮为单侧肾上腺(醛固酮/皮质醇比值高的一侧)来源,考虑为醛固酮瘤或PAH。若双侧均高,两侧相差<3倍,考虑醛固酮为双侧肾上腺来源。该检查的敏感性95%,特异性100%。
肾上腺静脉取血为有创检查手段,应由有经验的医生进行,常见并发症为腹股沟血肿,肾上腺出血及肾上腺静脉损伤等。
五、鉴别诊断
1.先天性肾上腺皮质增生(11β,17α-羟化酶缺乏等) 临床上由于酶缺陷,肾上腺皮质激素合成途径受阻,导致大量具有盐皮质激素效应的中间代谢产物增加,引起高血压、低血钾等。两种酶系缺陷均有双侧肾上腺增生。该类患者常有男性性早熟,女性假两性畸形或性不发育、ACTH升高等特征性表现,易与原醛症鉴别。
2.Liddle综合征 又称假性醛固酮增多症,为常染色体显性遗传性疾病。有家族聚集发病现象,人群中发病呈散发性。肾单位远端上皮细胞钠通道(ENa+C)处于异常激活状态,钠重吸收过多、容量扩张,血压升高。远端小管Na+-K+交换增加,K+排出过多,H+进入细胞内,造成低钾血症、代谢性碱中毒。低钾与低镁常同时存在。容量扩张抑制肾小球旁器合成和释放肾素。血浆肾素水平降低、低钾血症使醛固酮分泌减少。ENa+C对阿米洛利(amiloride)敏感。阿米洛利可以特异性阻断ENa+C,使Na+的重吸收减少,过高血容量和血压下降。低钾血症得以纠正。
3.伴高血压、低血钾的继发性醛固酮增多症
(1)分泌肾素的肿瘤:①肾小球旁细胞瘤;②肾外肿瘤Wilms瘤、卵巢肿瘤等。
(2)继发性肾素增高所致继发性醛固酮增多:①恶性高血压;②肾动脉狭窄;③一侧肾萎缩、结缔组织病等。
继发性醛固酮增多症者血浆肾素均升高,易与原醛鉴别。
六、治疗
1.APA及PAH 应行腹腔镜手术摘除单侧肾上腺瘤或增生的肾上腺,治愈率70%~90%。术前准备包括补钾,应用螺内酯控制血压,纠正电解质紊乱和酸碱平衡。术后血钾多在1周内恢复。大多数患者的血压可以恢复正常;如血压仍轻度升高,可加用螺内酯及其他降压药控制;血压改善不理想者,可能与长期高血压致肾损害及动脉硬化有关。术前及后1周,可加用氢化可的松100~200mg/d,1周后逐渐停药。
2.IHA 可选用螺内酯治疗,螺内酯为醛固酮拮抗药,可与肾小管细胞质及核内受体结合。用法:120~240mg/d,服药后血钾多于1~2周、血压4~8周恢复正常。螺内酯在降低原醛患者血压的同时,还能改善由于高醛固酮血症对心肌和血管的毒性,降低心力衰竭和心肌梗死发生率,此作用是独立于降压作用之外;螺内酯治疗有一定的不良反应,主要是由于对孕酮和雄激素受体的部分拮抗作用,临床上可表现为男性乳房发育、阳萎、性欲减退,女性月经紊乱;部分患者难以长期坚持使用。近年来国外应用高选择性的醛固酮受体拮抗药依普利酮(eplerenone)治疗,剂量为25~50mg,每日2次,避免了上述不良反应。其他药物可选用阿米洛利或氨苯蝶啶,钙离子阻滞药、ACEI及ARB等,可用于原醛症患者血压的控制,但无明显拮抗高醛固酮的作用。
3.GRA 生理剂量的糖皮质激素可使GRA患者血压、血钾恢复正常。对于儿童患者,治疗过程中要考虑到糖皮质激素对其生长发育的影响,应选择短效制剂,采用最低有效剂量[如氢化可的松10~12mg/(m2·d)]。也可使用盐皮质激素受体拮抗药治疗GRA,疗效与糖皮质激素相当,并可避免糖皮质激素导致下丘脑-垂体-肾上腺轴的抑制和医源性不良反应。
4.肾上腺醛固酮癌 发现时多已有转移,失去手术时机,可行化疗,用米托坦、氨基导眠能、顺铂等治疗。
七、典型病例
病例1:
患者,女性,43岁。有2年高血压、低血钾病史,ARR>61,盐水输注确诊试验证实为原醛,24h尿醛固酮53μg,患者为双侧肾上腺占位(图16-9),经AVS检查,证实为右侧肾上腺分泌醛固酮明显高于左侧(表16-8),行右侧肾上腺占位切除术,术后检查血浆醛固酮<10ng/dl,血压、血钾恢复正常,未再用降压药物治疗。
该病例提示双侧肾上腺病变的原醛患者,有时两侧功能特性可能并不相同,单纯影像学检查难以判断,此时行AVS检查可进一步明确功能定位,以利于手术治疗,同时避免不必要的手术。

图16-9 患者肾上腺CT显示左侧肾上腺1.2cm,右侧2个1.0cm的低密度结节(箭头所示)
表16-8 患者双侧肾上腺取血结果

病例2:
单侧肾上腺增生原醛患者,经AVS确诊、定位,成功进行手术治疗。患者为43岁男性,有高血压及低血钾病史8年,实验室检查血醛固酮水平升高,肾素受抑制,肾上腺CT大致正常,仅左侧可疑增生,为排除IHA,行AVS检查,证实左侧肾上腺分泌醛固酮(醛固酮/皮质醇比值为11.3)明显高于右侧(醛固酮/皮质醇比值为0.7),行左侧肾上腺切除,病理为肾上腺增生,术后血浆醛固酮水平由17.3ng/dl降至4.6ng/dl,24h尿醛固酮由10.3μg/24h降至0.9μg/24h,肾素活性恢复正常,患者血压、血钾恢复正常。
该患者为单侧肾上腺增生,一般肾上腺增生原醛患者多采用药物治疗,单侧增生少见,该患者单从影像学检查看并无手术指征,但AVS检查证实一侧肾上腺分泌醛固酮功能明显增高,经手术治疗取得良好效果。
(巴建明)
参考文献
[1]Milliez P,Girerd X,Plouin PF,et al.Evidence for an increased rate of cardiovascular events in patients with primary aldosteronism.J Am Coll Cardiol,2005,45(8):1243-1248.
[2]Nishimura M,Uzu T,Fujii T,et al.Cardiovascular complications in patients with primary aldosteronism.Am J Kidney Dis,1999,33(2):261-266.
[3]吕朝晖,郑蕾,田慧,等.原发性醛固酮增多症高血压特点的临床研究.解放军医学杂志,2003,28(5):419-421.
[4]吴景程,汤正义,张炜,等.原发性醛固酮增多症患者心血管和肾功能指标的改变.上海交通大学学报(医学版),2006,26:48-50.
[5]Funder JW,Carey RM,Fardella C,et al.Case detection,diagnosis,and treatment of patients with primary aldosteronism:an endocrine society clinical practice guideline.Clin Endocrinol M etab,2008,93(9):3266-3281.
[6]Schwartz GL,Turner ST.Screening for primary aldosteronism in essential hypertension:diagnostic accuracy of the ratio of plasma aldosterone concentration to plasma renin activity.Clin Chem,2005,51:386-394.
[7]Gordon RD,Stowasser M,Tunny TJ,et al.High incidence of primary aldosteronism in 199 patients referred with hypertension.Clin Exp Pharmacol Physiol,1994,21:315-318.
[8]Loh KC,Koay ES,Khaw MC,et al.Prevalence of primary aldosteronism among Asian hypertensive patients in Singapore.J Clin Endocrinol Metab,2000,85:2854-2859.
[9]Fardella CE,Mosso L,Gomez-Sanchez C,et al.Primary hyperaldosteronism in essential hypertensives:prevalence,biochemical profile,and molecular biology.J Clin Endocrinol Metab,2000,85:1863-1867.
[10]William F.Young Jr.Primary aldosteronism,In Kronenberg ed:Williams Textbook of Endocrinology,11th ed.Saunders,2008.
[11]Phillips JL,Wahher MM,Pezzullo JC,et al.Predictive value of pre.operative tests in discriminating bilateral adrenal hyperplasia from an aldosterone-producing adrenal adenoma.J Clin Endocrinol Metab,2000,85(12):4526-4533.
[12]Mc Mahon GT,Dluhy RG.Glucocorticoid-remediable aldosteronism.Cardiol Rev,2004,12:44-48.
[13]Young Jr WF,Klee GG:Primary aldosteronism.Diagnostic evaluation.Endocrinol Metab Clin North Am,1988,17:367-395.
[14]Blumenfeld JD,Sealey JE,Schlussel Y,et al.Diagnosis and treatment of primary hyperaldosteronism.Ann Intern Med,1994,121:877-885.
[15]Ma JT,Wang C,Lam KS,et al.Fifty cases of primary hyperaldosteronism in Hong Kong Chinese with a high frequency of periodic paralysis.Evaluation of techniques for tumour localisation.Q J Med,1986,61:1021-1037.
[16]Holland OB,Brown H,Kuhnert L,et al.Further evaluation of saline infusion for the diagnosis of primary aldosteronism.Hypertension,1984,6:717-723.
[17]Schirpenbach C.Seiler L,Maser-Gluth C,et al.Confirmatory testing in normalkalaemic primary aldosteronism:the value of the saline infusion test and urinary aldosterone metabolites.Euro J Endocrinol,2006,154:865-873.
[18]Young Jr WF,Klee GG:Primary aldosteronism.Diagnostic evaluation.Endocrinol Metab Clin North Am,1988,17:367-395.
[19]Young Jr WF,Hogan MJ,Klee GG,et al.Primary aldoster-onism:diagnosis and treatment.Mayo Clinic Proc,1990,65:96-110.
[20]Bravo EL,Tarazi RC,Dustan HP,et al.The changing clinical spectrum of primary aldosteronism.Am J Med,1983,74:641-665.
[21]Lim PO,Farquharson CA,Shiels P,et al.Adverse cardiac effects of salt with fludrocortisone in hypertension.Hypertension,2001,37:856-861.
[22]Stowasser M,Gordon RD.Primary aldosteronism—careful investigation is essential and rewarding.Mol Cell Endocrinol,2004,217:33-39.
[23]Gordon RD,Stowasser M,Rutherford JC:Primary aldosteronism:are we diagnosing and operating on too few patients?.World J Surg,2001,25:941-947.
[24]Young WF,Stanson AW,Thompson GB,et al.Role for adrenal venous sampling in primary aldosteronism.Surgery,2004,136:1227-1235.
[25]Doppman JL,Gill Jr JR:Hyperaldosteronism:sampling the adrenal veins.Radiology,1996,198:309-312.
[26]张炜,汤正义,王卫庆,等.肾上腺静脉采血在原发性醛固酮增多症分型诊断中的应用.中华内分泌代谢杂志,2006,22(5):411-413.
[27]Daunt N:Adrenal vein sampling:how to make it quick,easy,and successful.Radiographics,2005,25(suppl 1):S143-S158.
[28]Assalia A,Gagner M:Laparoscopic adrenalectomy.Br J Surg,2004,91:1259-1274.
[29]Rossi H,Kim A,Prinz RA.Primary hyperaldosteronism in the era of laparoscopic adrenalectomy.Am Surg,2002,68:253-256.discussion 256-257.
[30]Gonzalez R,Smith CD,McClusky 3rd DA,et al.Laparoscopic approach reduces likelihood of perioperative complications in patients undergoing adrenalectomy.Am Surg,2004,70:668-674.
[31]Sica DA:Pharmacokinetics and pharmacodynamics of mineralocorticoid blocking agents and their effects on potassium homeostasis.Heart Fail Rev,2005,10:23-29.
[32]Stowasser M,Sharman J,Leano R,et al.Evidence for abnormal left ventricular structure and function in normotensive individuals with familial hyperaldosteronism type I.J Clin Endocrinol Metab,2005,90:5070-5076.
[33]Katayama Y,Takata N.Tamura T,et al.A case of primary aldosteronism due to unilateral adrenal hyperplasia.Hypertens Res,2005,28:379-384.
第三节 嗜铬细胞瘤
嗜铬细胞瘤是来源于肾上腺髓质和肾上腺外嗜铬组织的肿瘤,是内分泌性高血压的重要原因。嗜铬细胞瘤在高血压人群中的患病率约为1.9%。由于嗜铬细胞瘤患者的临床表现错综复杂,多数患者表现为难治性高血压,并可以导致心、脑、肾血管系统的严重并发症,而造成巨大的社会经济负担。因此,早期发现及正确诊断、治疗嗜铬细胞瘤患者具有重要的意义。
一、病因、病理和发病机制
嗜铬细胞瘤作为一种神经内分泌肿瘤,其发病机制还知之甚少。它和家族性副神经节瘤都起源于胚胎神经嵴,为自主神经系统肿瘤,目前已经发现嗜铬细胞瘤患者存在多种遗传基因的异常。
85%~95%的嗜铬细胞瘤定位于肾上腺髓质。异位的嗜铬细胞瘤主要分布在腹膜后腹主动脉前、左右腰椎旁间隙、肠系膜下动脉开口处主动脉旁的嗜铬体。肿瘤的大小不一,直径由1~2cm至20~25cm,肿瘤的重量变异较大,可从2g至3kg,一般多为20~100g。形状多为圆形或者椭圆形。肿瘤较大时瘤体内常有局灶性或者大片状出血、坏死、囊性变和(或)钙化。电子显微镜下可见肿瘤细胞内富含肾上腺素和去甲肾上腺素的分泌颗粒。恶性者细胞排列不规则,有细胞分裂象,包膜,肾上腺静脉中有瘤细胞浸润,有时有瘤栓,附近脏器组织也可有瘤细胞浸润。
这种起源于肾上腺髓质、交感神经节、旁交感神经节或其他部位的嗜铬组织的肿瘤。由于瘤组织可以阵发性或持续性地分泌多量去甲肾上腺素和肾上腺素,以及微量多巴胺,儿茶酚胺通过肾上腺素能受体对心血管系、平滑肌、神经内分泌系起广泛的生理作用,从而引起高儿茶酚胺血症的症候群。
二、临床表现
1.高血压症候群 肾上腺素作用于心肌,心排血量增加,收缩压升高;去甲肾上腺素作用于周围血管引起其收缩,促使收缩压和舒张压均升高,此为本病的主要症候群。临床上根据血压发作方式,可分为阵发性和持续性两型。阵发性高血压的诱因包括精神刺激、弯腰、排尿、排便、触摸和肿瘤手术检查等血压骤然升高,收缩压最高可达到300mm Hg,舒张压可相应升高达180mm Hg。持续时间一般为数分钟,大多少于15min,但是长者可达16~24h。患者如果不及时诊治,随着病情的发展,发作会越来越频繁,晚期动脉发生器质性病变,血压呈现持续性升高,但是仍可阵发性加剧。
嗜铬细胞瘤又有其特殊的临床症状,如高血压及同时有头痛、心悸、多汗三联症,此时嗜铬细胞瘤的诊断敏感性为89%~91%,但特异性却为67%~94%。头痛剧烈,呈炸裂样,心悸常伴胸闷、憋气、胸部压榨感,发作时常常大汗淋漓、面色苍白、四肢发凉等。
2.代谢紊乱 儿茶酚胺升高可以使机体的代谢率升高,发作时体温升高、多汗、体重减轻主要是由于脂肪分解增加所导致。血糖升高,糖原分解增加,胰岛素作用拮抗等,患者表现为糖尿病病或者糖耐量低减。
3.其他特殊临床表现
(1)低血压及休克:少数患者表现为发作性低血压甚至休克。原因包括:①肿瘤组织坏死出血,导致儿茶酚胺释放减少。②大量儿茶酚胺引起心肌炎症,心肌坏死,诱发心律失常,心力衰竭或心肌梗死,诱发心源性休克。③肿瘤分泌大量肾上腺素,引起周围血管扩张。④部分肿瘤分泌多量多巴胺,抵消了去甲肾上腺素的升压作用。⑤大量儿茶酚胺引起血管强烈收缩,微血管壁缺血缺氧,通透性增高,血浆渗出,有效血容量减少。
(2)腹部肿块:绝大多数情况下,肿瘤很难通过腹部触诊扪及。但是嗜铬细胞瘤体积很大时,可以在腹部触诊时扪及,但是有可能会诱发高血压发作。
(3)消化道症状:儿茶酚胺可以引起肠蠕动及张力减弱,可以引起便秘、腹胀、腹痛等。
(4)泌尿系症状:膀胱内肿瘤是异位嗜铬细胞瘤中发生率较高的一种。患者在憋尿、排尿或者排尿后刺激瘤体释放儿茶酚胺可以引起高血压发作(病例1)。
4.特殊类型嗜铬细胞瘤 特殊类型嗜铬细胞瘤症状不典型,表现复杂,涉及普外、儿科、妇科等相关科室,容易延误诊治,致残率和致死率较高。
(1)静止性嗜铬细胞瘤:静止型嗜铬细胞瘤是指平时未表现出高血压等征象,但在严重外伤、感染、手术等应激条件下血压可急骤上升的嗜铬细胞瘤。静止型嗜铬细胞瘤不产生临床症状,可能是:①瘤体不具有分泌功能或分泌功能低下。②大部分去甲肾上腺素分泌后储存在肿瘤内部,很少进入血液循环中。③肿瘤分泌较多的多巴及多巴胺抢占了受体,由于多巴具有降压作用,对抗了肾上腺素和去甲肾上腺素的作用而不发生高血压。④大的肿瘤虽然含有大量的儿茶酚胺类物质,但大多在肿瘤的内部代谢对于怀疑静止型嗜铬细胞瘤的患者,胰高血糖素刺激试验可以发现一些隐匿功能的嗜铬细胞瘤(病例2)。
(2)复发性嗜铬细胞瘤:嗜铬细胞瘤的复发率为4.6%~10%。肾上腺外、儿童、多发嗜铬细胞瘤复发率较高。复发性嗜铬细胞瘤容易恶变。复发性嗜铬细胞瘤根据病史、内分泌和影像学检查不难作出诊断(病例3)。
(3)多发性嗜铬细胞瘤:多发性嗜铬细胞瘤占嗜铬细胞瘤的10%左右。多发有两种形式:①肾上腺多发嗜铬细胞瘤,可以表现为双侧肾上腺肿瘤和一侧肾上腺多个肿瘤。②肾上腺外多发嗜铬细胞瘤,肿瘤都位于肾上腺外的嗜铬体中。儿童和肾上腺外嗜铬细胞瘤多发常见。术中切除肿瘤之后,血压下降不明显的情况下,应考虑到多发性嗜铬细胞瘤的可能,应该进行探查。
三、实验室和其他检查
1.基础生化检查 包括24h尿儿茶酚胺及其代谢产物。从诊断的敏感性和特异性角度来讲,最为可靠的是测定血和尿中的儿茶酚胺。
(1)24h尿儿茶酚胺测定:血浆中的儿茶酚胺2%~5%经尿排出,其中80%为去甲肾上腺素,20%为肾上腺素。有时症状发作时间短,尿CA排出量短暂性升高,如果仍留24h尿则会被稀释,可以留取发作后4h的尿测定CA,并与其他不发作的时候的同时间段的尿CA进行比较。如果明显升高可做出确诊。
(2)24h尿3-甲氧基-4-羟基苦杏仁酸(VMA):VMA为去甲肾上腺素和肾上腺素的最终代谢产物,能够反映体内儿茶酚胺的生成情况。发作后4h和24h的尿标本测定阳性率更高。
(3)血浆CA的测定:血浆儿茶酚胺包括肾上腺素、去甲肾上腺素和儿茶酚胺的总称。必须在清晨空腹状态安静状态下测定。在测定儿茶酚胺时候,尽量停用降压药物,避免饮茶、咖啡、可乐、水果等含有色素的物质,以免干扰化验结果。
2.激发试验 激发试验常用于血压正常或者较低而高度怀疑嗜铬细胞瘤的患者。如果血压超过170/110mm Hg则不宜采用。实验前先做冷水加压试验作对照。目前主要采用胰高血糖素试验:胰高血糖素可以刺激瘤体分泌儿茶酚胺。一次注射剂量为0.5~1mg,采血测定刺激后0min和3min的儿茶酚胺。注射后血浆儿茶酚胺浓度为注射前的3倍以上,或者注射后浓度高于2 000pg/ml可确诊。试验前应当准备酚妥拉明,血压升高过高的时候,需要静脉输注以控制血压。
3.抑制试验 适用于血压持续升高,阵发性高血压的发作期。血压高于170/110mm Hg的时候可以应用。目前主要采用酚妥拉明试验:酚妥拉明是一种短效的α肾上腺素能受体阻滞药,可以阻断CA在组织中的作用,因此可以鉴别高血压是会否因儿茶酚胺分泌过多所致。方法是酚妥拉明5mg缓慢静脉注射,然后观察血压的变化,如果注射2min后血压迅速下降、幅度超过35/25mm Hg并且持续3~5min,可判断为阳性。如果血压下降幅度过大,出现低血压休克时,应当迅速输液,尽快增加血容量,必要时应用去甲肾上腺素或者肾上腺素静脉滴注治疗。
激发试验和抑制试验都具有一定的风险,尤其是对于病史较长且已经出现动脉硬化等表现者,应当慎重进行。
四、诊断和鉴别诊断
1.诊断 嗜铬细胞瘤常规诊断程序是以临床表现及体征为主导,先进行生化检查定性,然后进行影像学检查进行定位诊断。
(1)定性诊断:嗜铬细胞瘤有良性与恶性,其数有单发与多发,其部位有单侧与双侧、肾上腺内与肾上腺外,其血压类型有阵发性、持续性;其病史有家族性、非家族性;有合并内分泌腺瘤病(MEN)或非MEN等。因此,在临床上诊断嗜铬细胞瘤较困难。但嗜铬细胞瘤又有特殊的临床症状,如高血压及同时有头痛、心悸、多汗三联症。如果患者有高血压、同时有直立性低血压和头痛、心悸、多汗三联症,特异性则可高达95%。在发生上述症状的同时测定血、尿儿茶酚胺及尿VMA等,如有明显升高可以确诊。对于高血压发作时可以进行酚妥拉明试验等抑制试验,对于血压不高者,可以进行激发试验来明确诊断。一般来讲,通过上述检查,可以做出定性诊断。
(2)定位诊断
①常规定位检查方法:传统的定位方法主要有超声、CT、MRI等。超声简易无创,对肾上腺内嗜铬细胞瘤的筛查有很大实用价值,但准确性不高。CT和MRI虽然提供了良好的形态学影像,且在嗜铬细胞瘤的定位诊断中具有较高的敏感性,但两者的特异性均不佳。
②核素扫描:核素成像方法的优点是能执行全身影像扫描,具有较高的敏感性和特异性,有助于发现CT和(或)MRI未发现的微小病灶或者异位病灶。
a.131 I-间碘苄胍扫描(MIBG):MIBG是一种肾上腺素能神经阻滞药,因为其结构与去甲肾上腺素类似,因此被瘤子组织的小囊泡摄取并储存。用放射性碘标记后,静脉注射,可以使嗜铬细胞瘤显像,尤其适用于肾上腺外、多发和恶性转移的定位。检查前1周应当停用影响有关的药物,并服用碘溶液阻断甲状腺对碘的摄取。
b.正电子断层显像(PET):PET为正电子发射型电子计算机断层摄影。最常用的PET放射性示踪剂是18F-FDG。研究显示,采用F-FDG-PET扫描法的特异性和敏感性较高,适用于MIBG结果阴性者,可以作为探查的二线方法之一。
c.生长抑素(SMS)受体(SSR)显像:内分泌肿瘤细胞的表面,都有生长抑素受体的高表达。奥曲肽是人工合成的SMS类似物,它保留了对SSR高亲和力结合活性部分,而体内半衰期明显延长,因此核素标记后,广泛应用于SSR显像中,常规使用111 In-奥曲肽进行受体显像。有助于嗜铬细胞瘤显像。
2.鉴别诊断
(1)甲状腺功能亢进症:甲状腺功能亢进症的患者有明显的高代谢症候群,并且也可以合并高血压,但是血压的升高幅度不大,并且以收缩压升高为主,舒张压升高不明显。多数甲亢患者还有许多特征性的表现,如突眼、颈粗、多汗、手抖等。嗜铬细胞瘤的患者血压波动性升高,并且幅度较高。检验血甲状腺功能水平可以鉴别。
(2)冠心病:冠心病患者心绞痛发作时,血压可以突然急剧升高,可伴有心悸、心动过速,大汗淋漓等交感神经兴奋症状。心电图可见特征性改变。含服硝酸甘油后数分钟内可以缓解,有助于两者的鉴别。
(3)围绝经期综合征:围绝经期综合征的女性会出现心悸、多汗、发作性潮热、血压波动等类似嗜铬细胞瘤的症状,但是血压波动幅度一般不大,可自行缓解。发作时无剧烈头痛等。仔细询问病史,特别是月经史,血压升高时化验血尿CA等可以进行鉴别。
五、治疗
嗜铬细胞瘤一经诊断即应进行药物治疗,待血压和临床症状控制后手术切除肿瘤。充分术前准备可使手术死亡率低于1%,即使在一些紧急情况如肿瘤破裂或出血坏死引发休克时做出诊断者,也应做充分术前准备择期手术。
1.内科治疗和术前准备 嗜铬细胞瘤手术死亡率高的主要原因是由于在麻醉诱导或挤压肿瘤时发生严重的高血压危象、心力衰竭甚至发生脑出血;在切除肿瘤后,发生难以控制的低血压,甚至休克。因此,近年来,术前采用α受体阻滞药阻断儿茶酚胺的外周血管收缩效应,降低血压,使微循环血管床扩张,血容量减少的病理生理变化得到调整与补充,在肿瘤切除后,血压平稳维持,避免难治性低血压性休克的发生。
(1)α受体阻滞药:酚苄明为非竞争性α受体阻滞药,阻断α1受体作用为α2的作用的100倍。半衰期较长。不良反应为直立性低血压、鼻塞、心悸等。初始剂量10mg,每日1次,渐渐增量至血压降至接近正常。一般要求血压控制在120/80mm Hg左右。哌唑嗪为α1受体选择性阻滞药,半衰期较短。初始剂量1mg,每日1次,渐渐增加到6~8mg/d。不良反应主要有直立性低血压、心动过速和鼻塞等。
(2)β受体阻滞药:美托洛尔在α受体阻滞药用后出现心悸、心动过速的时应用。与α受体阻滞药的应用顺序不能颠倒,否则易诱发严重肺水肿。术前心率应当控制在80/min左右。
2.手术 早期手术切除肿瘤是临床根治的唯一途径,常规手术方式是开腹手术,术中及时调节酚妥拉明静脉滴注速度,以便调整血压和血容量。在剥离肿瘤时候可以静脉推注酚妥拉明1~5mg后缓慢静脉滴注,维持血压稳定。切除肿瘤后血压可能会出现急速下降,应当停用酚妥拉明静脉滴注,改为生理盐水,5%葡萄糖或代血浆等迅速输注,迅速补充血容量,升高血压。必要的时候,静脉滴注去甲肾上腺素4~8mg入液500ml静脉滴注,术后病情稳定后逐渐停用。
近年来腹腔镜下肾上腺切除术得到了广泛应用。嗜铬细胞瘤局部无浸润或转移表现时,虽有恶性可能,腹腔镜手术仍是适应证。已有不少报道对肾上腺外和复发性嗜铬细胞瘤成功施行了腹腔镜下切除术。术中若发现局部浸润或转移灶,应改行开放性手术。腹腔镜手术优点是创伤小,出血量较少,术中血压波动幅度小。
3.恶性嗜铬细胞瘤治疗 恶性嗜铬细胞瘤转移快,术后复发率高,5年生存率低于40%。对于局部复发性嗜铬细胞瘤,仍可手术切除包括切除淋巴结转移灶。如果不能完整的切除病灶,一般采用α和β受体阻滞药治疗。大剂量131 I-M IBG治疗恶性嗜铬细胞瘤是近几年发展起来的治疗方法,它可被嗜铬细胞选择性吸收,储存在癌细胞儿茶酚胺颗粒中,发出β射线作用于肿瘤细胞而达到治疗作用。抗肿瘤药物联合化疗:临床上常用CVD方案(环磷酰胺+达卡巴嗪+长春新碱),可使已转移的恶性嗜铬细胞瘤转移灶体积缩小。
六、高血压危象的处理
嗜铬细胞瘤患者术前发生高血压危象的诱因有情绪紧张、肿瘤区域受到不良刺激,如碰撞、挤压、体位不当、药物剂量不足,以及不恰当的护理操作,避免不良的机械刺激。高血压危象处理:①吸氧;②缓慢静脉注射酚妥拉明1~5mg,同时密切观察血压,心率等,然后继续给予酚妥拉明缓慢静脉滴注维持;③及时处理其他心脑并发症。
七、典型病例
病例1:
患者,男性,38岁。主因“排尿时发作性头痛、心悸、出汗、面色苍白伴血压升高5个月”入院。查体:发作间期血压100/75mm Hg。心肺腹部未见异常。发作间期实验室检查:CA 214.5nmol/24h(<266nmol/24h),VMA 32.0nmol/24h(<76.3nmol/24h)。膀胱MRI显示膀胱下后方见1.5cm大小肿物(图16-10)。于左侧输尿管口可见一大小1.5cm×2cm球状肿瘤。肿物表面无出血、坏死,表面较光滑。采用2μg激光技术将肿瘤完整切除。病理结果:异位嗜铬细胞瘤。

图16-10 左侧输尿管口可见一大小1.5cm×2cm的球状肿物(箭头所示)
分析:该病例表现为经典的发作性高血压伴4“P”症状,实验室检查显示24h尿CA、VMA显著升高,定性诊断嗜铬细胞瘤明确。比较少见的是患者上述症状的发作在排尿时发作,临床医师据此应当首先考虑膀胱嗜铬细胞瘤的诊断。随后的影像学检查和手术病理证实是该诊断。患者在排尿时由于膀胱内压增高,压迫使嗜铬细胞瘤导致上述症状发作。临床上还常见另外一种膀胱嗜铬细胞瘤,即患者并没有明显的发作性高血压,而是表现为无痛性血尿。这类患者常常在进行膀胱镜检查或者取活检的时候诱发高血压发作,如果患者存在基础的心脑血管疾病,则容易诱发心血管意外。因此,临床医生在进行无痛性血尿、膀胱壁肿瘤鉴别诊断时,应当注意考虑膀胱嗜铬细胞瘤的可能。
病例2:
患者,女性,65岁。主因“确诊右肺腺癌,肝脏、全身骨转移9个月,发现右肾肾上腺占位2d”入院。查体:血压110/70mm Hg,心肺未见异常。下肢无水肿。实验室检查:CA 206.8nmol/24h(<266nmol/24h),VMA 22.3nmol/24h(<76.3nmol/24h)。CT:右肾上腺区3.7cm×3.0cm肿块(图16-11)。
初步诊断右侧肾上腺转移癌,拟行超声引导下介入治疗。肾上腺占位穿刺后,血压立即升高至205/107mm Hg,心率108/min,频发室性期前收缩,遂停止治疗,给予乌拉地尔10mg静脉推注+艾司洛尔40mg静脉推注,约2min后完全缓解。考虑到患者右肾上腺区占位对刺激反应敏感,诊断嗜铬细胞瘤,停止微波消融治疗。
分析:本例是一个非常少见的病例。根据常规临床经验,肺癌容易出现肾上腺转移,表现为单侧或双侧。当肺癌患者出现肾上腺占位时应当首先考虑肾上腺转移。事实上,复习患者近年来的腹部CT,发现患者右侧肾上腺的占位性病变在近2年中大小并没有发生明显的变化,这一点不支持肾上腺转移癌。该患者在进行穿刺介入治疗前,如果临床医师能够拓展临床思维,考虑是否存在肾上腺无功能瘤或寂静型嗜铬细胞瘤并提前做好预案,则可以避免出现血压的急剧升高及可能出现的心血管意外。

图16-11 肾上腺CT平扫
右肾上腺区可见3.7cm×3.0cm肿块(箭头所示)
病例3:
患者,男性,39岁。主因“膀胱嗜铬细胞瘤术后9年,伴随阵发性心悸、大汗、头晕1年余”入院。查体:血压180/100mm Hg,心、肺、腹部检查未见异常,双下肢无水肿。实验室检查:CA 4483 nmol/24h(<266nmol/24h),VMA 136nmol/24h(<76.3nmol/24h)。奥曲肽检查:左后胸部、肝右叶外侧及膀胱右上方间多发异常放射性浓聚区,全身其余部位始终未见异常放射性减低或浓聚区,考虑为嗜铬细胞瘤多发转移(图16-12A、B)。
病例分析:该病例初诊时确诊膀胱嗜铬细胞瘤,在术后9年再次出现发作性高血压,此时应当考虑嗜铬细胞瘤复发。随后的24h尿CA、VMA检验证实复发。奥曲肽扫描显示嗜铬细胞瘤出现了原位、肝脏、骨骼多发转移,再次手术后的病理检查证实。嗜铬细胞瘤复发提示病变为恶性。通常对于能够切除的病灶,还是以手术切除为主。如果无法手术切除,目前常用的方法是大剂量131 I-MIBG治疗,该方法实际上是一种内照射治疗。文献报道这种方法对于病变缩小、生活质量改善和预期寿命延长都有很多优点。

图16-12A 胸部CT显示右侧第7肋骨局限性溶骨性破坏(箭头所示)
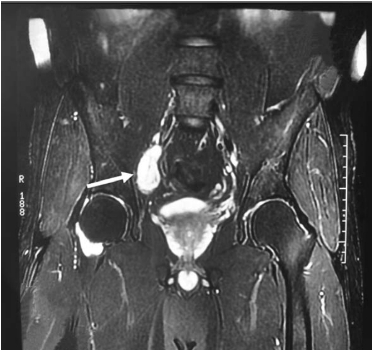
图16-12B 骨盆膀胱MRI显示右侧髂窝内见一1.2cm×4.7cm富血供结节块影,可明显强化。患者转泌尿外科行手术治疗,术后病理为嗜铬细胞瘤(箭头所示)
(王先令)
参考文献
[1]程时武,陆菊明.嗜铬细胞瘤的诊疗进展.临床内科杂志,2006,23:160-163.
[2]Nieman LK.Approach to the patient with an adrenal incidentaloma.J Clin Endocrinol Metab,2010,95:3.4106-4113.
[3]Waguespack SG,Rich T,Grubbs E,et al.A current review of the etiology,diagnosis,and treatment of pediatric pheochromocytoma and paraganglioma.J Clin Endocrinol Metab,2010,95:2023-2037.
[4]王养民,赵志强,王楠,等.异位嗜铬细胞瘤的诊断和治疗.现代泌尿外科杂志,2010,15:96-98.
[5]Ilias I,Pacak K.Diagnosis,localization and treatment of pheochromocytoma in MEN 2 syndrome.Endocr Regul,2009,43:89-93.
[6]席文琪,杨国庆,母义明,等.149例嗜铬细胞瘤回顾性分析.内蒙古医学杂志,2007,39:676-679.
[7]宁光.重视嗜铬细胞瘤临床规范,提高诊治和研究水平.上海医学,2009,32:89.
[8]王卫庆.嗜铬细胞瘤的临床诊治规范进展.上海医学,2009,32:90-91.
[9]张迎强,陈黎波,李方,等.131 I-MIBG显像诊断嗜铬细胞瘤.中国医学影像技术,2009,25:1283-1285.
[10]Grünwald F,Ezziddin S.131I-metaiodobenzylguanidine therapy of neuroblastoma and other neuroendocrine tumors.Semin Nucl Med.2010,40:153-163.
[11]Joynt KE,Moslehi JJ,Baughman KL.Paragangliomas:etiology,presentation,and management.Cardiol Rev,2009,17:159-164.
[12]Havekes B,King K,Lai EW,et al.New imaging approaches to phaeochromocytomas and paragangliomas.Clin Endocrinol(Oxf).2010,72:137-145.
[13]赵艳荣,郭清华,陆菊明,等.肾上腺外的异位嗜铬细胞瘤-颈静脉球瘤1例.中国实用内科杂志,2005,25:630.
[14]苏颋为,祝宇,孙福康,等.甲磺酸多沙唑嗪控释片与酚苄明在嗜铬细胞瘤手术前准备及围术期血压控制效果.上海医学,2009,32:105-107.
[15]袁文祺,王卫庆,宁光.恶性嗜铬细胞瘤的非手术治疗进展.国际内分泌代谢杂志,2008,28:270-272.
[16]宋刚,周利群,蔡林,等.腹腔镜切除5-10cm肾上腺嗜铬细胞瘤的安全性分析.中华外科杂志,2008,46:1245-1248.
[17]彭杰,张辉,强万明,等.异位嗜铬细胞瘤26例诊治分析.中华外科杂志,2007,45:1582-1583.
[18]Brown MJ,Grossman AB,Bornstein SR.Pheochromocytoma.Horm Metab Res,2009,41:655-657.
[19]Coleman RE,Stubbs JB,Barrett JA,et al.Radiation dosimetry,pharmacokinetics,and safety of ultratrace Iobenguane I-131 in patients with malignant pheochromocytoma/paraganglioma or metastatic carcinoid.Cancer Biother Radiopharm,2009,24:469-475.
[20]龙清云,周云峰,刘骏方,等.恶性嗜铬细胞瘤术后复发患者的动脉栓塞化疗.中华泌尿外科杂志,2009,30:400.
[21]Golden SH,Robinson KA,Saldanha I,et al.Clinical review:Prevalence and incidence of endocrine and metabolic disorders in the United States:a comprehensive review.J Clin Endocrinol Metab,2009,94:1853-1878.
第四节 原发性肾上腺皮质功能减退症
与继发于垂体促肾上皮质激素分泌不足或外源性糖皮质激素应用(医源性库欣综合征)引起的肾上腺皮质功能减退症不同,原发性肾上腺皮质功能减退症是指肾上腺皮质本身病变引起的功能低下,主要是糖皮质激素分泌不足,可伴有不同程度的盐皮质激素和性激素缺乏。该病由英国内科医生Thomas Addison(1793-1860年)于1855年首先描述,故常称之为艾迪生病(Addison’s disease)。
艾迪生病发病率不高,欧美报道为4~6人/10万,我国几家大医院资料显示该病占同期内科住院病人的0.07‰(湖北)、1.33‰(上海)和2‰(天津),我院近5年共收治6例,约占同期内科住院病人的0.17‰,占肾上腺疾病住院病人的2.3%。该病可发生于任何年龄,但多为20~50岁成年人,女性患者较男性为多,男∶女=1∶2~3。根据致病原因,可分为自身免疫性,炎症性,变性疾病,皮质激素合成酶缺乏,肿瘤、出血或外伤破坏五大类,根据病情进展情况可分为慢性肾上腺皮质功能减退,急性肾上腺皮质功能减退,先天性糖皮质激素合成障碍和肾上腺切除四大类。
一、慢性肾上腺皮质功能减退
1.病因病理
(1)特发性肾上腺皮质功能减退:是艾迪生病中最常见的一类,占70%~80%,为肾上腺皮质的自身免疫性病变。主要损及皮质束状带细胞,可不同程度累及球状带、网状带细胞。病理特点为肾上腺皮质细胞退行性变,皮质纤维化,并有淋巴细胞浸润,致肾上腺皮质萎缩、变薄,包膜增厚。肾上腺髓质不被累及。约60%的患者血清中可查见肾上腺皮质细胞抗体,主要是抗肾上腺P450酶抗原的自身抗体,包括21-羟化酶抗体(21OHA)、17α-羟化酶抗体(17OH-A)及侧链裂解酶抗体(SCC-A)。约45%的患者合并有其他内分泌腺体或组织脏器的自身免疫性疾病。常见的有:①甲状腺自身免疫性疾病,主要是桥本甲状腺炎,可有不同的临床甲状腺功能改变,包括甲状腺功能减退(约占9%),亚临床甲状腺功能减退(单纯TSH升高),甲状腺功能正常,甲状腺功能亢进(约占7%),少数为突眼性毒性弥漫性甲状腺肿。发生的频率报道不一,受检测频率或其他因素影响,如约80%的特发性肾上腺皮质功能减退者的甲状腺有淋巴细胞浸润,约45%的患者血中可查见有抗甲状腺抗体,但仅约16%的患者诊断伴有甲状腺疾病。②性腺衰竭,男性患者合并性功能减退者较常见,约占女性特发性肾上腺皮质功能减退的1/4。主要表现为继发闭经(卵巢早衰),少数有原发性闭经者可伴有甲状旁腺功能减退。③胰岛B细胞衰竭,约12%的患者合并有胰岛素依赖型糖尿病(T1DM),这部分患者血清多能查见胰岛细胞抗体。④甲状旁腺功能减退,约6%的患者合并有甲状旁腺功能减退,多见于青、幼年女性患者。⑤非内分泌腺免疫异常性疾病,较多见为恶性贫血(4%)、皮肤白斑(9%)和秃发。少见有报道合并系统性红斑狼疮,类风湿关节炎、皮肌炎、肝炎。本症引起肾上腺皮质萎缩的原因还不十分清楚,据以往研究结果提示,涉及遗传因素及病原菌感染引起自身免疫异常。遗传因素:①该病有家族发病倾向,多为常染色体隐性遗传,个别男性家族发病表现为性连锁遗传。②一些研究提示,与HLA-DR3、HLA-B8分布频率过高有关。病原菌感染主要见于病毒感染诱导形成自身抗原,引起抗原抗体反应,破坏相应的内分泌腺体。
根据受损内分泌腺体及其他脏器异常的不同组合,分为下列综合征。
①Whitaker综合征或Blizzard综合征:艾迪生病合并甲状旁腺功能减低和皮肤念珠菌病。
②Schmidt综合征:艾迪生病合并甲状腺自身免疫性疾病。
③Carpenter综合征:艾迪生病合并甲状腺免疫性疾病和T1DM。
(2)炎症性艾迪生病:肾上腺位于腹膜后,肾包膜内,炎症性病原菌多为其他病灶感染经血液或淋巴结播散所致。
①肉芽肿样病变:主要是结核病变,少有报道为结节病累及肾上腺。肾上腺结核多继发于其他部位结核血行播散,病变逐渐发生,可侵及整个肾上腺呈现肉芽肿样干酪性坏死,可伴多灶性钙化,体积明显增大,肾上腺皮质、髓质功能均丧失。肾上腺结核在经济不发达国家为艾迪生病的主要原因,可占70%~80%,随着经济发展,生活及医疗水平提高,则逐渐减少,我国20世纪50年代以前为70%,50年代为59%,60年代为37%,70年代为21%,近20年来临床观察结核性肾上腺皮质功能减退有增长趋势,但缺乏大人群的详细资料。
②真菌、原虫感染:较少见,以真菌感染略多。随着艾滋病的传播,艾滋病人合并肾上腺真菌、原虫感染导致肾上腺衰竭也多有报道,常见于组织胞浆菌病、芽子菌病、球孢子菌病(sporidiosis)、念珠菌病、隐球菌病、卡氏肺囊虫(pneumocystis carinil)感染等,其中以小孢子菌感染(microsporidial infection)和卡氏肺囊虫感染多见。
③病毒感染:较少见,在自体免疫功能受损的艾滋病患者中可见因病毒感染直接造成肾上腺皮髓质多灶性坏死,多见于巨细胞病毒(cytomega-lovirus)和疱疹病毒,可同时伴有真菌、原虫感染(小孢子菌、卡氏肺囊虫等),除肾上腺外,常累及全身多脏器,病变进展较快。
(3)遗传代谢异常性艾迪生病
①淀粉样变性:少见,原发性淀粉样变性(家族性和非家族性两类)或继发性淀粉样变性均可累及肾上腺,引起皮质功能低下。
②Wolman病:罕见,病因不明,为遗传代谢性疾病,常为常染色体隐性遗传,推测可能是一种因酸性脂酶活性完全性缺陷导致多数器官有胆固醇和三酰甘油沉积,引起肾上腺功能不全,可伴有肾上腺退化,均在发生后6个月内死亡。
③Addison-Schilder综合征:艾迪生病合并弥散性脑硬化或痉挛性瘫痪,分为两型:a.肾上腺脑白质病,常见于2~12岁男孩,伴性连锁隐性遗传,多先患有艾迪生病,以后出现脑白质退行性变,多于该病发生后数月或数年死亡。b.肾上腺脊髓神经病,儿童期出现艾迪生病,成年后出现痉挛性瘫痪。
(4)糖皮质激素合成障碍:先天性对ACTH无反应综合征,罕见,从生后不久到幼儿期发病,血浆ACTH增加,皮质醇低,给予外源ACTH后亦不增加,醛固酮、11-脱氧皮质酮的分泌量正常。推测存在肾上腺皮质细胞ACTH受体或受体后缺陷。
(5)物理、化学等因素(少见):放射治疗,肿瘤侵犯可致双侧肾上腺受损,一些对肾上腺皮质功能有抑制作用的药物,如密妥坦(OP′-DDD)、甲吡酮(metyrapone)和氨基导眠能(氨鲁米特)等,后两种药物主要抑制氢化可的松的合成,密妥坦还可使产生氢化可的松的组织受到永久性的损害。
2.临床症状及体征 病程长短不一,受多种因素影响,可长达10余年才被发现。
临床表现受病变损害程度轻重的影响,各有不同,主要源于因糖皮质激素缺乏引起的钠、水丢失及糖类和蛋白质代谢异常。现按照发生比例多少列举如下。
(1)虚弱,疲乏无力,纳差,体重下降(100%)。
(2)皮肤色素沉着(>90%),多见于暴露、摩擦部位、甲床、乳晕、肛周、唇齿龈处皮肤色素沉着为特征性改变(图16-13)。
(3)低血压(90%),多在90/60mm Hg,可合并有直立性低血压,体检心界小而心音弱。
(4)低血糖,儿童多见(>90%),与成年人(血糖<50mg/dl发生低血糖症状)不同,可在血糖50~80mg/dl时发生。进食稍晚即出现头晕、心悸、冷汗等症状,劳累或感染可诱发。严重者出现精神障碍(约70%)、智力减退、冷漠无情、定向力障碍、激动、违拗症、胡言乱语等,重症者可导致昏迷。
(5)胃肠症状,食欲缺乏(80%),厌食、恶心、呕吐(50%),常为危象的前兆,腹泻较少见(10%)。嗜咸食(15%~20%)。
(6)儿童多数青春期发育正常,仅少部分重症者可有青春期发育延迟。女性因肾上腺雄激素不足可有阴毛、腋毛脱落;重症者男性可有阳萎,女性继发性闭经。
3.实验室检查
(1)血常规:可有正色素正细胞性贫血,中性粒细胞减少,嗜酸粒细胞、淋巴细胞增多。
(2)血液生化:低血钠、低血氯、低血钙、低血糖,行口服葡萄糖耐量试验血糖值呈低平曲线。高血钾(少见)提示有醛固酮缺乏。脱水明显时可有BUN升高。
(3)激素水平
①血F↓,UFC↓,17-OH,17-KS和KGS↑。
②血Ald↓,尿-Ald↓,ACTH↑↑(完全性,临床期)。
③Ald Nor,尿-Ald Nor,17-KS Nor,F↓,UFC↓,17-KGS↓,ACTH↑↑(单纯糖皮质激素缺乏,临床期)。
④F、UFC、17-OH、17-KGS均正常,Ald正常ACTH↑(亚临床期)。
(4)抗体测定
①抗肾上腺(球、束、网)状带细胞抗体阳性50%~70%。
②抗甲状腺球蛋白抗体(TG)、抗微粒体抗体(TM)阳性45%。
③抗胃壁细胞抗体阳性30%。
④抗甲状旁腺细胞抗体阳性26%。
⑤抗胰岛细胞抗体阳性8%。
⑥抗内因子抗体阳性7%。
(5)特殊试验:以下试验是在缺乏检测血中ACTH和皮质醇时所用的辅助试验。

图16-13 皮肤黏膜色素沉着
①ACTH兴奋实验(三日法):通过连续3d给予肾上腺皮质最大兴奋剂量的外源性ACTH(25U/d),了解肾上腺皮质的储备功能及对外源性ACTH的反应,以判断肾上腺皮质功能的损伤程度和除外对内源性ACTH的不敏感,区分原发性或继发性肾上腺皮质功能低下。
方法:25U ACTH加入5%葡萄糖液500ml中均匀静脉滴注8h(8:00~16:00),连续3d,试验前一天(对照)及输入ACTH的每天(共4d)留取24h尿测定UFC。
正常值:ACTH静脉滴注后UFC比对照值升高3倍以上,提示肾上腺皮质本身功能正常。
临床意义:艾迪生病患者ACTH输入后,UFC与对照日变化不大,继发性肾上腺皮质功能减退患者输入ACTH后第1天UFC反应低值,第2、3天逐渐增高至正常或接近正常。
②水负荷试验:氢化可的松生理功能之一为提高肾小球的滤过率,如缺乏可使肾水清除功能减低。本试验通过饮一定负荷量的清水,观察给予可的松对肾脏水清除功能的影响,间接了解是否存在肾上腺糖皮质功能低下。
方法:按照每千克体重20ml计算饮水量,空腹饮水,30min内饮完,测定饮水后2h、3h、4h排尿量,如4h<50%第2天与水同时口服氢化可的松50mg,计算排尿量公式如下。

正常值:正常人2h排尿量>50%,4h>80%。
注意:血清钠离子含量<130mmol/L,不宜做此试验。
(6)其他:ECG显示T波低平或倒置,各导联低电压,补充可的松后可恢复。肾上腺结核者腹部X线片或CT可见肾上腺增大伴钙化(图16-14)。
4.诊断步骤
(1)有无肾上腺皮质功能低下:临床症状、体征、血液生化检查、激素水平测定,需除外药物因素。
(2)病因学检查:有无抗体,相关内分泌腺功能;ACTH兴奋试验,明确原发性、继发性或其他原因。
5.肾上腺皮质危象
(1)病因及病理生理:肾上腺皮质危象是指肾上腺皮质功能低下的危急状态。可见于以下几种情况。
①在慢性肾上腺皮质功能低下的基础上,因某些因素诱发可出现更严重肾上腺皮质功能低下的急性状态。常见的诱发因素有感染、创伤、手术、过度劳累等,在上述情况下未能及时增加糖皮质激素用量,尤其是在尚未能得到及时诊断或治疗者。亦可见于已长期服用糖皮质激素替代治疗但又不适当骤然停用者,在治疗条件好的情况下,发生率很低。

图16-14 肾上腺结核(钙化)
②双侧肾上腺的急性损害,可见于产伤(新生儿),体内凝血机制异常(弥散性血管内凝血,过量抗凝药物应用)、肾上腺静脉栓塞、高血压血管硬化等情况时发生的肾上腺大出血(华佛综合征);继发于败血症、菌血症引起的肾上腺感染、脓肿。
③糖皮质激素撤退综合征:a.原较大剂量服用泼尼松治疗非肾上腺疾病,突然停药;b.原有功能性肾上腺皮质腺瘤,腺瘤外肾上腺组织萎缩,切除腺瘤后;c.高ACTH血症(垂体来源)和异位ACTH分泌的肿瘤,经手术切除垂体腺瘤和异位分泌ACTH肿瘤后,垂体、肾上腺皮质轴功能不能很快转入正常调节;d.有上述病史已经处于恢复状态1年内者,遇感染、外伤等情况,由于肾上腺皮质储备功能尚未完全恢复,也可诱发肾上腺皮质现象。
④肾上腺皮质危象的主要病理生理改变是因缺乏糖皮质激素导致的尿中钠、氯离子大量丢失,水分随之丢失,引起低血容量性休克,临床表现为升压药难以纠正的低血压(但对Cortisol反应好)。危象发生之前原有乏力症状加重,可出现重度厌食、恶心、体重下降,呕吐及腹泻严重者病情发展更快。初期可有高热,危重时体温可下降,皮肤出现脱水征象,常可伴有低血糖。严重者低血压休克,低血糖可引起意识障碍,嗜睡、谵妄、木僵甚至昏迷及抽搐。实验室检查可见重症低血钠、低血氯、低血糖、低血钾等。
(2)诊断要点
①有或无肾上腺皮质功能低下的病史。
②有或无皮肤色素沉着。
③有或无高血钾。
④有或无ACTH异常升高。
⑤支持点有感染、创伤、停用药物等诱因。
⑥有明显恶心、呕吐、低血压症状和体征。
⑦有低血钠、低血氯及脱水(循环血容量不足)的实验室指标。
⑧有血、尿皮质醇低值(给予糖皮质激素治疗效果好)。
(3)治疗:肾上腺皮质激素替代治疗。
①常规治疗:单纯糖皮质激素缺乏,选择下列1种药物,需终身服用。
醋酸可的松25~37.5mg/d(每片25mg)
氢化可的松20~30mg/d(每片20mg)
泼尼松5~7.5mg/d(每片5mg)
泼尼松龙5~7.5mg/d(每片5mg)
服法:1片量,每早顿服,>1片量,分早、下午2次服。
合并高血钾,有醛固酮分泌不足,可加用9α-氟氢可的松,0.05~0.2mg/d。
合并性激素(网状带)分泌不足,女性加用少量雌激素,男性酌情补充睾酮制剂。
②应激情况治疗:正常人体在应激情况下糖皮质激素分泌增加2~3倍,艾迪生病患者处于应激状态异常时,增加糖皮质激素用量,主要是短效或静脉给药,在原有替代治疗的基础上加用氢化可的松200~400mg/d或地塞米松10mg/d,可分2次给予。轻症者(一般感染等)可增加口服糖皮质激素到原每日用量的2~3倍,应激情况解除后及时撤回至原用量。注意引起应激的原因治疗。
③危象时用药:补充足量糖皮质激素,尽早缓解危重状况。
首剂:氢化可的松100~200mg加入葡萄糖盐水中静脉滴注。
第一天:氢化可的松50~100mg静脉滴注,每6小时1次;或醋酸可的松50~100mg肌内注射,每6小时1次,最大用量:氢化可的松400mg/d,地塞米松80mg/d,醋酸可的松400mg/d。
维持此治疗24~48h,病情平稳后减半量,维持4~5d,改为原维持量,必要时加用9α-氟氢可的松。
④肾上腺移植:同种异体移植,取胎儿肾上腺(包括供养血管),带血管移植于股内侧,成功率及可行性均较低。
⑤病因治疗:合并活动性结核者抗结核治疗;检出高抗肾上腺抗体血症者(早期)可采用免疫抑制药治疗。
⑥注意点:
a.治疗量要因人而异,体积大者量可增加(有剂量/体重关系,氢化可的松0.35mg/kg)。
b.合并糖尿病、溃疡病、肥胖者用量可减少1/4~1/3。
c.用药后出现高血压者要停用糖皮质激素。
d.儿童用量计算按氢化可的松10~15mg/(m2·d),不会妨碍人体的生长发育,切勿过量。
e.个别患者有形成ACTH腺瘤倾向,可在晚上增加地塞米松0.25mg。
f.合并用药注意相互影响。
g.合并甲状腺功能减低者,先补充糖皮质激素后再补充甲状腺激素。
h.同时抗结核治疗,服用利福平者增加氢化可的松的量约1/3。利福平为肝微粒体酶类的强诱导剂,促进氢化可的松在肝内的氧化代谢、排出,重者可诱发肾上腺危象。
i.做好患者的教育及随访。
(4)预后:慢性肾上腺皮质功能减退的病理改变是不可逆转的;需终身服用糖皮质激素替代治疗。如能得到正确的治疗,可以正常生活,不影响寿命。如不能得到及早诊断和正确治疗,可在未确诊前发生肾上腺危象而威胁生命。
6.急性肾上腺皮质功能低下(waterhousefriderichsen syndrome,华佛综合征) 本病是指因肾上腺急性广泛性出血引起的急性肾上腺皮质功能低下,亦称急性肾上腺皮质危象(acute adrenal crisis)和肾上腺卒中(suprarenal apoplexy)。因由Waterhouse(1911年)与Friderichsen(1918年)两者提出而得名。
该病多见于重症感染引起败血症,脓毒血症及弥散性血管内凝血(DIC),致两侧肾上腺皮、髓质广泛性出血,破坏了肾上腺的内分泌功能,造成在急性感染的应激情况下糖皮质激素和醛固酮的分泌急剧减少,出现机体抵抗力、免疫能力下降,水盐代谢紊乱,血压下降,很快陷入休克状态。病程进展快,Waterhouse首例报道1例8岁男孩,病后11h即死亡。
该病亦可见于新生儿产伤引起的肾上腺出血,外伤性肾上腺出血,抗凝药物应用不当,重症高血压动脉硬化引起的肾上腺出血及全身免疫功能低下(艾滋病)合并多菌种(病毒、真菌、原虫等)对肾上腺的直接侵犯。病理表现为肾上腺皮髓质广泛出血或广泛性细胞破坏,多发区域坏死灶。
(1)临床表现:主要是由突然发生的胃肠道症状,恶心、呕吐、腹痛、腹泻,肾上腺出血引起的双肋、腹背部疼痛,水钠丢失引起的心悸、乏力、血压下降,可有高热、意识障碍、抽搐、昏迷。也可伴有全身出血、感染征象。
(2)实验室检查:可有白细胞增高,血糖偏低,BUN增高,低血钠,低血、尿皮质醇。
(3)诊断要点:在重症感染时,突然发生出血倾向,伴腹痛、双肋或腹背部疼痛即严重休克和进行性发展的意识障碍,对大剂量糖皮质激素治疗反应好。
(4)治疗原则:①积极治疗原发病(强有力的抗生素、产伤、外伤处置等)。②大剂量糖皮质激素,多次重复应用。氢化可的松500~2000mg/d,地塞米松20~80mg/d,泼尼松100~1000mg/d。③合并DIC者,用肝素抗凝治疗。④静脉补充足够水量,纠正血容量不足。
(5)预后:重症或救治不及时,病死率高。如能渡过急性期,肾上腺皮质功能多能恢复正常,不遗留慢性肾上腺皮质功能不全。仅需在危象缓解后,用小剂量糖皮质激素维持治疗1个月左右,不需长期替代治疗。
二、典型病例
1.病例资料 患者,男性,18岁。以“全身皮肤色素沉着13年”为主诉入院。13年前无明显诱因出现全身皮肤色素沉着,以颜面部及四肢明显,不伴有皮肤瘙痒、皮疹及疼痛,无乏力、头晕、易疲劳、纳差、恶心、呕吐、腹胀、腹泻、怕冷、精神异常、少言,无心悸、晕厥、体重下降等不适。病程中,无咳嗽、咳痰、发热、盗汗、咯血、关节疼痛、肢体活动障碍等不适。平素喜欢运动,体力好,经常从事体育运动。8年前到当地医院就诊,检验结果不详,未进一步治疗。患者生长发育与同龄青少年相似。近年来,患者精神好,体力好,饮食睡眠可,大小便正常,体重无明显变化。1周前来我院门诊查8AM,ACTH>275pmol/L,皮质醇84.3nmol/L。行肾上腺CT平扫+增强检查结果未回报。为进一步检查及治疗收入院。既往无肝炎、结核、疟疾病史,按照当地防疫部门要求预防接种。无烟酒嗜好。父母健在,无兄弟姐妹,否认家族性及遗传性疾病史。入院查体:身高180cm,体重61kg,血压120/60mm Hg。全身皮肤色素沉着,有光泽,以暴露部位明显(图16-15 A~C)。甲状腺未触及,双肺呼吸音清晰,未闻及干湿啰音,心率60/min,律齐,各瓣膜听诊区未闻及心脏杂音,腹部平坦,肝脾肋下未触及,胡须可见,腋毛稀少,阴毛呈倒三角分布,阴茎牵长约7cm,双侧睾丸发育正常,四肢、脊柱发育正常,各关节运动自如,病理征阴性。入院后查凝血四项、肿瘤标记物、甲状腺激素及相关抗体、性腺激素均正常。抗核抗体系列均为阴性。PTH 55.25pg/ml。行75gOGTT(表16-9)未见糖代谢异常。ACTH-F节律(表16-10)提示ACTH明显升高,而皮质醇分泌不足,24h尿皮质醇(UFC)62.23 nmol(正常值:89.0~500.1nmol/d)。ESR 3mm/h。结核三项阴性。PPD试验阳性(+)。肾上腺CT平扫(图16-16A、B)+增强(图16-16C、D):双肾上腺缩小。垂体MRI平扫+增强(图16-17A、B)检查示:垂体MRI平扫及动态增强扫描见垂体前叶较饱满,形态无异常。肺CT平扫(图16-18):右肺上叶纤维索条病灶,邻近胸膜可见增厚。
该患者口服醋酸泼尼松片5mg,口服,每早1次(8:00);2.5mg口服,每日下午1次(16:00),皮肤黏膜色素沉着较前有所减轻,好转出院。
表16-9 患者75g OGTT

表16-10 患者ACTH-F节律


图16-15A 患者与正常对照
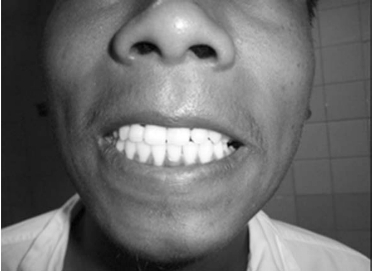
图16-15B 口唇、牙龈色素沉着
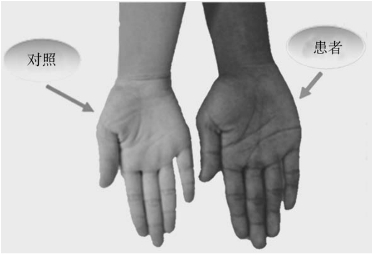
图16-15C 患者与对照组手掌

图16-16A 肾上腺CT平扫
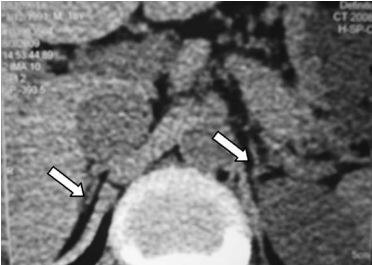
图16-16B 肾上腺CT平扫

图16-16C 肾上腺CT增强

图16-16D 肾上腺CT增强

图16-17A 垂体MRI平扫
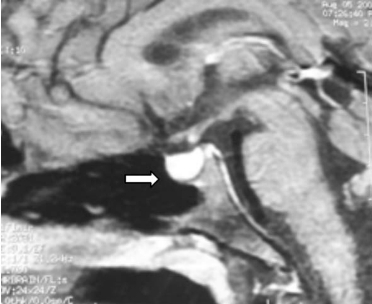
图16-17B 垂体MRI增强

图16-18 肺CT平扫
2.病例分析
(1)关于诊断:艾迪生病是指因肾上腺病变所致的糖皮质激素轴功能低下,ACTH代偿性高分泌,多数情况下皮质醇分泌不足,以至于难以维持人体日常生存所需,可出现怠倦、低血压、低血糖、低血钠等症状。诊断主要依据,皮质醇分泌水平低下引起的相应症状和体征,血浆ACTH明显升高、皮质醇低下或正常(少数人肾上腺皮质还能在ACTH促进下分泌一定水平的皮质醇,满足患者一般生活所需)。本例患者自幼起病,经历青春期至18岁,生长发育均正常,提示肾上腺皮质功能未完全丧失。结合本例临床特点,引起肾上腺皮质功能异常的原因需考虑:①先天性肾上腺皮质增生症,21-羟化酶缺乏;该病主要由于21-羟化酶缺乏导致糖皮质激素合成障碍,ACTH代偿性分泌增多以促进糖皮质激素多分泌,但因伴存的肾上腺来源雄激素分泌过多,轻症男性也会出现青春期发育提前、矮身材,血清17-羟孕酮和脱氢表雄酮增高,本例不支持。②肾上腺结核,是亚洲地区发生艾迪生病的主要致病因素。本例发病年龄小,缺乏明确的结核病史,右肺中部上叶存在纤维索条病灶和胸膜粘连,PPD试验阳性(+),提示可能有过结核感染。但肾上腺未见结核感染后特异性表现(肾上腺肉芽肿性不规则增大,局灶性钙化等),很少见。血清结核抗体阴性,红细胞沉降率正常,近期无活动性结核感染。③自身免疫性多内分泌腺病综合征-1型(APS-1),多在儿童起病,发病初期可有自身抗体和组织淋巴细胞浸润等免疫反应,最终肾上腺萎缩。可合并甲状旁腺功能减退、皮肤黏膜念珠菌病,女性多发,可合并卵巢早衰、恶性贫血。本例起病年龄小、肾上腺萎缩支持APS-1可能,未查见其他内分泌腺体功能异常。总之,本例缺乏明确的引起肾上腺病变的确切病因学证据,病程长且病变程度较轻,目前无肾上腺损伤的活动性病变。
(2)关于治疗:艾迪生病治疗涉及两方面内容。①补充肾上腺功能不足。肾上腺包括皮质(盐皮质激素,醛固酮;糖皮质激素,皮质醇;性激素,脱氢表雄酮),髓质(多巴胺),如为整体损害,性激素和多巴胺可分别由体内性器官和交感神经系统代替分泌,仅余盐皮质激素和糖皮质激素需要适量补充。本例为肾上腺部分性损伤,血钠、血钾、血压均正常,无盐皮质激素缺乏证据。故仅需补充糖皮质激素即可。②病因治疗。本例病史13年之久,无活动性结核证据,近年来肾上腺病变无明显进展,提示是一个慢性发展过程。目前尚无需要处理的病因学证据。
(田 慧 李 虹)
参考文献
[1]廖二元,莫朝晖主编.内分泌学.第2版.北京:人民卫生出版社,2007年.
[2]Bratland E,Husebye ES.Cellular immunity and immunopathology in autoimmune Addison′s disease.Mol Cell Endocrinol,2011,336(1-2):180-190.
[3]Betterle C,Morlin L.Autoimmune Addison′s Disease.Endocr Dev,2011,20:161-172.
[4]Jabbour SA.Cutaneous manifestations of endocrine disorders:a guide for dermatologists.Am J Clin Dermatol,2003,4(5):315-331.
[5]Connor A,Care S,Taylor J.Addison′s disease presenting with acute kidney injury.Clin Med,2010,10(5):515-516.
[6]Leelarathna L,Breen L,Powrie JK,et al.Co-morbidities,management and clinical outcome of auto-immune Addison′s disease.Endocrine,2010,38(1):113-117.
第五节 先天性肾上腺皮质增生症
先天性肾上腺皮质增生症(congenital adrenal hyperplasia,CAH),是由基因缺陷所致的肾上腺皮质多种类固醇类激素合成酶先天性活性缺乏引起的一组常染色体隐性遗传性疾病。由于肾上腺皮质激素合成有关酶缺陷,皮质醇合成部分或完全受阻,使下丘脑-垂体的CRH-ACTH代偿分泌增加,导致肾上腺皮质增生。本病新生儿发病率在欧美地区为1∶16 000~1∶15 000,我国缺乏全国性的筛查,上海无锡等地的筛查结果显示分别为1∶15 321和1∶16 866。
先天性肾上腺皮质增生最常见的酶缺陷是21-羟化酶缺陷(21-OHD),约占90%以上,其余依次为11-β羟化酶缺陷症(11β-OHD),3β类固醇脱氢酶(3β-HSD)缺陷症,17α-羟化酶缺陷症(17α-OHD)及St AR缺陷症。不同类型酶缺陷产生不同生化改变和临床表现。早期诊断、治疗甚为重要,特别是21-羟化酶和11-β羟化酶缺乏,如诊治始于胚胎早期,可阻止雄性化出现,获得正常发育婴儿,如出生时未能识别,常导致后来发育异常,严重病例则夭折于婴儿期。
本节先简要介绍各种类型CAH发病机制和临床特点,然后着重介绍CAH最常见类型21-OHD及近期诊治进展。
一、病因和发病机制
本病是常染色体隐性遗传病,双亲是杂合子,患者则为纯合子,部分患者具有生育能力,子代出现纯合子患者的概率更高,近亲婚配也增加子女出现纯合子患者的概率。
肾上腺中从胆固醇合成肾上腺皮质激素的过程需要多种酶的参与,各种酶在肾上腺皮质束状带、球状带、网状带中的定位,决定了皮质激素合成的方向和空间分布。束状带主要合成皮质醇,参与合成的酶依次是胆固醇20、22裂链酶、17α-羟化酶、3β-HSD、21α-羟化酶、11β-羟化酶(图16-19)。这些酶缺陷造成临床上不同类型的CAH。21α-羟化酶和11β-羟化酶缺陷可以阻断皮质醇和ALD的合成、增加雄激素,故可在临床上引起男性假性性早熟或女性男性化;严重的21-OHD可以出现盐皮质激素的缺乏而导致“失盐”和低血压;而严重的11β-OHD由于具有盐皮质激素作用的脱氧皮质酮(DOC)和11-脱氧皮质醇蓄积,产生高血压和低血钾。3β-HSD缺陷可导致肾上腺皮质3种激素及其作用的缺乏。17α-羟化酶阻断皮质醇和性激素途径,增加球状带盐皮质激素途径的流量,但实际醛固酮水平并不高,同样具有盐皮质激素作用的DOC升高引起高血压、低血钾,性激素途径被阻断致男性完全假两性畸形和女性不发育。不论是何种酶缺陷均可导致垂体ACTH代偿性分泌增加,使双侧肾上腺皮质增生,肤色、皮肤皱褶和掌纹色深。

图16-19 胆固醇代谢途径
二、各型CAH的临床特点、临床诊断和鉴别
胆固醇代谢的中间产物和终产物的增减都会对临床表现产生影响,除ACTH刺激下的肾上腺增生外,各型CAH的表现还具有自身的特点,主要表现的症状有失盐症候群、雄激素过多症候群(女性男性化和男性性早熟)、高血压伴有低血钾、男性女性化等。
1.21-OHD 患者由于21-羟化酶缺乏或活性降低,孕酮和17-羟孕酮不能转化为脱氧皮质酮(DOC)和11-脱氢皮质醇(图16-19),皮质醇合成减少,ACTH反馈性增加,刺激肾上腺束状带增生,孕酮和17-羟孕酮等中间代谢产物增加,部分进入雄激素合成途径导致雄激素增加,严重者也可有盐皮质激素不足,引起失盐症候群。本症根据表现可分为单纯男性化型、失盐型和非经典型。主要表现为不同程度的肾上腺皮质功能减退症状、性分化发育异常。由于疾病谱很广,出现症状的年龄和程度很不相同。严重者(经典型)在出生时即可发现女性男性化/失盐症候群,如女性外生殖器的男性化(女性假两性畸形)及厌食、恶心、呕吐、低血糖、低血钠、高血钾、代谢性酸中毒。新生儿出现假两性畸形、失盐症候群及低血压,应主要考虑21-OHD缺陷症。较轻的患者仅表现不同程度雄激素增高症候群,即女性男性化,男性性早熟。随着年龄的增长,雄激素过多症状和体征逐渐明显而较易被诊断。生长发育期女性患者可有阴、腋毛早现、痤疮、生长轻度加速、阴蒂轻度肥大;男性患儿可出现生长加速,假性性早熟(肌肉发达,骨龄提前,阴茎增大,但睾丸很小);青春期或成年期女性患者可有多毛症、痤疮、月经紊乱和不育等。少数患者无任何高雄激素血症表现,仅因家系调查或体检偶然发现(隐匿性非经典型)。此外,ACTH增高,有不同程度色素沉着,类似艾迪生病表现,全身皮肤黑,皮肤皱褶处,如手指关节伸面、腋窝、腹股沟、乳晕周围尤为明显。实验室检查血浆17-OHP增高;尿17-KS或17-OHP增高也有助于诊断。非经典21-OHD患者可仅表现睾酮轻度升高,ACTH的升高和皮质醇降低均不明显,血清17-OHP也多在正常范围。清晨测定17-OHP常有所升高,可以用于筛查;快速ACTH兴奋实验在临床上诊断非经典型21-OHD有重要意义。
2.11β-羟化酶缺陷 患者DOC和11-去氧皮质醇进一步合成ALD和皮质醇的途径被阻断,皮质醇醛固酮合成减少,ACTH增加,阻断部位的前体物质DOC、11-去氧皮质醇等增加,部分进入性激素合成途径。患者雄激素合成增强引起不同程度的雄性化表现;具有盐皮质激素作用的DOC堆积导致高血压和(或)低血钾,同时肾素活性(PRA)受到抑制。11β-OHD典型表现为高血压(少数伴有低血钾)和女性男性化,可分为重型和迟发型。因酶缺陷的严重程度不同,患者可以有正常血压到严重高血压、低血钾的不同表现。女性男性化与21-OHD类似,女性患者出生时也可出现外生殖器辨识不清,但程度往往不如后者明显。迟发型患者往往在青春期发病,表现为多毛、痤疮、月经紊乱、不育,可有阴蒂肥大(无大阴唇融合),高血压可有可无,男性患儿往往难以诊断,唯一诊断线索是快速生长和阴毛早现。实验室检查可发现皮质醇合成不足,血浆DOC基础值和ACTH兴奋后增高,ALD水平很低,PRA通常被抑制。血浆肾上腺雄激素(雄烯二酮、DHEAS)基础值水平增高,肾上腺雄激素代谢产物如17-KS增高。经典型患者血浆与尿四氢-11-去氧皮质醇增高。测定羊水四氢-11-去氧皮质醇可于产前做出CYP11β缺陷症诊断。
3.3β-HSD缺陷症 患者肾上腺和性腺中3β-HSD酶活性均下降,Δ5-孕烯醇酮不能转化为孕酮,17α-羟孕烯醇酮不能转化为Δ5-雄烯二酮及孕酮,以至皮质醇、ALD及雄激素合成均受阻,而去氢异雄酮(DHEA)可增加,尿中17-KS排出量增多。临床表现主要有:①ALD分泌不足引起的失盐表现;②雄激素合成受阻,但肾上腺雄激素(DHEA)增加,对于男性和女性而言均不能发挥正常作用,常导致男性患者男性化不足,女性患者假两性畸形和不同程度的男性化。经典型症状较为显著,可有假两性畸形(不论男女),出生时外生殖器辨识不清。男性在青春期多有男性乳房发育,女性可有多毛、痤疮和月经稀发。该缺陷者可能是多囊卵巢综合征主要的原因之一。实验室检查血浆孕烯醇酮、17α-羟孕烯醇酮和DHEA升高,血浆或尿中Δ5/Δ4-类固醇比值升高。ACTH兴奋试验对于轻型病例有诊断价值。ACTH兴奋后,17-羟孕烯醇酮、DHEA明显增加,17-羟孕烯醇酮/17羟孕酮,17-羟孕烯醇酮/皮质醇比值高于正常,可确诊。据此也可与21-羟化酶缺乏进行鉴别。
4.17α-羟化酶缺陷症 因酶缺陷,阻断了皮质醇和性激素合成通路,ACTH分泌增多,盐皮质激素途径活性增强,皮质酮和DOC合成显著增加(可为正常的30~60倍),ALD通常降低。主要表现:①性发育障碍。患者常因原发性闭经或青春期延迟而就诊。女性至青春期乳房不发育,无腋毛、阴毛,无月经,外阴幼女式、体型瘦高、肤色黝黑。男性由于胚胎期无睾酮,外生殖器似女性或部分男性化,往往作为女性培养。但无子宫、输卵管,睾丸可位于腹股沟或腹腔内。②低肾素性高血压、低血钾:患者往往有不同程度高血压。有的7~8岁即出现高血压,个别有严重高血压,一般抗高血压药难以奏效。低血钾多见,患者常伴有无力、疲劳、夜尿,甚至麻痹、骨骺融合延迟。③通常不表现肾上腺皮质功能减退。皮质酮具有部分糖皮质激素活性,极高水平的皮质酮可以代偿皮质醇作用。实验室检查可有低血钾、低ALD,低肾素活性(受DOC等抑制),血孕酮、皮质酮、DOC增高,尿17-KS、17-OHCS排泄减低。
5.St AR缺陷症 极罕见,对有皮质功能不足症候群的新生儿、假两性畸形的男性(46,XY),出生后不久出现肾上腺功能减低危象,均应考虑St AR缺陷症。若实验室检查发现所有的肾上腺或性腺激素均减低或不可检出,即可确诊。
各型CAH的鉴别诊断见表16-11。
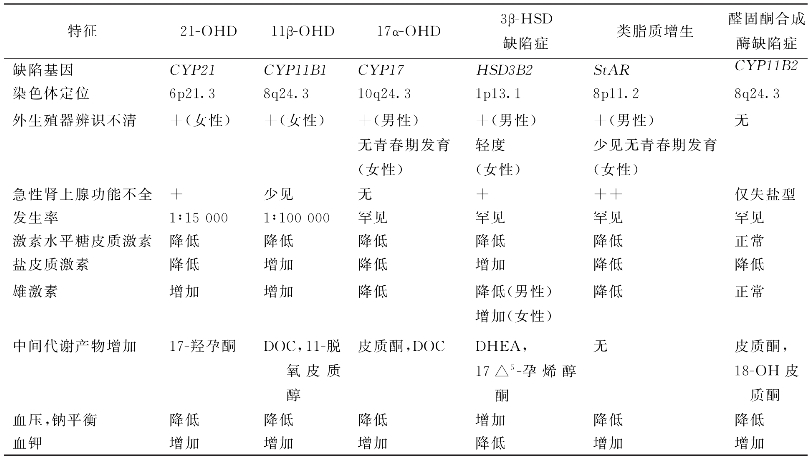
表16-11 各类型CAH的特征
三、CAH的治疗
1.糖皮质激素替代治疗 GC为各种类型CAH的主要治疗手段,主要作用是抑制ACTH,减少21-OHD、11β-OHD和3β-HSD缺陷症的雄激素水平,降低11β-OHD和17α-OHD的脱氧皮质醇(DOC)水平,进而改善这些患者的骨龄、终身高或高血压,增强患者应激能力。对所有类型的CAH,临床上选用氢化可的松口服最为理想,它属于生理性糖皮质激素,本身具有一定的潴钠作用,更加适合于儿童患者应用。剂量原则上先大后小,维持量一般为氢化可的松20~40mg/d,分2次口服。泼尼松或地塞米松这些制剂作用更强、作用时间持续更久,但对生长的抑制作用大,故在处于生长发育期的儿童中不用。应激如外伤、手术、发热时,需要酌情增加GC量。严重应激可静脉应用氢化可的松,稍后迅速减量。
2.盐皮质激素替代治疗 盐皮质激素主要用于治疗失盐型21-OHD、3β-HSD缺陷症和St AR缺陷症患者,但大多数盐皮质激素缺乏的患儿(失盐型尤其是21-OHD)“失盐”表现可以随年龄增长而缓解,盐皮质激素治疗也可随之停止。常用的盐皮质激素为9α-氟氢可的松,剂量通常0.05~0.2mg/d,治疗期间应对血压,电解质,卧、立位肾素活性进行检测以评估治疗反应。对于严重失盐型患者,有严重脱水或休克时,需要静脉补液及静脉应用皮质醇,经上述治疗使血压升高,尿钠排泄增多后,给予醋酸去氧皮质酮1~5mg/d。急性危象纠正后,可改用氢化可的松和氟氢可的松口服。单纯男性化型CAH也可给予盐皮质激素治疗,能减少氢化可的松用量,改善患者线性生长,抑制PRA。另外需要注意的是,在进行盐皮质激素治疗的同时应适当增加每日食盐摄入量。
CAH常规治疗见表16-12。
表16-12 CAH常规治疗

引自廖二元主编《内分泌学》2版
3.性分化和发育异常的治疗 对于性分化异常的CAH患者,应确定患者的染色体性别、性腺性别,评价外生殖器分化发育情况,尽早诊断、及时治疗可以部分消除后续的影响。21-OHD、11β-OHD和3β-HSD缺陷症可以出现女性假两性畸形。无论其外生殖器男性化的严重程度如何,她们在新生儿期都应尽量按女性进行抚养。外生殖器严重畸形者需行外科矫形于术,宜在3岁前进行,使性别及早得到确认,病儿能在正常的方式下成长。手术首选保留血管神经的阴蒂成形术和外阴成形术,对于误作男孩抚养的女性假两性畸形儿,不愿改变性别者,宜在补充皮质激素治疗后,切除卵巢及子宫,同时补充睾酮或其他类似的雄性激素。对于仅表现阴蒂增大的女性患儿,早期药物治疗改善体内性激素的水平,可以使阴蒂有所回缩,有些可避免手术。正确而早期开始的治疗可使这种患者获得正常的青春发育和生育能力。
4.治疗过程中的监测 CAH的治疗为终身,如果治疗及时且适当,效果较好,可获得正常的生长、发育和生育能力。治疗过程中的监测非常重要,一般建议:①每3个月监测血17α-OHP、DHEA、睾酮、PRA,24h尿中17-KS、17-OHS、孕三醇,可以用于所有类型CAH的治疗调整;②生长期患儿应定期检测身高增长速度,每2年测1次骨龄;③睾酮值应抑制在相应性别、年龄的正常范围内。一些文献认为17-OHP易受疼痛、昼夜节律等因素影响,24h内波动可相差达10倍,故推荐17-OHP代谢产物——尿孕三醇为监测指标。
四、21-羟化酶缺陷症的诊治
(一)流行病学
21-OHD是CAH的最常见类型,约占全部CAH的90%。新生儿发病率有明显的种族差异,一般为1∶15 000~1∶5 000,在一些相对封闭的族群如阿拉斯加的因纽特人则高达1∶300。非经典型21-OHD的发病率远较经典型21-OHD高,非犹太白种人群中为1∶2000~1∶1000。因非经典型诊断率不高,根据对北美经典型患儿和携带者的筛查进行计算和估计,其发病率有可能高达1∶100,使之有可能成为最常见的常染色体隐性遗传疾病。
(二)21-OHD的分子遗传学
21-OHD是常染色隐性遗传疾病,由CYP21基因缺陷引起。典型家系中父母均为杂合子,无临床表现,但其子代中出现纯合子(大多为复合杂合子)CYP21基因缺陷,表现为CAH。
21-OHD的基因缺陷发生在CYP21基因,但人类同时存在一个无活性的假基因CYP21P。两者高度同源,外显子序列同源性高达98%,内含子为96%,共同定位于第6号染色体短臂(6p21.3),与组织相容性抗原HLA-B、DR紧密连锁,并与补体C4A和C4B相邻(图16-20A),这种定位有双重意义,一方面,该区域多数基因表达参与免疫调节,因此有着很高的重组频率,这是CYP21高突变率的基础;另一方面,可以利用与HLA-B、DR的紧密连锁,可用HLA分型对CYP21缺陷症患者进行基因分型。由于CYP21基因结构和位置的特殊性,常因与CYP21P之间发生的基因重组或转换,使CYP2l基因比较容易发生突变,而突变大多来源于CYP21P(图16-20C)。另外,CYP21P和CYP21可以在减数分裂中进行非对称交换,导致子代染色体中出现3个CYP21基因和1个无功能(重组)的CYP21基因,无功能CYP21基因进入子代可导致21-OHD(图16-20B)。
CYP21基因突变和临床表型间存在着良好的相关性。基因突变的位点和性质很大程度决定了临床表现的严重程度,相同的突变常具有相似的临床表型。失盐型(SW)患者大多(56%)存在第3外显子5′端上游第13个碱基(位于第2内含子内)有点突变(a→g)(图16-20C),这种点突变可以导致RNA剪接异常,临床表型介于失盐型和单纯男性化型之间;32%有等位基因大片段缺失或基因易位,这种突变如G110Δ8nt、F306+1nt、Q318X,由于酶活性几乎全部丧失,因此临床表现更为严重(图16-20C)。单纯男性化型以I172N突变最为常见,其次是第2内含子的点突变。第7外显子V281L突变患者表现为非经典21-OHD(图16-20C),该突变也第一个被报道的非经典型突变位点,也是白种人非经典型21-OHD最常见(60%)的突变位点。目前的报道亚洲人中以P30L突变最为常见(图16-20C);这些突变仅导致轻度的酶活性下降,其临床表现差异很大,出生时外生殖器畸形较少见。女性以多毛、痤疮、月经紊乱、不孕等一系列雄激素增多症状为主要表现。男性症状不典型,部分患者可完全无临床表现,临床上易漏诊或误诊。
(三)生化机制和临床表现
21-羟化酶的作用是在肾上腺皮质网状带及束状带,分别催化孕酮转化为脱氧皮质酮(DOC),以及17-羟孕酮(17-OHP)转化为11-脱氧皮质醇,这两种物质分别是肾上腺合成醛固酮及皮质醇必需的前体物质。21-羟化酶缺乏或失活,皮质醇合成减少,解除了对ACTH的抑制,ACTH代偿性分泌增多,促进双侧肾上腺皮质增生,21-羟化酶酶促反应的前体物质孕酮及17-OHP堆积,并且向雄激素合成途径转化,皮质醇和ALD减少,雄烯二酮、睾酮等增多,导致肾上腺皮质功能减退、性分化发育异常(男性性早熟和女性男性化)的临床表现。在非经典型21-OHD中,上述病理过程常不明显,而皮质醇合成的前体物质17-OHP仍可一定程度的堆积,肾上腺源性的雄激素产生过量,并进一步生成高生物学活性的雄激素睾酮和二氢睾酮,临床出现一系列高雄激素血症的症状和体征。

图16-20 CYP21邻近部位结构、重组和突变位点
A图中CYP21P和CYP21分别为21羟化酶假基因和活性基因。C4A和C4B编码血清补体成分。RP1编码未知功能的核蛋白,互补链上存在TNXB编码关键蛋白X,TNXA是相应的假基因。约20%的21-OHD可出现图示中30kb的缺失。B图中,CYP21P和CYP21可以在减数分裂中进行非对称交换,导致子代染色体中出现3个CYP21基因或1个无功能(重组)的CYP21基因。C图显示基因所涵盖的10个外显子和常见的突变位点。这些突变在正常情况下可以在CYP21P假基因中出现,但也可以重组进入CYP21基因产生21-OHD。21-OHD的基因型和表现型的一致性非常高,突变P30L、V281L通常表现为非经典21-OHD,I172N表现为单纯男性化,其他突变可出现失盐型表现
21-OHD主要表现为肾上腺皮质功能减退症状、性分化发育异常。其他非特异的改变包括性格改变、好动、注意力不集中、学习成绩差,可能与雄激素过高有关。根据其临床表现分为经典型及非经典型。其中经典型又包括单纯男性化型和失盐型。
单纯男性化型21-OHD:妊娠期胎儿起病,出生后女性新生儿患者外生殖器男性化。无失盐表现,但可出现轻度PRA增高。女性外生殖器因胎儿期不同的雄性化程度而表现不同程度的畸形。性腺和内生殖器发育正常,无睾丸,较轻的患儿予以适当的GC替代治疗和外生殖器修复术仍可生育。女性男性化严重者在出生后经常被误认为是男婴。男性患儿在出生时外生殖器一般无异常,少数可仅在会阴部有轻度色素沉着及阴茎稍大,其内生殖器发育正常。男性患者和非失盐型患者的女性男性化不易引起注意,其后进一步出现阴茎过大、阴蒂肥大、生长过快和性毛早现才被诊断。出生后,女性患者外生殖器的男性化程度进一步加重,而男性患者则可出现男性假性性早熟,表现为阴毛提早出现,阴茎、前列腺增大,可有勃起,显示发育过度,但睾丸很小;儿童早期生长加速,肌肉发达,肩距宽,皮肤粗糙,比同龄人高大,又由于雄激素的作用使骨骺提前融合(11~12岁已完全融合),最终身高又低于同龄人,体形粗矮丑陋,最终长成矮小宽肩的小“大力士”体型;未经治疗成年男性,其间质细胞功能、精子生成大多正常,少数患者没有正常青春期,睾丸体积小,无精子、不育。女性患者还可表现月经稀发、不规则或闭经,多数患者不育,肌肉亦较发达,嗓音变粗,出现痤疮、喉结、多毛甚至胡须,阴、腋毛提早出现。
失盐型(salt-wasting,SW)21-羟化酶缺陷症:约占本病诊断患者的1/3,由皮质醇、ALD缺乏和雄激素分泌过多所致。除上述男性化表现外,患儿出生后表现拒食、不安、昏睡,常有反复呕吐、腹泻和体重迅速下降,肾小管潴钠和排钾功能丧失可出现低钠血症、高钾血症、代谢性酸中毒,一些患儿由于皮质醇缺乏可出现低血糖症,甚至肾上腺皮质功能减退危象。如不及时治疗,可以因循环衰竭而死亡。由于ACTH增高,有不同程度色素沉着,类似艾迪生病表现,全身皮肤黑,皮肤皱褶处,如手指关节伸面、腋窝、腹股沟、乳晕周围尤为明显。
大部分失盐型患者从1~4周可逐渐发展为肾上腺危象。ALD缺乏也可随年龄的增长而逐渐好转,肾脏保钠能力增强,血钠逐渐升高,但仍低于正常。未经治疗的失盐型CYP21缺陷症,血清ALD低于正常(<50~250ng/dl),伴血浆肾素活性增高。
非经典型21-OHD:21-羟化酶质或量的部分丧失,临床表现较轻,一般出生后无失盐症候群,女性无外生殖器异常。青春期前少数患者可有性毛早现、痤疮、阴蒂轻度肥大及儿童期的生长速度加快;在发热或其他应激状态下,也可不出现肾上腺皮质功能不全的表现。女性青春期或成年期可有多毛症、囊性痤疮、月经紊乱和不育等。少数患者无雄激素过多症状(隐匿性非经典型)。男性患者可无症状或症状较轻,可出现青春发育提前、性毛早现、痤疮、生长轻度加速,但成年后身材较矮。雄激素过多分泌可引起垂体促性腺激素释放抑制而致生精障碍和生育能力下降。
(四)21-OHD的实验室检查和诊断
除高危人群进行产前诊断和新生儿筛查外,新生儿出现外生殖器辨识不清、失盐、低血压和低血糖均应考虑到本病。失盐型患者可有低血钠、高血钾和血浆肾素活性增高。随着年龄增长,一些患者可以表现为性早熟或PCOS及肾上腺雄激素(DHEAS和雄烯二酮)的增高。ACTH兴奋试验可以用于这类患者的鉴别诊断。
1.产前诊断 产前诊断的目的:①对胎儿进行产前治疗阻止外生殖器男性化,避免手术治疗;②鉴定性别,防止女性男性化患者性别认同错误;③中止男性胎儿与非CAH女性胎儿的不必要产前治疗,并对产后提供适当的治疗。准确的CAH产前预测要求正确的基因分型(包括父母)和正确的临床表型估计。方法:①羊水激素检测。1975年Fraiser等首次报道羊水17α-羟孕酮监测用于失盐型患儿产前诊断。羊水17α-羟孕酮、Δ4雄烯二酮增高均有诊断意义。但该方法仅能在妊娠中期以后对有明显异常的失盐型患儿进行诊断,并且对于长期服用地塞米松的孕母需停药5~7d,因此具有一定的局限性。②胎儿HLA分型。CAH与人类白细胞抗原连锁是该病诊断的重要进展之一,21-羟化酶基因CYP21位于HLA基因内部,如果羊膜穿刺培养胎儿细胞的HLA血清学分型与家族CAH先证者一致,则高度怀疑CAH。③基因诊断。绒毛活检术(chorionic villi sampling,CVS)结合基因诊断技术可用于胎儿早期(妊娠10~12周)诊断。通过CVS或羊膜穿刺获得的胎儿DNA,采用PCR扩增和直接测序技术可以检测绝大多数CAH基因突变患儿。④胎儿性别也作为产前诊断的重要内容,有研究通过孕妇外周血提取胎儿DNA标记SRY基因可将预测胎儿性别的时间提前至妊娠第6周,可以有效地地指导临床宫内治疗。⑤超声检查可以在妊娠中晚期发现CAH胎儿肾上腺增大(>第95百分位),肾上腺可呈脑回状表现。
2.新生儿筛查 21-OHD新生儿筛查的主要目标是辨认有发生危及生命的肾上腺危象的婴儿及避免外生殖器不明确的女性婴儿被误认为男性。对于初始表现即为肾上腺危象的男孩尤为重要。另外,早期辨认可以对受累婴儿及儿童进行监测及治疗,以避免产后暴露于大量雄激素及伴随的临床表现,美国内分泌协会建议用双重筛查方法,先用免疫法进行17-OHP检测,并根据出生孕周数(选择孕周数要优于出生体重)确定诊断切点。免疫法具有较高的假阳性率,因而作为第一步筛查。而液相色谱法/串联质谱法(MS/MS)可增加CAH筛查的阳性预测值,使假阳性率减至最低。新生儿21-OHD筛查的参考途径:先进行新生儿毛细血管血17-OHP的筛查,如结果超过第95~98百分位数值(出生体重或孕周数校正后),应进行第二重检测(MS/MS法)或直接进行DNA检测。如第二重检测仍>第95~98百分位数值或DNA检测到突变位点,则进一步行ACTH兴奋试验。ACTH兴奋试验方法:静脉推注ACTH(1~24肽)0.25mg,注射前(基础值0min)注射后60min取血测17-OHP。若兴奋后17-OHP<1500ng/dl,可能为21羟化酶杂合突变,无需进一步治疗,但应随访;17-OHP>10 000ng/dl多为经典型CAH,需要糖、盐皮质激素治疗,并根据治疗反应调整药物;17-OHP在1500~10 000ng/dl多为非经典型CAH,如有症状,应进行氢化可的松治疗;无症状者需密切随访。
3.单纯男性化型CAH的诊断 女性在诊断过程需与以下疾病进行鉴别:①男性假两性畸形(XY)和XO/XY嵌合型,虽然外生殖器有类似表现,但本病单纯男性化型患者核型是XX而予鉴别。②真两性畸形,外生殖器类似,核型可以是XX,但血雄激素,尿17-酮正常。③分泌雄激素的肿瘤:本病男性患儿需与儿童期雄性化肿瘤和阴毛早现相鉴别。胎儿期发病者鉴别诊断不难,若血睾酮水平低于6mmol/L(170mg/dl)可除外分泌雄激素的肿瘤。对于晚发型患者中剂量地塞米松抑制试验对鉴别有帮助。中剂量DXM抑制试验常用两种方法:五日法和一日法。五日法:口服地塞米松0.75mg,每6h 1次×5d,于服药前和服药后第2天,第6天测定血浆17-OHP及睾酮。一日法:服地塞米松0.75mg,每6h 1次×1d,同样测定对照日和服药后第2天血浆17-OHP和睾酮。该实验主要目的帮助鉴别CAH与肾上腺雄性化肿瘤。服用地塞米松后,CAH患者的ACTH分泌受到抑制,其17-OHD和睾酮分泌减少至正常或近于正常;如果不被抑制为肾上腺肿瘤。据北京协和医院的资料总结,一日法与五日法具有相同的诊断价值,但更简便、时间短。肾上腺肿瘤患者对地塞米松抑制试验无反应。④非肾上腺源雄激素过多所致女性假两性畸形,此外还有一些原因不明女性假两性畸形,往往伴有尿道生殖道畸形,如双输尿管、膀胱-肠道瘘,先天性肛门闭锁和其他畸形。
单纯男性患儿应与真性性成熟相鉴别:后者有睾丸发育,17-KS或睾酮排出量高到青春期水平,但尿孕三醇或17-OHP不增加。单纯型男性化肾上腺皮质增生患儿,睾丸都不发育,除了17-酮类固醇明显增加之外,17羟孕酮及其代谢产物尿孕三醇也增多。
4.非经典型21-OHD的诊断 阴毛早现可作为重要的提示症状,阴毛早现儿童8%~30%诊断为非经典型21-OHD。非经典21-OHD是青春期或成年女性高雄激素血症的一个重要原因,可有多毛、痤疮、脂溢性皮炎、秃顶等,常常难于与其他引起高雄激素血症的原因如多囊卵巢综合征(PCOS)进行鉴别。而40%的非经典型21-OHD患者B超可有多囊卵巢改变。部分患者主诉月经紊乱或不孕症。同多囊卵巢综合征类似,非经典型2l-OHD也因慢性的高雄激素血症合并有代谢异常。而且与高胰岛素血症互相加重,形成恶性循环。患者胰岛素敏感性有显著下降,并具有显著增高的空腹胰岛素和稳态模式胰岛素抵抗指数(HOMA-IR),动脉中膜厚度较健康对照组也有显著增厚。部分患者无任何高雄激素血症表现,仅因家系调查或体检偶然发现,称之为“隐匿性”21-OHD。
实验室检查中,非经典型21-OHD患者睾酮和雄烯二酮、脱氢表雄酮可以有所升高,但低于经典型。轻度升高的睾酮常成为唯一线索,但不能作为诊断依据。与经典型不同,血ACTH的升高及皮质醇的降低均不明显。其特异性诊断指标血清17-OHP浓度随机测定时也多数在正常范围,仅清晨测定有所升高。单次血清17-OHP浓度主要用于临床筛查,筛查的异常人群应行ACTH兴奋试验进一步诊断。如以基础17-OHP浓度6.0nmol/L(2.0μg/L)为筛查切点,有10%~15%的患者高于此切点最终被诊断为21-OHD,而低于此切点的所有患者均被除外该症。患者ACTH兴奋实验后60min的17-OHP浓度大多在30.3~60.6nmol/L(10~20μg/L),一般认为达到45.5nmol/L(15μg/L)以上即可诊断。对于ACTH兴奋实验后60min的17-OHP浓度在30.3~45.5nmol/L的患者,可行基因型检测以进一步明确。部分患者影像学检查可以发现肾上腺增生,有研究报道其发生率可达45%。
(五)21-OHD的治疗
21-OHD药物治疗主要是根据需要补充外源性糖皮质激素和盐皮质激素,具体应用原则和治疗监测见前述CAH的治疗。在疾病的各个时期,治疗目的和治疗手段均有所差异。
1.胚胎期的治疗 胚胎期的治疗:肾上腺是在胚胎发育第4周由中胚层上皮分化而来,胚胎6~7周开始分泌类固醇,此时CAH胎儿的高雄激素使女性胎儿外生殖器向男性化发育,而由于米勒管存在并不影响女胎内生殖器的发育。因此,患者内生殖器仍表现女性型。胚胎早期即补充皮质激素可有效遏制女胎男性化发育,提高患儿的生活质量。这是胎儿宫内治疗的基础。宫内治疗选择标准:①先证者为同胞或一级亲属,且经DNA分析证实存在可导致经典型CAH的突变;②孕母了解CAH及宫内治疗风险,愿意继续妊娠并接受治疗。治疗应在妊娠3~6周开始。地塞米松容易通过胎盘,并且不会被胎盘11βHSD2酶解失活,剂量每日20μg/kg,分2~3次口服,最大剂量不宜超过1.5mg/d(1~1.5mg/d),直至妊娠末期。治疗的主要目的是有效抑制肾上腺雄激素的过量分泌,阻止女性胎儿雄性化,降低女性生殖器男性化的发生,避免手术和男性化所造成的心理障碍(推测可能与宫内大脑发育过多暴露于雄激素有关)。21-OHD是第一种应用产前治疗的疾病,通常方法:DXM 1~2mg/d,母亲每天分1~4次服用。妊娠早期即开始DXM治疗的患者大部分在出生后不需手术治疗。如果产前治疗在妊娠中期中断或妊娠期10周后开始,新生儿将有严重的男性化外生殖器。母亲在妊娠期第1周服用DXM 0.5mg,每个月3次,疗效最佳,但应注意其不良反应的发生与防治。胎儿性别确定是本病产前诊断的重要部分,当确定胎儿为女性CAH患儿后治疗需持续至妊娠足月,如为男性胎儿或非患病胎儿即可中止治疗。尽管目前利用母血DNA技术早在妊娠6周即可预测胎儿性别,仍有3/8的胎儿被过度治疗。然而绝大多数研究者仍认为宫内治疗利远大于弊。另外需要注意的是,胚胎期治疗不能阻断患者出生后的疾病进程,仍需终身激素替代治疗以及监测。到目前为止最大的一项研究,收集了532 CAH胎儿病例,其中281例在胎儿期就开始治疗。105例经典型CAH(61例女性,44例男性),至今尚未发现对胎儿有不良影响,也无畸形和其他危险。
2.出生后的治疗 对筛查出的CAH患儿不管是否有肾上腺危象症状和体征,都应立即开始治疗,并监测17-OHP、雄激素和皮质素变化。若失盐表现重与性分化异常,应立即静脉滴注5%葡萄糖盐水,内加氢化可的松或醋酸可的松(初始剂量为25mg),其后几天为25~30mg/d。21-羟化酶缺陷症诊断必须根据严格的实验室检查证实。即血清17-OHP明显增高达20~60ng/ml(正常值为1~3ng/ml)。对患者家属进行遗传学教育。
胎儿期诊断的21-OHD在出生后应继续治疗,而出生后新诊断患儿也应立刻开始治疗,治疗目的是纠正新生儿急性肾上腺皮质功能不足,抑制过高ACTH,使中间代谢产物减少,如17-羟孕酮、21-去氧皮质醇,继而使雄激素减少,阻止雄性化,使生长速率减慢,骨骺融合接近正常年龄,尽可能达到正常身高。对女性患者恢复正常排卵和生育能力;对男性患者治疗的目的是阻止假性性早熟和恢复生育能力。由于儿童生长期长达10多年,在治疗过程中要根据患儿身高增长速度,血睾酮、17-羟孕酮和ACTH浓度等,定期调整皮质醇激素治疗剂量。处于生长发育期的患者,需要平稳良好地控制雄激素分泌及尽量获得正常身高。21-OHD患者的最终身高往往低于正常水平。一项荟萃分析对18项研究结果进行了总结,发现21-OHD患者的平均终身高标准差与目标终身高标准差计分之差平均为-1.03(-4.21~2.32)。主要原因可能有:①高水平雄激素对骨骼的直接作用,导致骨骺提前融合;②高水平雄激素导致骨龄提前,当骨龄达到11~12岁或以上时,可能引发下丘脑-垂体-性腺轴激活,导致中枢性性早熟,即在假性性早熟基础上发生中枢性性早熟,会进一步加快骨骺闭合;③接受外源性肾上腺皮质激素治疗,尤其是在超生理量的皮质激素治疗下,干扰内源性hGH分泌、减弱类胰岛素生长因子(IGF)的生物活性、影响骨和胶原蛋白的形成等。初治年龄、治疗方案都会对最终身高产生影响。尽早诊断、尽早治疗可以有效改善身高预后。早期有效的皮质醇激素替代治疗能抑制骨龄过快增长;对于已发生中枢性性早熟的患儿,可在肾上腺皮质激素替代治疗基础上给予hGH,Gn-RHa等药物治疗以获得正常身高,具体应用原则可参照“性早熟章节”。
3.妊娠期间的治疗 妊娠期间的治疗:部分及时正规治疗的经典型21-OHD患者可以成功妊娠。妊娠期间应适当增加糖皮质激素剂量,并平均1~2周测血清17α-OHP,女性胎儿则更要密切随诊。待胎儿安全分娩后再逐渐减量,Lo报道3例失盐型、1例经典型21-羟化酶缺乏症孕妇,经密切激素水平检测,调整泼尼松用量,均成功分娩了外生殖器正常的女性新生儿。
4.非经典21-OHP的治疗 非经典型21-OHP的治疗:治疗原则同经典型2l-OHD类似,以糖皮质激素替代为主,抑制ACTH分泌及垂体-肾上腺轴的不良反馈,进一步达到纠正肾上腺源性雄激素合成紊乱的目的。对于儿童或青少年患者,仍建议使用对生长发育影响较小的短效糖皮质激素,如氢化可的松等。
5.手术治疗 见前述CAH治疗。
五、典型病例
病例1 女性,23岁,汉族,主因外阴畸形23年。第2胎第2产,足月顺产,出生后发现有小阴茎样阴蒂,尿道开口在阴蒂下方。8岁时行“阴茎切除术”,9岁时出现身高骤长,体力正常。2007年行染色体核型分析:46,XX。患者现声音变粗,肤色较黑,阴毛、腋毛正常,无乳房发育。查体:血压110/80mm Hg,身高151cm,体重48kg,BMI 21.1kg/m2,腰围72cm,臀围85cm,上部量80cm,下部量71cm,指间距155cm。全身皮肤色素沉着,乳房未发育。女性外阴,阴毛呈菱形分布,尿道口位于阴蒂下方约1.5cm处,其下方可见阴道开口,阴道内有支撑物(图16-21)。
肾上腺CT平扫+增强:双侧肾上腺明显增粗肥大(图16-22)。

图16-21 病例1外观表现
经阴道妇科超声:子宫体积小,大小3.7cm×2.1cm×3.1cm,双卵巢多囊样改变,右卵巢大小2.7cm×1.9cm×2.1cm,左卵巢大小1.8cm×1.7cm×1.9cm,双卵巢内均可见多个卵泡,右侧大者直径约0.9cm,左侧大者直径约0.7cm。性腺五项:T:8.23 nmol/L;E2:132.53pmol/L;LH:10.87m U/ml;0‘PRL 27.73μg/L;FSH 7.93U/L。血清ACTH:3.0pmol/L(0a.m.),62.2pmol/L(8a.m.),19.4pmol/L(4p.m.);O血清F<25.7nmol/L(0am),147.8nmol/L(8am),121.4nmol/L(4pm)。
卧立位实验结果:


图16-22 病例1双侧肾上腺CT表现(平扫:上左、上右;增强:下左、下右)
中剂量地塞米松抑制实验结果:

DHEA正常值:35~430 ng/ml(女性);17-OHP正常值:0.14~4.28 mg/dl(女性)。
诊断:21羟化酶缺陷症。
病例2 女性,14岁,学生,主因外生殖器两性畸形14年。患者系第2胎第2产,足月顺产。其母孕期曾服“孕宝”,有化肥接触史,余无特殊。满月时其母发现其外生殖器两性畸形;智力同当地同年龄段儿童无差别。3岁时出现喉结,变声,力大,唇前小须;5岁时喉结明显,腋毛、阴毛生长。12岁前生长迅速,近2年身高未改变;12岁时,向母亲提出想当男孩的意愿。从未有月经来潮,乳房未发育。血压125/65mm Hg,反复测血压均正常。身高147.5cm,体重50.1kg,上部量73.5cm,下部量74.0cm,指尖距143cm。全身肤色黑,皮肤粗糙;上唇有少量胡须,腋毛正常,阴毛浓密,喉结明显。双乳晕色深,下方未触及乳核,无触痛,乳房Tanner1期。阴唇阴囊皱襞部分融合,阴蒂肥大,酷似阴茎,约5cm×2.5cm×2.5cm,有类龟头,尿道开口(图14-23)。在阴茎根部,腹股沟区未触及包块。性腺五项:T 27.55nmol/L,E2 107.09pmol/L,LH 3.60m U/ml,PRL 24.09μg/l,FSH 6.92U/L,P 54.72nmol/l。腹腔超声:子宫2.2cm×0.9cm×2.2cm,卵巢右1.7cm×0.8cm,左2.4cm×1.0cm,未见明确睾丸结构。骨龄检查发现骨骺已经闭合(图16-24)。肾上腺CT平扫加增强:双侧肾上腺增生(图16-25)。染色体核型分析:46,XX。

图16-23 病例2的外观表现
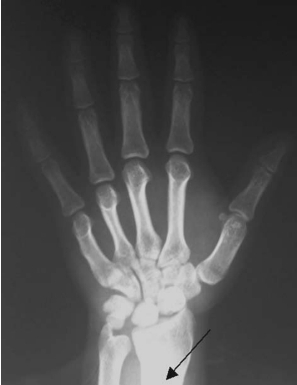
图16-24 骨龄片显示骨骺已闭合
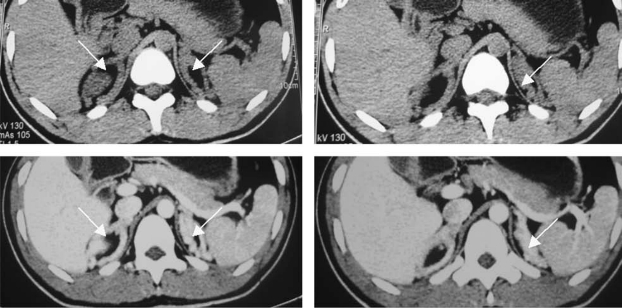
图16-25 肾上腺CT显示双侧肾上腺增生
两次ACTH和皮质醇基础值结果如下:
2011年7月11日
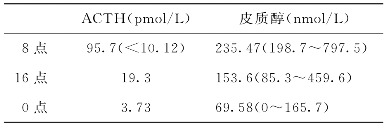
2011年7月13日

DHEA:728μg/dl(正常值35~430μg/dl),17-OHP 44.8ng/ml(正常值0.6~3.34ng/ml)
中剂量地塞米松抑制试验结果如下:
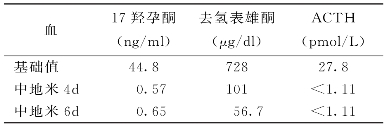
诊断:21-羟化酶缺陷症。
(母义明 陈 康)
参考文献
[1]Van der Kamp HJ,Wit JM.Neonatal screening for congenital adrenal hyperplasia.Eur J Endocrinol,2004,151[suppl3]:71-75.
[2]顾学范,周德建,叶军.上海地区新生儿先天性肾上腺皮质增生症的筛查.中华预防医学杂志.2002,36(1):16-18.
[3]吴志军,朱云霞,陈道桢.无锡地区新生儿先天性肾上腺皮质增生症的发病情况探讨.中国优生与遗传杂志,2006,14(10):72.
[4]Ritzen EM,Lajic S,Wedell A,et al.How can molecular biology contribute to the management of congenital adrenal hyperplasia?Horm Res,2000;53:34-37.
[5]Costa EM,Mendonca BB,Inacio M,et al.Management of ambiguous genitalia in pseudohermaphrodites:new perpectives on vaginal dilation.Fertil Steril,1997,67:229-232.
[6]Merke D,Kabbani M.Congenital adrenal hyperplasia:epidemiology,management and practical drug treatment.Paediatr Drugs,2001,3(8):599-611.
[7]Romaguera J,Moran C,Diaz-Montes TP,et al.Prevalence of 21-hydroxylase-deficient nonclassic hyperplasia and insulin resistance among hirsute women from Pueto Rico.Fertil Steril,2000,74:59-62.
[8]Speiser PW,Dupont B,Rubinstein P,et al.High frequency of nonclassical steroid 21-hydroxylase deficiency.Am J Hum Genet,1985,37:650-667.
[9]Bristow J,Gitelman SE,Tee MK,et al.Abundant adrenal-specific transcription of the human P450c21A“pseudogene”.J Biol Chem,1993;268:12919.
[10]Levine LS,Zachmann M,New MI,et al.Genetic mapping of the 21-hydroxylase deficiency gene within the HLA linkage group.N Engl J Med,1978,299:911.
[11]Phyllis WS,Perrin CW.Congenital adrenal hyperplasia.N Engl J Med,2003,349:776-788.
[12]Krone N,Braun A,Roscher AA,et al.Predicting phenotype in steroid 21-hydroxlysae deficiency?comprehensive genotyping in 155 unrelated,well defined patients from southern Germany.J Clin Endocrinol Metab,2000,85:1059-1065.
[13]Speiser PW,New MI,White PC.Molecular genetic analysis of nonclassic steroid 21-hydroxylase deficiency associated with HLA-B14,DRI.N Engl J Med,1988,319:19-23.
[14]Tajima T,Fujieda K,Nakae J,et al.Mutations of the CYP21 gene in nonclassical steroid 21 hydInxylase de6cien.y in Japan.Endocr J,1998,45:493-497.
[15]Forest MG.Recent advances in the diagnosis and management of congenital adrenal hyperplasia due to 21一hydroxylase deficiency.Hum Reprod Update,2004,10(6):469-485.
[16]Frasier SD.Thomeycroft IH,Weiss BA,et al.Elevated amniotic fluid concentration oI 17 alphahydroxyprogesterone in congenital adrenal hyperplasia.J Pediatr,1975,8(2):310-312.
[17]Nimkam S,New MI.Prenatal diagnosis and treatment of congenital adrenal hyperplasia owing to 21一hydroxylase deficiency.Nat clin Pract Endocrinol Metab,2007,3(5):405-413.
[18]Saada J,Grebilel AG,Aubry MC,et al.Sonography in prenatal diagnosis of congenital adrenal hyperplesia.Prenat Diagn,2004,24(8):627-630.
[19]Technical report:congenital adrenal hyperplasia.Section on Endocrinology and Committee on Genetics.Pediatrics,2000,106(6):1511-1518.
[20]van der Kamp HJ,Oudshoorn CGM,Elvers BH,et al.Cutoff levels of 17-hydroxyprogesterone in neonatal screening for congenital adrenal hyperplasia should be based on gestational age rather than on birth weight.Journal of Clinical Endocrinology and Metabolism,2005,90(7):3904-3907.
[21]Matern D,Tortorelli S,Oglesbee D et al.Reduction of the false-positive rate in newborn screening by implementation of MS/MS-based second-tier tests:the Mayo Clinic experience(2004-2007),Journal of Inherited Metabolic Disease,2007(30):585-592.
[22]Dacou-Voutetakis c,Dracopoulou M.High incidence of molecular defects of the CYP2 1 gene in patients with premature adrenarche.J clin Endocrinol Metab,1999,84:1570-1574.
[23]Momn C,Azziz ZR.2l-Hydmxylase-deficient nonclassic adrenal hyperplasia:the great retender Carlos.Sernin Reprod Med,2003,21:295-299.
[24]KSpeiser Pw,Serrat J,New Ml,et al.Insulin insensitivity in adrenal hyperplasia due to nonclassical steroid 21-hydroxylase deficiency.J Cljn Endocrinol Metab,1992,75:1421-1424.
[25]Sartorato P,Zulian E,Benedini S,et al.Cardiovascular risk factors and ultrasound evaluation of intima media thickness at common carotids,carotid bulbs,femoral and abdominal aorta arteries in patients with classic congenital adrenal hyperplasia due to 21-hydroxylase deficiency.J Clin Endocrinol Metab,2007,92(3):1015-1018.
[26]Azziz R,Hincapie LA,Knochenhauer ES,et al.Screening for 21 hydroxylase deficient nonclassic adrenal hyperplasia among hyperandrogenic women:a prospective study.Fertil Steril,1999,72:915-925.
[27]Miller ML.Molecular biology of steroid hormone synthesis.Endocrinol Rev,1988,9:295-318.
[28]White PC,Mune T,Agarwal AK 1997 11-Hydroxysteroid dehydrogenase and the syndrome of apparent mineralocorticoid excess.Endocr Rev 18:135-156.
[29]Forest MG,David M,Morel Y 1993 Prenatal diagnosis and treatment of 21-hydroxylase deficiency.J S teroid Biochem Mol Biol,45:75-82.
[30]Ghizzoni L,Cesari S,Cremonini G.et al.Prenatal and early postnatal treatment of congenital adrenal hyperplasia.Endocr Dev,2007:11158-11169.
[31]Eugster EA,Dimeglio LA,Wright JC,et al.Height outcome in congenital adrenal hyperplasia caused by 21-hydroxylase deficiency:a meta-analysis.J Pediatr,2001,138(1):26-32.
[32]杜红伟,叶军,韩连书,等.先天性肾上腺皮质增生症合并中枢性性早熟临床分析.临床儿科杂志,2006,24(3):207-209.
[33]Stikkelbroeck NM,van hof-Grootenboer BA,Hermus AR,et al.Growth inhibition by glucocorticoid treatment in salt wasting 21-hydroxylase deficiency:in early infancy and(pre)puberty.J Clin Endocrinol Metab,2003,88(8):3525-3530.
[34]田玉梅,叶军,韩连书,等.不同初治年龄对先天性肾上腺皮质增生症患儿发育的影响.中国实用儿科学杂志,2006,21:272-273.
[35]Karen LS,Maria GV,Ian M,et al.Treatment with growth hormone and luteinizing hormone releasing hormone analog improves final adult height in children with congenital adrenal hyperplasia.The Journal of Clinical Endocrinology&Metabolism,2005,90(6):3318-3325.
[36]Lo JC,Schwitzgebel VM,Trrell JB,et al.Normal female infants born of mothers with classic congenital adrenal hyperplasia due to 21-hydroxylase deficiency.J Clin Endocrinol Metab,1999,84:990-936.
第六节 肾上腺意外瘤
肾上腺是人体重要的内分泌器官,能分泌多种内分泌激素,其中不少激素与血压有关,是继发性高血压的重要病因。肾上腺疾病种类多,病因复杂,发病机制各不相同,对有些疾病的诊断仍有一定困难。近年来由于生化检测技术的不断发展,影像学检查的广泛应用,以及手术例数的逐年增多,对肾上腺疾病的认识有了明显的提高。我院肾上腺手术例数近年来明显增加。我院曾对282例肾上腺手术做了临床和病理分析,对比了术前和术后的诊断,发现术前诊断和术后病理诊断的符合率仅为65.2%,其中大部分为有内分泌功能的肿瘤。说明对一些罕见、无内分泌功能表现的肾上腺疾病的术前诊断仍然是相当困难的。肾上腺意外瘤顾名思义是指因肾上腺以外的疾病或查体时行影像学检查而发现的肾上腺肿物。意外瘤的定义不包括那些为了肿瘤分期而进行影像学检查时所发现的肿瘤。超声、CT和MRI检查技术的广泛应用使我们更多地了解了肾上腺意外瘤,我院分析了98例肾上腺意外瘤的病理结果,大多数为无内分泌功能的肾上腺病变,但恶性病变占到了18.4%,无创伤性影像学检查对肾上腺病变的检出具有重要价值,为早期手术治疗肾上腺恶性病变提供了可能。随着无创、高分辨影像技术的运用,无症状肾上腺占位的发现呈增加趋势。使用超声在健康人群普查为0.1%,在非内分泌疾病主诉的患者为0.42%,CT发现占0.35%~4.4%,肾上腺活检占1.4%~5.5%。根据尸检研究结果,肾上腺占位是人类最普遍的肿瘤,尸检发现,在50岁以上的人肾上腺占位的发生率超过3%。大多数肾上腺肿瘤为良性,但1∶4000为恶性。肾上腺意外瘤大多数为无功能性,约占70%,而经功能评价,其中大约10%有亚临床库欣综合征。临床上处理肾上腺意外瘤的重点是鉴别:良性还是恶性,有无内分泌功能,肾上腺意外瘤的病因、发病率、自然病史,如何临床判定肾上腺意外瘤,如何选择处理肾上腺意外瘤的手术或非手术指征。如何选择适当的手术方法,每种处理方法后如何随访,如何进行进一步研究以指导临床实践?
一、主要病因、病理
肾上腺意外瘤原因可以分为良性和恶性来源的组织,包括腺瘤、嗜铬细胞瘤、髓脂瘤、神经节细胞瘤、肾上腺囊肿、血肿、恶性包括肾上腺皮质腺癌、转移移癌及其他少见原因。对无功能肾上腺占位随访发现,25%出现体积增大,近20%的患者出现激素分泌过多,3cm以上的占位比较小者更易发生高功能的情况,大多数研究都显示小的无功能占位(<3cm)转变为有功能肿瘤的发生率很低。
二、分类
根据临床病史和体格检查。
无病史或体检发现提示肾上腺功能失常或占位,而影像检查发现肾上腺意外瘤。
发现的原因包括非特异性腹痛(29%)、体检(21%)、肝胆区影像学(12%)、腹部手术后随访(11%)、腰痛(7%)、肾脏病变(5%)。有特异影像学特点的肾上腺占位包括髓脂瘤,为肾上腺皮质良性占位,由成熟脂肪细胞和造血组织构成,尽管大多数无内分泌功能,个别报道有高功能。
CT显示低密度,不均质。MRI显示T 1脂肪成分为高信号,在T 2为中等信号。
无症状髓脂瘤保守治疗。肾上腺囊肿:较少见、通常为单侧,女性多见。45%为内皮囊肿,40%为假囊肿,来源于上皮组织和寄生虫性少见。CT检查为光滑、圆形、低密度占位,有薄壁的囊性占位,复杂的囊肿需要活检或手术以除外恶性。肾上腺出血:可为自发性、外伤性或使用抗凝药物后导致,CT显示单侧或双侧、起初为高密度、在随访中可观察到密度的逐渐降低和吸收的占位,MRI显示由于血红蛋白的分解表现为急性至慢性期的演变。急性期:T 1和T 2信号降低。亚急性:T1高信号。慢性期:T1和T2低信号。超声:无回声占位可压迫肾上极。
三、临床表现和诊断
除了病史和影像学检查外,要进行内分泌功能的筛选和评价。因为肾上腺意外瘤可能具有激素活性。常见的有功能腺瘤包括皮质醇增多症、醛固酮增多症、嗜铬细胞瘤等,如果肾上腺功能低下也需要进一步明确诊断。激素测定包括肾上腺皮质和髓质激素的基础值和功能试验。肾上腺意外瘤内分泌功能的最适用和最经济的评价无统一的认识。
根据有无内分泌功能分为高功能性和无功能性。根据肿瘤性质分为良性和恶性。
1.无高分泌功能的肾上腺肿瘤 无高分泌功能的良性肾上腺腺瘤最常见,患病率为1.05%~32%。此类病人临床和实验室检查均无某种激素分泌增多的表现,仅是由于其他原因行腹部CT或其他影像学检查而发现肾上腺肿瘤,其男、女性别无显著差异,30岁以下不常见,但患病率随着年龄增长而增加。
2.高分泌功能的肾上腺肿瘤 高功能的肾上腺肿瘤主要分泌皮质醇、雄激素、雌激素、盐皮质激素或儿茶酚胺。一般从病史、查体、血液生化检查及激素测定可予以直接诊断,如库欣综合征,临床上可有典型的特殊面容和体型,即向心性肥胖、满月脸、水牛背、皮肤紫纹、痤疮、血浆总皮质醇或尿游离皮质醇水平增高。原发性醛固酮增多症可有高血压、低血钾、碱中毒、夜尿增多等症状,激素测定显示高醛固酮、低肾素、正常皮质醇水平,嗜铬细胞瘤病人可有发作性或持续性血压升高,伴有头痛、心悸、多汗三联症及其他代谢增高的表现,实验室检查可有血、尿儿茶酚胺浓度和(或)代谢产物排泄增多;如为分泌雄激素或雌激素的肿瘤,则可有相应的性征异常,由于去氢表雄酮水平是反映肾上腺雄激素是否增多的标志,同样也是肾上腺皮质癌的标志,因此,在所有肾上腺意外瘤病人中均应进行测定。
3.寂静型高分泌功能的肾上腺肿瘤 需要注意的是,在临床表现上无症状的寂静型高分泌功能肾上腺肿瘤,包括皮质醇分泌瘤、醛固酮分泌瘤及嗜铬细胞瘤。有的皮质醇分泌瘤病人的血浆皮质醇水平增高,为亚临床库欣综合征,其自主分泌糖皮质激素,无特异性症状或体征,占肾上腺意外瘤的8%,<1cm的占位不必筛选亚临床库欣综合征,因为高皮质醇很少。亚临床库欣综合征的皮质功能异常包括昼夜节律的消失,午夜一片法中不被1mg地塞米松抑制。24h游离皮质醇(UFC)增高,ACTH降低。亚临床库欣综合征进展至显性库欣综合征者很少。
有的醛固酮分泌瘤病人血压增高但无低血钾,由于限钠可导致钾排泄减少,如给上述血钾正常的原醛症病人每天饮食钠摄入增加10~12g氯化钠,则3~7d后可诱发低钾血症,而减少10%的假阴性结果。而对自发性、容易诱发或由利尿药引起的低血钾病人则应进一步检查有无原发性盐皮质激素分泌增多。对已服用降压药的病人,则应停药一段时间后(螺内酯及雌激素需停药6周,利尿药需停药4周,抗高血压的交感抑制药需停药1~2周)测定血浆醛固酮和肾素活性水平,以避免药物的干扰作用。由于血浆醛固酮水平与肾素活性比值(ARR)的广泛应用,越来越多的早期患者被检出,也因此认识到低钾血症不是原发性醛固酮增多症的常见表现。在分型上,随着对糖皮质激素可治性醛固酮增多症(GRA)发病原因的认识,基因检测成为可能。GRA是由于11β2-羟化酶基因的5′端调控序列和醛固酮合成酶基因的编码序列融合形成嵌合基因,其产物具有醛固酮合成酶活性,但基因表达受ACTH而不受血管紧张素Ⅱ的调控,因此地塞米松治疗有效。开展肾上腺静脉取血测定激素水平,进一步提高了对于醛固酮瘤和特发性醛固酮增多症的鉴别能力。近年来开展的直接检测血浆肾素浓度可以避免肾素活性测定过程中多种因素的干扰,如不需立即冰浴,不受血管紧张素原水平的影响等,初步报道稳定性高,敏感性和特异性分别达84%和100%,有望取代目前的血浆肾素活性测定。尽管ARR的检测缺乏标准化,仍然是筛选原发性醛固酮增多症的实用指标,多数实验室报道的敏感性和特异性均在75%~80%。在多次的ARR超过切点值之后,通过确诊试验和影像学检查加以确诊并进行分型,从而指导治疗,已是目前公认的诊断程序。
尽管嗜铬细胞瘤占肾上腺意外瘤的1.5%~11%,76%的嗜铬细胞瘤为临床静息性,为避免手术或活检时的高血压危象,必须警惕,对意外发现的肾上腺肿瘤首先做有关嗜铬细胞瘤的定性诊断,测定尿儿茶酚胺和(或)VMA进行初筛,必要时可在备好抢救措施的情况下行药物激发或抑制试验,以明确诊断。近年来应用131 I-MIBG(131 I-间碘苄胍)或111 In-octreotide(奥曲肽)核素显像对于嗜铬细胞瘤的定性及定位有较大的诊断价值,并可用于寂静型嗜铬细胞瘤的诊断,对血压及儿茶酚胺测定正常的肾上腺意外瘤,在有条件的情况下,应行全身131 I-MIBG核素显像检查。对肿瘤131 I-MIBG显像阳性者,尽管测定其血、尿儿茶酚胺及血压均正常,但仍按嗜铬细胞瘤服用α受体阻滞药行术前准备,并按嗜铬细胞瘤进行手术。
4.良性与恶性肾上腺腺瘤 在肾上腺意外瘤中,最常见的原因是良性肾上腺腺瘤,其次为恶性肿瘤至肾上腺的转移瘤,如肺、乳腺、肠、胃、肾等部位肿瘤及黑色素瘤、淋巴瘤等的转移瘤。有的病人首先发现的是肾上腺意外转移瘤而不知道肾上腺外的原发病灶,而在尸检中发现8%~38%的肾上腺外恶性肿瘤病人有肾上腺转移瘤。也有文献报道,在确诊的原发于肾上腺外的恶性肿瘤病例中,其肾上腺病变为恶性者占32%~73%,而良性病变占27%~68%。占位的大小和形态有助于区分良、恶性,一般来说,肾上腺肿瘤越大,恶性程度越高。在一组报道中,肾上腺瘤直径≤3cm者,其恶性肿瘤发生率为0%~50%;而直径≥3cm者,其恶性肿瘤发生率为43%~100%;直径≥6cm者,85%的肿瘤为恶性。在增强CT,质地均匀、边界规则,低于10Hu支持良性,MRI的T 2加权像,良性腺瘤的信号强度与肝脏近似。必要时可行超声引导下的细针穿刺活检。术中要预防嗜铬细胞瘤的发作。
原发性肾上腺皮质癌较罕见,每年在意外瘤中发现的病例数为1/160万~1/45万。非激素高分泌的皮质癌一般多见于老年男性病人中,如原发肿瘤直径在5cm以下,手术切除后的长期生存率较高。
四、肾上腺意外瘤的处理
1.手术治疗:适用于高功能和(或)恶性肾上腺肿瘤 对于高功能占位以及临床静止状态的醛固酮瘤和嗜铬细胞瘤,应该首选手术,无临床症状的皮质醇增多症仍在争议,根据有无皮质醇分泌过多、高血压、肥胖、糖尿病或IGT、骨质疏松等的程度决定是否手术治疗。在无功能肾上腺占位,需区分良、恶性,考虑因素包括大小、影像学特点、生长速度、脂肪含量。除了内分泌功能,占位的大小也是决定是否进一步检测的主要标准:肾上腺癌较良性占位大(90%>6cm),通常占位直径>3cm建议手术切除,而影像学提示良性的特征包括体积小、圆滑规则的形状、质地均匀,CT为低密度,增强后低密度有提高,MRI T2加权低信号,脂质含量高。影像学提示恶性的特征为体积大(>5cm)、外形不规则、边界厚,CT示高密度而造影剂后不均匀强化,MRI T 2加权为高信号,脂质含量高、增长快。其他因素包括肿瘤大小,随着体积增大恶性的可能性增加,在4cm切点,恶性/良性比约8∶1,因此建议切除所有>3cm,或>5cm的肿瘤。随着年龄增长肾上腺结节的发生率增加,提示血管的重新分布可能是发病机制,因此,肾上腺占位在老年人比年轻人恶性的危险性低。建议年龄在50岁以下的患者,如肾上腺占位的直径>3cm,则行肾上腺切除。其优点为手术的风险低、避免可能为恶性和亚临床高功能占位的危险、避免长期随访。
手术方式的选择:可以选择传统开放式手术和腹腔镜手术,如经腹、腹膜后。
2.随访 无功能、良性的肾上腺占位应进行随访检查,监测肿瘤大小和是否产生过多激素,25%发生肿瘤增大,20%出现高功能表现,但在<3cm则否,皮质醇增多最常见,在2/3发生显性或亚临床性,长期随访中发生高儿茶酚胺或醛固酮的情况很少,可监测午夜一片法和尿儿茶酚胺结果。
存在的争论在于如何选择最适当的内分泌和形态学检查及进行检查的间隔。通常建议间隔3~4个月或在最初诊断后3个月进行影像学复查,有关肾上腺意外瘤的自然病程和该病变衍变为高功能或恶性的危险性正在进行评价。长期随访肾上腺意外瘤的研究很少,据报道大多数诊断时归类为良性和无功能性的占位随后的内分泌和形态学无变化,但是在一些病例发生肾上腺高功能和(或)占位增大,分别为0~16%和0~11%,但有报道亚临床高皮质醇血症的患者中50%自发性内分泌功能正常。
一些在随访过程中激素水平无变化,而在一些患者,内分泌高功能如高皮质醇血症或高儿茶酚胺可表现为明显临床症状。长期随访中恶变的可能性小,肾上腺占位的增大,或者在对侧肾上腺出现另一个占位则提示恶变,肾上腺意外瘤的长期研究,64例(34~79岁),随访12~120个月(中位数25.5个月),最初的CT在52例为单侧,13例为双侧2.5±0.1cm(1.0~4.0cm)12例有亚临床库欣,41例有轻度激素的异常,11例内分泌功能正常。结果显示,在13例增大≥1cm,18例发生内分泌改变。
3.亚临床库欣综合征 主要特点为肾上腺意外瘤+无特异的体征和症状+肾上腺自主分泌皮质醇。其发病率为79/10万,明显高于经典的库欣综合征。根据皮质醇分泌量的多少,临床表现谱可从轻度皮质醇昼夜节律紊乱到在一侧肾上腺切除后出现对侧肾上腺完全萎缩伴肾上腺功能持久性低下。亚临床库欣综合征缺乏经典的表现,但在肥胖、高血压和2型糖尿病中患病率高。初筛及检查:因明确为肾上腺分泌皮质醇的病变,建议做大剂量短程地塞米松抑制试验(午夜一片法,用3mg,而不是1mg),如>80nmol/L,进一步做试验,包括大剂量地塞米松抑制试验、CRH试验和测定昼夜节律皮质醇水平。UFC价值小,因为在后期才升高。对CRH反应低,ACTH上升少的患者术后常出现肾上腺皮质功能低下,在围术期和术后需做替代治疗。亚临床库欣综合征的实验室诊断:①UFC升高;②血皮质醇升高;③ACTH,皮质醇节律紊乱;④上述3条中有1条+小剂量地塞米松抑制试验异常。亚临床库欣病是否需手术治疗存在争议。目前建议:<50岁,ACTH水平明显低下,近期体重增加,明显肥胖、高血压、糖尿病和骨质疏松者做手术治疗。如无明显症状,ACTH水平正常,>75岁者建议暂不手术。
五、防治及进展
需开展新的研究工作以指导实践,需解决问题包括自然病史,能否确定肾上腺皮质癌的高危人群,需监测多久以排除有发生肾上腺皮质癌和高功能腺瘤的危险,肾上腺意外瘤的最佳随访策略。拟开展的研究工作包括确定不同手术前后的危险和益处的研究,在存在肾上腺意外瘤的患者生理和精神的影响和生活质量的研究,手术切除对慢性疾病,如肥胖、糖尿病、骨质疏松、高血压及心理状态的影响,有关亚临床库欣综合征的前瞻性研究包括诊断试验、相关的发病率及治疗的益处,确定肾上腺癌的敏感和特异的指标。
(李 剑)
参考文献
[1]廖二元,莫朝晖主编.内分泌学.2版.北京:人民卫生出版社,2007.
[2]巴建明,席文琪,陆菊明,等.ACTH非依赖性大结节样肾上腺增生症7例报告并文献复习.解放军医学杂志,2007,32(3):245-247.
[3]Guignat L,Bertherat J.The diagnosis of Cushing′s syndrome:an Endocrine Society Clinical Practice Guideline:commentary from a European perspective.Eur J Endocrinol,2010,163(1):9-13.
[4]Nieman LK,Biller BM,Findling JW,et al.The diagnosis of Cushing′s syndrome:an Endocrine Society Clinical Practice Guideline.J Clin Endocrinol Metab,2008,93(5):1526-1540.
[5]Newell-Price J.Diagnosis/differential diagnosis of Cushing′s syndrome:a review of best practice.Best Pract Res Clin Endocrinol Metab,2009,23 Suppl 1:S5-S14.
[6]Murakami H,Nigawara T,Sakihara S,et al.The frequency of type 2 diabetic patients who meet the endocrinological screening criteria of subclinical Cushing′s disease.Endocr J,2010,57(3):267-272.
[7]Nieman LK,Biller BM,Findling JW,et al.The diagnosis of Cushing′s syndrome:an Endocrine Society Clinical Practice Guideline.J Clin Endocrinol Metab,2008,93(5):1526-1540.
[8]高明,谷伟军,邹效漫,等.小剂量地塞米松抑制试验对库欣综合征诊断价值探讨.军医进修学院学报,2012,33(6):577-580.
[9]Milliez P,Girerd X,Plouin PF,et al.Evidence for an increased rate of cardiovascular events in patients with primary aldosteronism.J Am Coll Cardiol,2005,45(8):1243-1248.
[10]吴景程,汤正义,张炜,等.原发性醛固酮增多症患者心血管和肾功能指标的改变.上海交通大学学报(医学版),2006,26:48-50.
[11]Funder JW,Carey RM,Fardella C,et al.Case detection,diagnosis,and treatment of patients with primary aldosteronism:an endocrine society clinical practice guideline.Clin Endocrinol M etab,2008,93(9):3266-3281.
[12]Schwartz GL,Turner ST.Screening for primary aldosteronism in essential hypertension:diagnostic accuracy of the ratio of plasma aldosterone concentration to plasma renin activity.Clin Chem,2005,51:386-394.
[13]Mulatero P,Stowasser M,Loh KC,et al.Increased diagnosis of primary aldosteronism,including surgically correctable forms,in centers from five continents.J Clin Endocrinol Metab,2004,89(3):1045-1050.
[14]William F,Young Jr.Primary aldosteronism,In Kronenberg ed:Williams Textbook of Endocrinology,11th ed.Saunders,2008.
[15]Mc Mahon GT,Dluhy RG.Glucocorticoid-remediable aldosteronism.Cardiol Rev,2004,12:44-48.
[16]Schirpenbach C.Seiler L,Maser-Gluth C,et al.Confirmatory testing in normalkalaemic primary aldosteronism:the value of the saline infusion test and urinary aldosterone metabolites.Euro J Endocrinol,2006,154:865-873.
[17]Stowasser M,Gordon RD,Primary aldosteronismcareful investigation is essential and rewarding.Mol Cell Endocrinol,2004,217:33-39.
[18]Young WF,Stanson AW,Thompson GB,et al:Role for adrenal venous sampling in primary aldosteronism.Surgery,2004,136:1227-1235.
[19]张炜,汤正义,王卫庆,等.肾上腺静脉采血在原发性醛固酮增多症分型诊断中的应用.中华内分泌代谢杂志,2006,22(5):411-413.
[20]Daunt N.Adrenal vein sampling:how to make it quick,easy,and successful.Radiographics,2005,25(suppl 1):S143-S158.
[21]Assalia A,Gagner M.Laparoscopic adrenalectomy.Br J Surg,2004,91:1259-1274.
[22]Gonzalez R,Smith CD,McClusky 3rd DA,et al.Laparoscopic approach reduces likelihood of perioperative complications in patients undergoing adrenalectomy.Am Surg,2004,70:668-674.
[23]Sica DA.Pharmacokinetics and pharmacodynamics of mineralocorticoid blocking agents and their effects on potassium homeostasis.Heart Fail Rev,2005,10:23-29.
[24]Stowasser M,Sharman J,Leano R,et al.Evidence for abnormal left ventricular structure and function in normotensive individuals with familial hyperaldosteronism type I.J Clin Endocrinol Metab,2005,90:5070-5076.
[25]Katayama Y,Takata N,Tamura T,et al.A case of primary aldosteronism due to unilateral adrenal hyperplasia.Hypertens Res,2005,28:379-384.
[26]程时武,陆菊明.嗜铬细胞瘤的诊疗进展.临床内科杂志,2006,23:160-163.
[27]Nieman LK.Approach to the patient with an adrenal incidentaloma.J Clin Endocrinol Metab,2010,95:28.4106-4113.
[28]Waguespack SG,Rich T,Grubbs E,et al.A current review of the etiology,diagnosis,and treatment of pediatric pheochromocytoma and paraganglioma.J Clin Endocrinol Metab,2010,95:2023-2037.
[29]王养民,赵志强,王楠,等.异位嗜铬细胞瘤的诊断和治疗.现代泌尿外科杂志,2010,15:96-98.
[30]Ilias I,Pacak K.Diagnosis,localization and treatment of pheochromocytoma in MEN 2 syndrome.Endocr Regul,2009,43:89-93.
[31]席文琪,杨国庆,母义明,等.149例嗜铬细胞瘤回顾性分析.内蒙古医学杂志,2007,39:676-679.
[32]宁光.重视嗜铬细胞瘤临床规范,提高诊治和研究水平.上海医学,2009,32:89.
[33]王卫庆.嗜铬细胞瘤的临床诊治规范进展.上海医学,2009,32:90-91.
[34]张迎强,陈黎波,李方,等.131 I-MIBG显像诊断嗜铬细胞瘤.中国医学影像技术,2009,25:1283-1285.
[35]Grünwald F,Ezziddin S.131I-metaiodobenzylguanidine therapy of neuroblastoma and other neuroendocrine tumors.Semin Nucl Med,2010,40:153-163.
[36]Joynt KE,Moslehi JJ,Baughman KL.Paragangliomas:etiology,presentation,and management.Cardiol Rev,2009,17:159-164.
[37]Havekes B,King K,Lai EW,et al.New imaging approaches to phaeochromocytomas and paragangliomas.Clin Endocrinol(Oxf),2010,72:137-145.
[38]赵艳荣,郭清华,陆菊明,等.肾上腺外的异位嗜铬细胞瘤-颈静脉球瘤1例.中国实用内科杂志,2005,25:630.
[39]苏颋为,祝宇,孙福康,等.甲磺酸多沙唑嗪控释片与酚苄明在嗜铬细胞瘤手术前准备及围术期血压控制效果.上海医学,2009,32:105-107.
[40]袁文祺,王卫庆,宁光.恶性嗜铬细胞瘤的非手术治疗进展.国际内分泌代谢杂志,2008,28:270-272.
[41]宋刚,周利群,蔡林,等.腹腔镜切除5~10cm肾上腺嗜铬细胞瘤的安全性分析.中华外科杂志,2008,46:1245-248.
[42]彭杰,张辉,强万明,等.异位嗜铬细胞瘤26例诊治分析.中华外科杂志,2007,45:1582-1583.
[43]Brown MJ,Grossman AB,Bornstein SR.Pheochromocytoma.Horm Metab Res,2009,41:655-657.
[44]Coleman RE,Stubbs JB,Barrett JA,et al.Radiation dosimetry,pharmacokinetics,and safety of ultratrace Iobenguane 131 I in patients with malignant pheochromocytoma/paraganglioma or metastatic carcinoid.Cancer Biother Radiopharm,2009,24:469-475.
[45]龙清云,周云峰,刘骏方,等.恶性嗜铬细胞瘤术后复发患者的动脉栓塞化疗.中华泌尿外科杂志,2009,30:400.
[46]Golden SH,Robinson KA,Saldanha I,et al.Clinical review:Prevalence and incidence of endocrine and metabolic disorders in the United States:a comprehensive review.J Clin Endocrinol Metab,2009,94:1853-1878.
[47]Bratland E,Husebye ES.Cellular immunity and immunopathology in autoimmune Addison′s disease.Mol Cell Endocrinol,2011,10,336(1-2):180-190.
[48]Betterle C,Morlin L.Autoimmune Addison′s Disease.Endocr Dev,2011,20:161-172.
[49]Connor A,Care S,Taylor J.Addison′s disease presenting with acute kidney injury.Clin Med,2010,10(5):515-516.
[50]Leelarathna L,Breen L,Powrie JK,et al.Co-morbidities,management and clinical outcome of auto-immune Addison′s disease.Endocrine.2010,38(1):113-117.
[51]Van der Kamp HJ,Wit JM.Neonatal screening for congenital adrenal hyperplasia.Eur J Endocrinol,2004,151(suppl3):71-75.
[52]吴志军,朱云霞,陈道桢.无锡地区新生儿先天性肾上腺皮质增生症的发病情况探讨.中国优生与遗传杂志,2006,14(10):72.
[53]Forest MG.Recent advances in the diagnosis and management of congenital adrenal hyperplasia due to 21-hydroxylase deficiency.Hum Reprod Update,2004,10(6):469-485.
[54]Nimkam S,New MI.Prenatal diagnosis and treatment of congenital adrenal hyperplasia owing to 21-hydroxylase deficiency.Nat clin Pract Endocrinol Metab,2007,3(5):405-413.
[55]Saada J,Grebilel AG,Aubry MC,et al.Sonography in prenatal diagnosis of congenital adrenal hyperplesia.Prenat Diagn,2004,24(8):1627-1630.
[56]Van der Kamp HJ,Oudshoorn CGM,Elvers BH,et al.Cutoff levels of 17-hydroxyprogesterone in neonatal screening for congenital adrenal hyperplasia should be based on gestational age rather than on birth weight.Journal of Clinical Endocrinology and Metabolism,2005,90(7):3904-3907.
[57]Matern D,Tortorelli S,Oglesbee D et al.Reduction of the false-positive rate in newborn screening by implementation of MS/MS-based second-tier tests:the Mayo Clinic experience(2004-2007),Journal of Inherited Metabolic Disease,2007(30):585-592.
[58]Sartorato P,Zulian E,Benedini S,et al.Cardiovascular risk factors and ultrasound evaluation of intima media thickness at common carotids,carotid bulbs,femoral and abdominal aorta arteries in patients with classic congenital adrenal hyperplasia due to 21-hydroxylase deficiency.J Clin Endocrinol Metab,2007,92(3):1015-1018.
[59]Ghizzoni L,Cesari S,Cremonini G,et al.Prenatal and early postnatal treatment of congenital adrenal hyperplasia.Endocr Dev,2007:11158-11169.
[60]杜红伟,叶军,韩连书,等.先天性肾上腺皮质增生症合并中枢性性早熟临床分析,临床儿科杂志,2006,24(3):207-209.
[61]田玉梅,叶军,韩连书,等.不同初治年龄对先天性肾上腺皮质增生症患儿发育的影响.中国实用儿科学杂志,2006,21:272-273.
[62]Karen LS,Maria GV,Ian M,et al.Treatment with growth hormone and luteinizing hormone releasing hormone analog improves final adult height in children with congenital adrenal hyperplasia.The Journal of Clinical Endocrinology&Metabolism,2005,90(6):3318-3325.
[63]Young WF Jr.Clinical p ractice1 The incidentally discovered adrenalmass.N Engl J Med,2007,356(6):6012-6101.
[64]Abiven G,Coste J,Groussin L,et al.Clinical and bioclinical features in the prognosis of adrenocortical cancer:poor outcome of cortisol2secreting tumors from a series of 202 consecutive patients.J Clin Endocrinol Metab,2006,91(7):26502-26551.
[65]Szolar DH,Korobkin M,Reittner P,et al.Adrenocortical carcinomas and adrenal pheochromocytomas:mass and enhancement loss evaluation at delayed contrast enhanced CT.Radiology,2005,234(2):4792-4851.
[66]Eisenhofer G,Bornstein SR,Brouwers FM,et al.Malignant pheochromocytoma:current status and initiatives for future progress1 Endocrine Related Cancer,2004,11(3):4232-4361.
[67]Rossi GP,Bernini G,Caliumi C,et al.A prospective study of the prevalence of primary aldosteronism in 1125 hypertensive pateints1 J Am Coll Cardiol,2006,48(11):22932-23001.
[68]Mulatero P,Stowasser M,Loh KC,et al.Increased diagnosis of primary aldosteronism,including surgically correctable forms,in centers from five continents.J Clin Endocrino Metab,2004,89(3):10452-10501.
[69]陶文玉,杨国庆,陆菊明.肾上腺意外瘤69例临床分析,临床内科杂志,2005,42(8):550-551.
[70]胡晓强,李全民,李小凤,等.282例肾上腺病变临床分析,医学临床研究,2007,43(12):2168-2169.
[71]Berland LL,Silverman SG,Gore RM,et al.Managing incidental findings on abdominal CT:white paper of the ACR incidental findings committee.J Am Coll Radiol,2010;77(10):754-773.
[72]Nieman LK.Approach to the patient with an adrenal incidentaloma.J Clin Endocrinol Metab,2010,95(9):4106-4113.
[74]O′Neill CJ,Spence A,Logan B,et al.Adrenal incidentalomas:risk of adrenocortical carcinoma and clinical outcomes.J Surg Oncol,2010,102(5):450-453.
[75]Peppa M,Karamitopoulou E,Nikolopoulos P,et al.Large adrenal oncocytoma with uncertain malignant potential:case report and review of literature.Endocr Pract,2010,16(4):641-645.
[76]Comlekci A,Yener S,Ertilav S,et al.Adrenal incidentaloma,clinical,metabolic follow-up aspects:single centre experience.Endocrine,2010,37(1):40-46.
[77]Chiodini I,Morelli V,Masserini B,et al.Bone mineral density,prevalence of vertebral fractures,and bone quality in patients with adrenal incidentalomas with and without subclinical hypercortisolism:an I-talian multicenter study.J Clin Endocrinol Metab,2009,94(9):3207-3214.
[78]Yener S,Ertilav S,Secil M,et al.Prospective evaluation of tumor size and hormonal status in adrenal incidentalomas.J Endocrinol Invest,2010,33(1):32-36.
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














