第十章 弥散性血管内凝血(DIC)
实验目的
初步掌握复制家兔急性DIC动物模型的方法,讨论急性DIC的发病机制。
实验原理
耳缘静脉注入兔脑粉浸液,通过激活外源性凝血系统,导致DIC发生。
实验对象及相关用品
1.实验对象
家兔,雌雄不限,体重2.0~2.5kg。
2.实验相关用品
动物实验手术器械,试管架,试管,刻度离心管,离心机,BL-420生物机能实验系统,BI-2000微循环图像分析系统,3%戊巴比妥钠溶液,4%兔脑粉生理盐水浸液,3.8%枸橼酸钠溶液。
实验分组
对照组和实验组。
观测指标
(1)血小板计数:急性DIC时,血小板的消耗大于生成。
(2)凝血相关指标:①活化部分凝血活酶时间(APTT),凡是参与凝血活酶生成的任何因子缺陷时,APTT延长,如Ⅷ因子、Ⅸ因子、Ⅺ因子、Ⅻ因子缺乏,也见于Ⅴ因子、Ⅹ因子、凝血酶原、纤维蛋白原缺乏;②凝血酶原时间(PT),急性DIC时,PT时间延长;③血浆鱼精蛋白副凝实验(3P试验),在继发性FDP大分子碎片存在的DIC中,本实验阳性;④血浆纤维蛋白原含量,急性DIC时,纤维蛋白原明显减少。
(3)肠系膜微循环:急性DIC时,可见血细胞及血小板形态、血流速度变化,血栓形成,血浆外渗现象等。
实验步骤
1.实验组
(1)家兔称重,仰卧位固定在兔台上。
(2)3%戊巴比妥钠溶液(1mL/kg)经耳缘静脉注射行全身麻醉。
(3)剪去颈部手术视野的被毛,常规暴露气管,插气管插管,保持呼吸通畅;分离一侧颈总动脉,插入硅胶管,作取血样本用;分离另一侧颈总动脉,行颈总动脉插管并连于压力换能器,在BL-420生物机能实验系统上描记血压。
(4)在右侧腹直肌旁做长5~8cm的纵向中腹部切口,钝性分离肌肉,打开腹腔后,推开大网膜,找出一段游离度较大的小肠肠袢,从腹腔中拉出,放置在BI-2000微循环图像分析系统连接的微循环恒温灌流槽内,使肠系膜均匀平铺在有机玻璃观察环上,压上固定板,调整灌流液液面,使其刚刚覆盖过肠系膜。
(5)用BI-2000微循环图像分析系统于显微镜下观察肠系膜的正常微循环。记录正常状态下的血压。经颈动脉取血,将最先流出的数滴血弃之,然后于盛有3.8%枸橼酸钠溶液(0.5mL)的离心管中放入兔血4.5mL,上下颠倒混匀,请勿震荡。先取20μL供血小板计数用,其余血液离心15min(3000r/min),取血浆检测凝血相关指标。
(6)取4%兔脑粉生理盐水浸液,按2.0mL/kg计算,将总量用生理盐水稀释至30mL,由耳缘静脉注射(可用头皮静脉针),在15min内注完。其注入速度为:第一个5min以1.0mL/min注入;第二个5min以2.0mL/min注入;最后5min以3.0 mL/min注入。
(7)用BI-2000微循环图像分析系统于显微镜10×物镜下动态观察肠系膜的微循环;于40×物镜下观察微循环中血细胞及血小板形态、血流速度、血栓形成、血浆外渗现象等。
(8)分别于注射兔脑粉浸液开始后15min、45min记录血压变化,并由颈总动脉采集血样,检测血小板计数和凝血相关指标。
(9)实验结束后处死动物,打开胸腔、腹腔,观察各脏器的变化。
2.对照组
将耳缘静脉注入兔脑粉浸液改为注入等量生理盐水,注入途径、总量、速率、观察指标等均与实验组相同。
注意事项
(1)本实验中,兔脑粉浸液的制备及注射速度对实验成败影响较大。①兔脑粉浸液的制备:称取兔脑粉400mg,其活力(PT)不得大于12s,加入生理盐水10mL,充分搅匀后放入37℃恒温水浴内孵育60min,每隔15min充分搅拌一次,然后离心(1000r/min)5min,取上清液过滤后,供静脉注射用。或将兔脑凝血活酶冻干制剂稀释后静脉注入。②注入兔脑粉浸液的原则是先慢后快,切忌过快,否则极易造成动物猝死。注射过程中密切观察动物呼吸情况,必要时酌情调整注射速度。
(2)每次采集完血样用生理盐水冲洗动脉插管(5mL注射器)以防管内凝血。注意不能使用抗凝剂,以免影响实验结果。
(3)本实验中所用试剂、血浆样本及吸管较多,同一吸管只能吸取某一试剂或血浆样本,避免交叉使用。
(4)如室温低于20℃,实验用血浆应在37℃恒温水浴中保温1min。
实验报告要点
(1)实验目的明确,实验步骤清晰。
(2)实验结果记录完整、准确。
(3)围绕实验结果展开讨论。
(4)总结实验中的经验、教训。
思考题
1.试分析本实验动物发生DIC的可能机制。
2.综合分析实验结果,你所复制的模型属于DIC的哪个期?并说明原因。
附:
1.血小板计数及凝血相关指标的检测方法
(1)血小板计数:吸取血小板稀释液0.38mL于一试管内,用血红蛋白吸管取血20μL立即加入血小板稀释液中,充分混匀后,用滴管将上述混悬液1小滴滴入计算室内,静置15min,用高倍镜计数。数5个中方格内的血小板数×109/L。
(2)活化部分凝血活酶时间(APTT)。
①原理:以脑磷脂代替血小板磷脂,白陶土为活化剂,使因子Ⅹ、Ⅺ充分活化,与血浆混合,温育一定时间使凝血因子活化,然后加入氯化钙测定血浆凝结时间。
②方法:将被检血浆0.2mL加入小试管内,置37℃水浴中,再加入白陶土部分凝血活酶试剂(K试液)0.2mL,混匀,孵育3min;加入0.025mol/L氯化钙溶液0.2mL,同时开动秒表,30s后将试管从水浴中取出,倾斜试管,直至液体停止流动(呈胶冻状)或出现白色粗颗粒,即为凝固终点。重复操作2~3次,取平均值。正常参考值约30s。
(3)凝血酶原时间(PT)。
①原理:血浆中加入过量的组织凝血活酶与适量的钙离子,观察其凝固时间,据此可以估计血浆中凝血酶原复合物(因子Ⅱ、Ⅴ、Ⅶ、Ⅹ)的水平。它是外源性凝血系统基本的筛选实验。
②方法:取被检血浆0.1mL加入小试管内,置37℃水浴中,再加入P试液0.2mL,开动秒表,观察方法同上,测定凝固时间。重复操作2~3次,取平均值。正常参考值为6~8s。
(4)血浆鱼精蛋白副凝实验(3P试验)。
①原理:鱼精蛋白可分离FDP与纤维蛋白单体结合的可溶性复合物使纤维蛋白单体聚合沉淀,呈现纤维丝条。
②方法:被检血浆0.45mL置于小试管内,37℃水浴3min,再向小试管内加入1%鱼精蛋白液0.5mL,37℃水浴15min或室温30min,将小试管轻轻摇动,置明亮的光源下,观察有无不溶解物质,必要时可用放大镜观察。有白色纤维或凝块为阳性,均匀浑浊、无白色纤维者为阴性。
(5)血浆纤维蛋白原含量(热沉淀比浊法)。
①原理:血浆经pH值为6.3的缓冲液稀释后置于56℃水浴15min,纤维蛋白原被沉淀而呈现浊度,而其他蛋白质仍处于溶解状态,于405nm波长比浊测定,在一定范围内,纤维蛋白原(包括无功能的纤维蛋白原、纤维蛋白原降解产物)含量与浊度成正比。
②方法:取3支试管,分别为空白管、实验管、对照管,按表10-1操作。
表10-1 血浆纤维蛋白原含量的测定
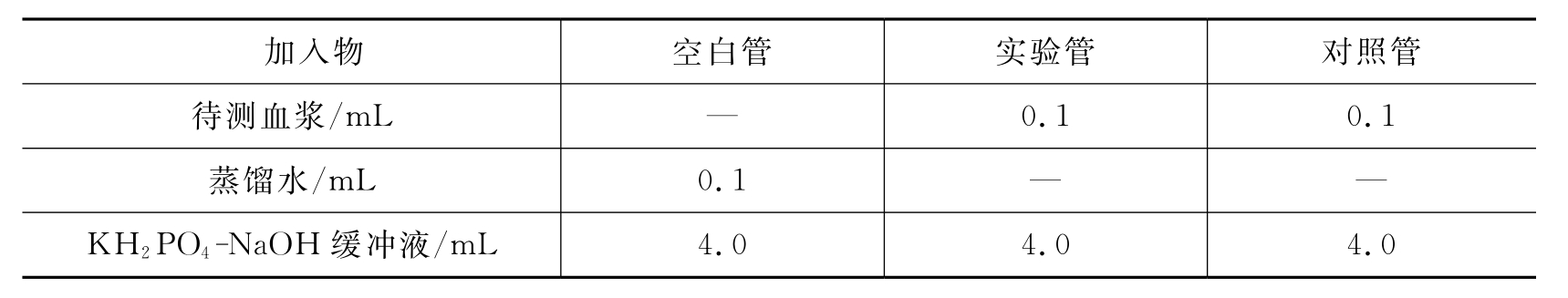
将各试管内液体旋转混匀。用722分光光度计(波长405nm),1cm比色杯,以空白管调零,读取第一次吸光度值为A1,然后3管同置56℃水浴15min,冷却至室温,读取第二次吸光度值为A2。
A2-A1=ΔA,查校正曲线得结果。
校正曲线的制作:将已知定量血浆配成1.0g/L、2.0g/L、4.0g/L、6.0g/L、8.0g/L溶液,按上述操作,求ΔA,作标准曲线。在8.0g/L范围内呈线性。
2.试剂配制
(1)K试液:实验前将2%白陶土生理盐水悬液1份与兔脑磷脂悬液等量混合,作KPTT测定用。
(2)P试液:实验前称取200mg兔脑粉,加入5mL生理盐水,充分混匀后于37℃恒温水浴1h。在此过程中,间歇用玻棒搅拌3~4次,并颠倒混匀,然后离心(1000r/min)5min,吸取上清液,加入等量的0.025mol/L氯化钙溶液,用前摇匀,作PT测定用。
(3)KH2PO4-NaOH缓冲液(pH值6.3):0.1mol/L KH2PO450mL加0.1mol/L NaOH 10.6mL混合,加蒸馏水至100mL。
(吉林大学白求恩医学院 李扬)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















