第四节 支架的选择及应用技巧
冠状动脉支架自应用于临床以来,发展很快,应用越来越多,目前已成为心肌血运重建的主要手段。在许多医院的心导管室,经皮冠状动脉介入治疗80%的病例植入冠状动脉支架。同时,在国外外科手术搭桥的病例数也已呈逐年下降趋势。冠状动脉支架广泛应用的原因为:①植入支架后造影的影像非常好,急性期结果好;②由于支架能够治疗由球囊扩张引起的急性或濒临闭塞,使介入治疗的安全性明显提高;③支架可以降低再狭窄率,改善患者的长期预后,近几年,药物支架的临床应用已经充分证明了这一点;④植入支架容易操作;⑤支架的应用可以减少操作时间;⑥对于复杂病变,球囊扩张结果往往不理想,植入支架可以得到满意的结果。这些广泛的应用归功于支架技术的完善、对植入支架血管壁损伤的深入理解以及辅助药物治疗的进步。
一、支架的分类
目前临床上有多种支架,每种支架在金属成分、支架丝的设计、支架长度、输送和释放系统、血管覆盖程度等方面各有不同。支架有很多种分类方法,一般可根据以下标准分类:①植入方式:自膨胀式和球囊膨胀式。目前临床上以球囊膨胀支架最为常用,颈动脉介入多用自膨胀支架;②支架设计:网状型、缠绕型、管状型及环型。现在临床上以管状支架最为常用,网状和缠绕型支架因再狭窄率较高已被淘汰;③网眼大小:闭环、开环;④支架材料:316L不锈钢支架、镍支架、钽支架、钴铬支架和高分子聚合物做成的生物降解性支架。目前临床上以316L不锈钢支架最为常用,生物降解性支架可能会代表支架的未来,但从现在的研究看还存在很多问题,如高分子聚合物支架的支撑力、降解速度以及降解的不均一性导致许多支架碎片形成等问题;⑤特殊支架:涂层、带膜、生物降解支架、分叉病变支架等;⑥药物洗脱支架和非药物洗脱支架:国际多中心试验充分肯定有效的药物支架有两种,一种为强生公司生产的雷帕霉素药物洗脱支架,另一种是波科生产的紫杉醇药物洗脱支架。
现在认为理想的支架应具备以下特征:①灵活;②示踪性好;③头端小;④不透X光;⑤抗血栓;⑥生物相容性好;⑦扩张性能可靠;⑧支撑力好;⑨良好的覆盖病变;⑩表面积小;輥輯訛符合流体力学。评价支架性能的指标见表3-3。目前应用的支架中,没有一种支架能够完全满足上述所有特点,每种支架都有各自的特性,熟悉各种支架的特性是介入治疗成功的保证。所有支架应用的目的都是为了减少并发症、改善患者的近远期预后。临床常用的支架设计特点(一)、(二)分别见表3-4、表3-5。
表3-3评价支架性能的指标

表3-4支架设计特点(一)

续表

BE=球囊膨胀;BSC=Boston-SciMed;NA=无数据;SS=不锈钢。
表3-5支架设计特点(二)

NA=无数据;NR=元数据。
1. PS及Crown、Minicrown支架PS153支架为激光蚀刻的316L不锈钢管状支架。该支架为第一个显示出较单纯球囊PTCA能降低再狭窄的支架,其经典的临床试验是BENESTENT和STRESS试验,并成为评价以后所有支架的必然对照试验。其管状支架设计使其有很强的支撑力,金属覆盖率高,在支架释放时能够均匀扩张,弹性回缩小。但其柔软性很差,型号单一,高压力扩张后容易变形。该类支架已被新一代支架所取代。Crowm、Minicrown支架均在PS支架基础上在柔软性和材料厚度方面做了改进,Minicrown适合于小血管的植入。
2. GR支架GR是Cook公司生产的第一个被用来治疗单纯球囊PTCA后血管闭塞的支架。该支架为一根0.006in316L不锈钢丝缠绕而成。第一代GR支架的主要缺点为柔软性差、profile大、需要8F或9F指引导管、显影性差、定位困难。第二代的GR支架两端增加的金制的标记,可保证准确定位,轴向缩短较第一代明显减少。但因发现该类支架的再狭窄发生率较高而限制了其临床应用。
3. Multilink、Duet和Tristar支架Multilink支架是由激光蚀刻的不锈钢管状支架。具有很好的柔软性、辐射性支撑力及很小的纵向缩短(<5%)。在ASCENT试验中,再狭窄率较低(16%)。Duet支架更加柔软,显影性更佳,其传输球囊是小外径、耐高压球囊。试验表明,可降低较大血管(>2.75mm)的再狭窄的发生率。但由于球囊在支架两端各长出1.8mm,球囊扩张过快可出现“狗骨头”情况,且容易产生支架边缘的撕裂和夹层。TriStar支架球囊突出的长度很小(0.4mm),应用了短过渡边缘保护技术、支架挤压特殊技术及三折技术,可很好地解决Duet支架以上的问题。
4. AVE环状支架MicrostentⅡ为8个Z字形的支架丝通过4个冠连接的球囊扩张支架。其最大的优点是其柔软性强,可通过重度弯曲病变及近端支架,可视性高,有利于口部病变及分叉病变的精确定位。MicrostentⅡ的更新换代产品为GFX和GFX-2以及近期的S670和S660,通过减小这些支架亚单位的长度来加强其通过弯曲病变的能力。S670和S660广泛用于小血管和重度弯曲病变。S660支架由6个冠的很小的亚单位通过激光焊接而成,这种模结构的环形支架比激光切割的管状支架表面更光滑,这些特点使该支架适合于小血管、弯曲病变。
5. Driver支架Driver支架是Medtronic公司生产的钴合金支架。钴合金比常用的不锈钢支撑力更强,显影性更好。其为10个冠的环状支架,每个单位只有1mm,支架丝细(0.0036″),profile小,保证其良好的输送性。支架两端球囊突出部分很少,减少了对血管的损伤。
6. NIR支架NIR支架是由316L不锈钢蚀刻而成的管状支架。其由7~8个闭环组成,通透性较好,也有较强的支撑力。NIR支架与PS-153支架的比较研究表明,两种支架的早期和晚期临床效果相似。该支架的缺点是可视性差、闭环设计容易影响边支以及球囊释放压力较低。新一代的NIR-ON-SOX支架设计了高压释放球囊,应用了袖套技术,即在支架远段有0.75mm的球囊反折覆盖,以防止支架两端对血管损伤造成支架植入后的血栓形成。而NIR Royal支架两端通过镀金增加了其可视性。
7. Liberté支架Liberté支架是Boston公司基于Maverick2TM导管及TrakTipTM技术生产的新型支架,profile很小(0.041″),支架丝较细(0.0038″),故输送性很好。Bi-axial支架设计,既保证支架的柔软性,同时又保证足够的支撑力。独特的网眼结构在保证支撑力的同时,又可尽量避免边支受累。Boston公司正在研发以该支架为载体的紫杉醇药物洗脱支架。
8. BX Velocity支架BX Velocity支架为闭环设计不锈钢管状支架,各环间S形连接增加了支架的柔软性、侧孔的通透性,传送球囊为整杆、高推送性、抗折的Worldpass球囊。其特点是柔软性好,容易输送。
9. MULTI-LINK ZETA、ULTRA、PIXEL支架MULTI-LINK ZETA支架是由Guidant公司生产的316L不锈钢管状支架,在既往的MULTI-LINK PENTA®支架基础上,应用了新的、更柔软灵活的QUICKTRACKTM ST球囊,前端的锥形段、较短,保证其较好的输送性和最小的支架两端血管损伤。而ULTRA支架是由在经过临床验证过的ACS MULTI-LINK支架基础上专门针对大血管设计的。该支架金属覆盖率高,辐射性支撑力强,同时其两端的锥形段也较短,保证球囊最小的突出支架外,减少对支架两端血管的损伤。PIXEL支架是针对小血管设计的。其为5个冠的波纹状环形设计,支撑力较好,支架丝很细(0.0039)″,金属含量低,profile很小,表面亲水涂层超滑,该支架可在5F指引导管内输送。支架回缩小,采用新的球囊保护技术,球囊突出支架很小,平均只有0.37mm。支架最大的特点是柔软性好,输送性强。
10. MULTI-LINK VISION、MINI VISION支架MULTI-LINK VISION(图3-13)和MULTI-LINKV M INI V ISION(图3-14)支架是Guidant公司生产的两款钴铬合金支架。这种支架是把钴铬合金用激光切割而成,钴铬合金比常用的不锈钢支撑力更强,显影性更好,故该支架的profile小,金属丝细(0.0032)″,比以往的不锈钢支架薄37%,输送性强,同时金属含量少。现有的研究认为,金属含量越少,再狭窄的发生率越低。针对该VISION支架的注册研究发现,其6个月的TLR只有1.9%。而M INI VISION支架专门针对小血管设计,其比传统支架减少金属含量45%。

图3-13 MULTI-LINK VISION支架

图3-14 MULTI-LINK M INI VISION支架
11. ARTHOSInert、ARTHOSPico支架ARTHOSInert支架(图3-15)是德国Amg公司生产的一种特殊工艺支架。因为研究发现镍、铬、钼等重金属合金支架植入血管内后会释放离子,这是引起炎症反应和过敏反应的原因,会引起内膜增生,导致再狭窄。ARTHOSInert支架是专门为解决这个问题而设计的,通过一种表面惰性技术防止支架金属释放离子。ARTHOSPico支架是Amg公司生产的专门针对小血管设计的钴铬合金支架。该支架同样具有钴铬支架的金属含量少、柔软性高、输送性强的特点。

图3-15 ARTHOSInert支架
12. DLC支架DLC支架(图3-16)是BioDiamond公司生产的特殊涂层支架。它的设计原理与ARTHOSInert相同,该支架通过特殊工艺在不锈钢支架表面镶嵌上钻石样碳涂层,可大大减少内膜增生和再狭窄的发生。

图3-16 DLC支架
13. CoStar支架CoStar支架(图3-17)是Conor Medsystem公司生产的药物洗脱支架的载体。该支架在支架丝上镶嵌上槽,可携带药物。这种设计就不必用现有药物洗脱支架的多聚物涂层(这些涂层作为异物在血管内膜下可引起炎症反应,导致内膜组织增生)。

图3-17 CoStar支架
14. ChromoFlex、S-Flex、S-Flex、Micro、Stellium Drug-Eluting支架这4种支架是南非DISA Vascu lar(Pty)公司生产的钴铬合金支架、不锈钢金属支架、为小血管设计的不锈钢金属支架及钴铬合金支架为载体的紫杉醇药物洗脱支架。
15. MULTI-LINK FRONTIERTM支架是Guidant公司生产的专门针对分叉病变设计的(图3-18)。支架基于传统MUTI-LINK支架设计,有两个导丝、两个球囊。180天的MACE为17.1%,比传统技术减少一半。
二、支架的特性
1.支架的网眼(图3-19)分为开环性网孔、闭环性网孔和中间型网孔。开环性网孔的设计覆盖管壁的面积相对较少,支架的柔顺性较好,较容易通过支架的网孔进到病变处的分支。以美敦力公司生产的S670为代表,其网孔可达12mm2。但有时开放性网孔会造成斑块凸入管腔。而闭合性网孔的设计覆盖管腔的面积相对较大,支架的柔顺性较差,特别适合斑块负荷重的病变,有时不容易通过支架的网孔进入到病变处的分支内。以强生公司的Bx velocity或Bx sonic为代表,其网孔可达3.3mm2。临床上常用的ACS公司生产的Tetra属于半开放网孔设计,其网孔可达4.06mm2。

图3-18 MULTI-LINK FRONTIER支架

图3-19 支架的网眼
2.支架丝的厚度(图3-20)支架丝的厚度越小,支架总的金属含量越少。现认为支架的金属含量与再狭窄的发生率有关,金属含量越高,再狭窄发生率越高。但金属含量少,会使支架的支撑力及显影性受到损失,故在保证支架的支撑力及显影性的同时,尽量减少支架丝的厚度是支架设计的目标。近期出现的非不锈钢金属支架采用了硬度更强的合金,使得支架丝更细,支架的金属含量降低,如Guidant公司的钴铬合金支架Vision、MiniVision,支架丝的厚度为0.032″,Meditronic AVE生产的铬合金的Driver支架金属丝厚度为0.036″。

图3-20 支架的厚度
3.支架的金属覆盖率(图3-21)支架的金属覆盖率是支架植入的急性期和长期预后的重要影响因素。不充分的金属覆盖率可能导致斑块通过网眼向管腔凸出,引起血栓形成和再狭窄的发生。而过度的金属覆盖使进入分支困难,减少支架的柔顺性、输送性,而且再狭窄率增加。

图3-21 支架的金属覆盖率
4.支架可视性(图3-22)根据支架在X线下的可视程度分为高、中和低可视性。支架的可视性与支架成分和支架丝厚度有关。316L不锈钢支架比镍支架的可视性强,而近期出现的钴铬合金支架比316L不锈钢支架的可视性强。有些支架尽管可视性较差,但在生产过程增加了标志,如Tenax-XR、Bestent 2、Carbostent,这样有助于支架在X线下定位。支架的可视性对于开口部病变和串联重叠放置支架时特别重要。

图3-22 支架的可视性
5.支架长度的缩短率(图3-23)是指支架膨胀后的长度占原长度的比率,缩短越多,则该比值越大。早期的支架长度缩短率较大,不利于支架的准确定位;新近设计的支架尽量使之减少到最小。熟悉支架长度缩短率有助于准确选择合适长度的支架。
6.支架直径的回缩率(图3-24)即支架直径回缩值(膨胀后的直径与实际支架直径的差值)与膨胀后直径的比值。支架直径回缩率是衡量支架抵抗血管壁弹性回缩能力的重要指标。支架自身的特点和支架丝的厚度是影响支架直径回缩率的关键因素。因为开口部病变的弹性回缩力强,支架回缩率小的支架特别适合位于开口部病变。

图3-23 支架长度的缩短率

图3-24 支架直径的回缩率
7.球囊突出支架两端的长度(图3-25)即目前使用的球囊预装支架中球囊两端长出支架的部分。新近生产的支架尽量减少球囊突出的长度,目的是在保证支架两端的充分膨胀的同时,尽量减少球囊对支架两端血管的损伤,减少撕裂、夹层的出现。
8.通过支架网眼进入分支(图3-26)不同的支架设计支架网眼的大小不同,了解支架网眼大小在分叉病变选择支架时有一定意义,选择网眼较大的支架有利于导丝通过网眼进入边支。
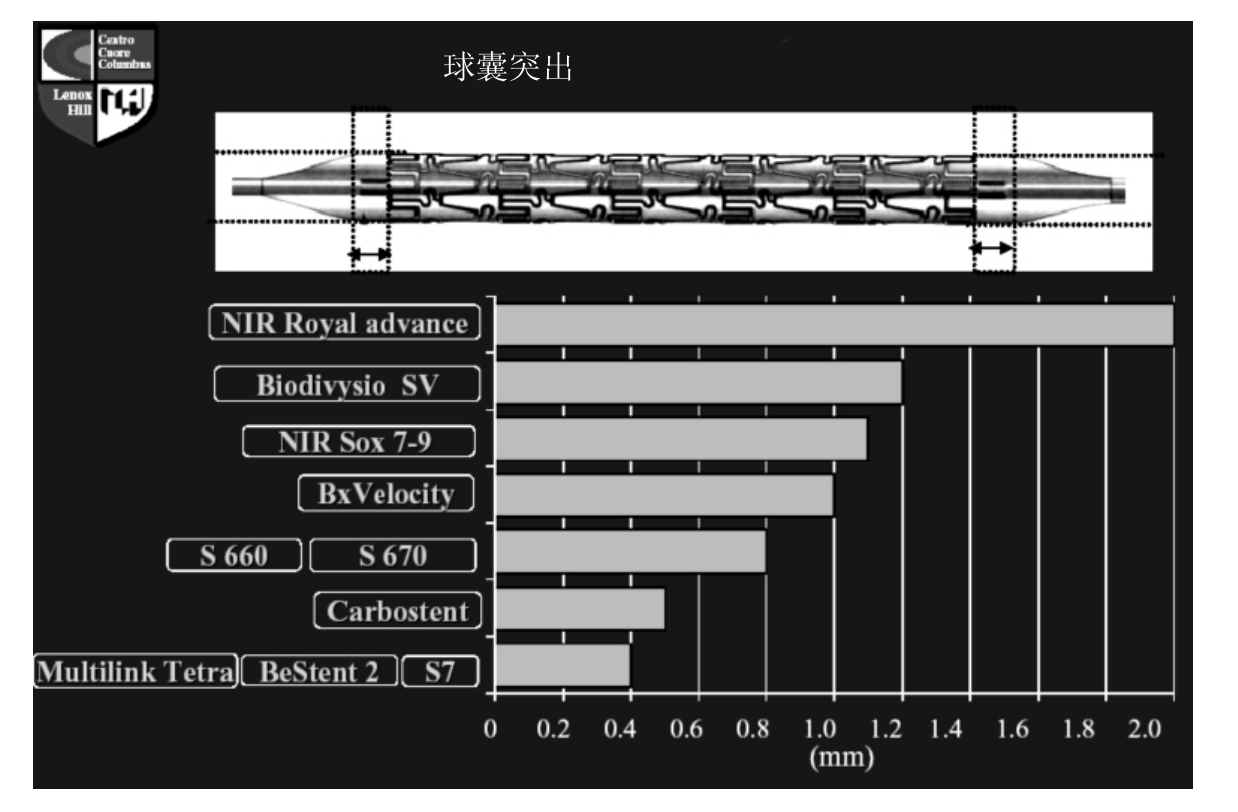
图3-25 球囊突出支架两端的长度
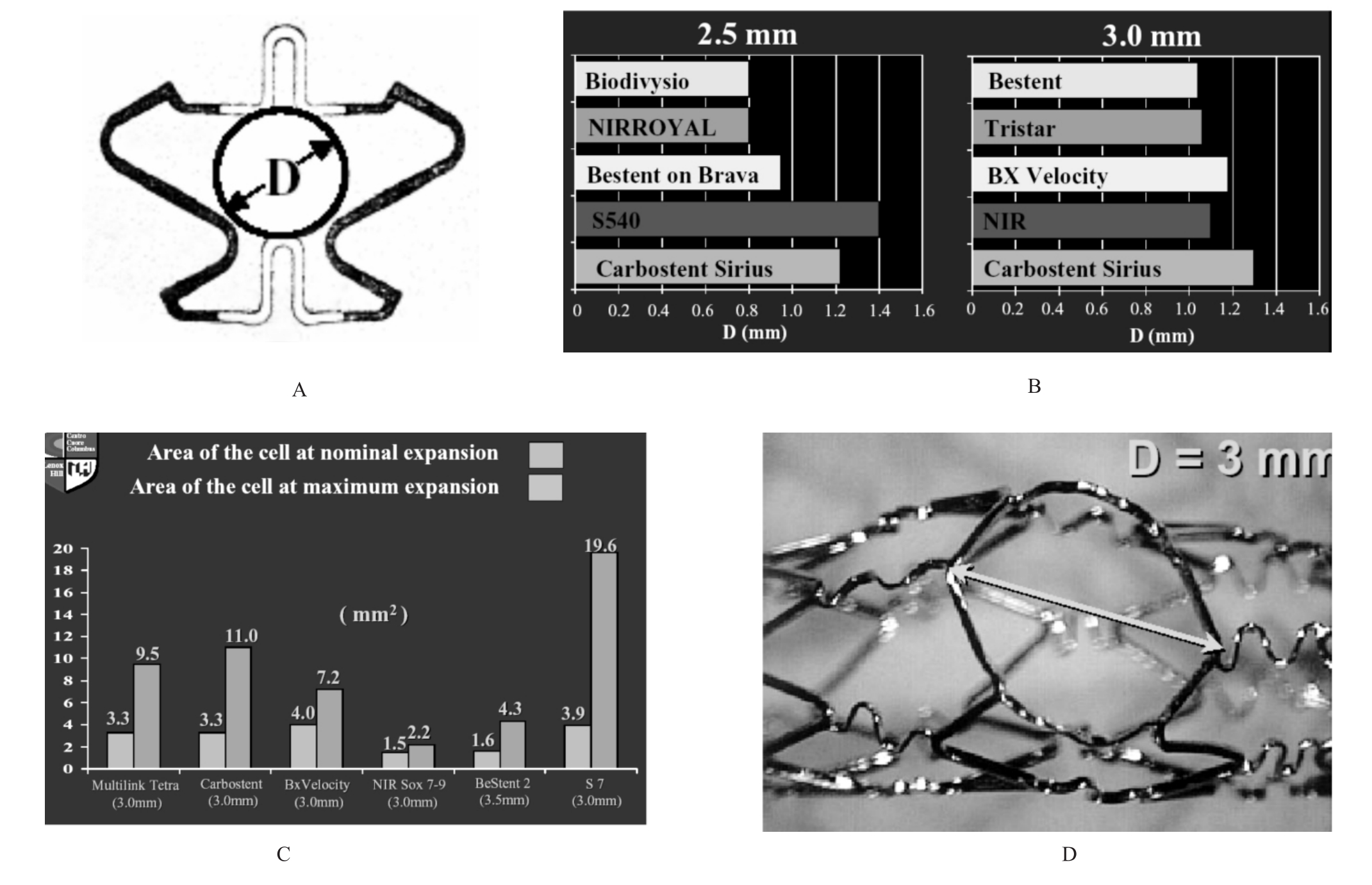
图3-26 支架网眼
三、支架之间的比较
PS153被认为是支架与支架之间进行等效性研究的金标准,这方面的临床试验见表3-6。不同的支架的确存在差异。动物实验表明,支架表面物质和几何形状是影响内膜增生程度和血栓形成的重要因素,并且血管壁损伤的程度和随之发生的内膜增生也依赖于支架的设计。人冠状动脉植入支架研究表明,只有植入管状支架能够降低再狭窄,缠绕型支架与单纯球囊扩张的再狭窄率相似。金属的成分和支架表面的特性是影响支架性能的重要因素。此外,支架的输送方式也影响再狭窄,如血管内植入过大的wallstent也是以后发生再狭窄的很强的预测因子。
表3-6 支架之间比较的临床试验

续表

注:*球囊PTCA加bailout支架植入,覭p<0.005。
1.支架不同设计对预后的影响与PS支架相比,植入Multilink和Micro StentⅡ支架的再狭窄率相似,但GRⅡ支架的再狭窄率明显增加。对于临床远期(9个月)预后的影响与上述相似,即植入GRⅡ支架的效果最差,因此目前缠绕形支架已经被临床淘汰。即便均为管状支架,由于支架结构不同,临床的再狭窄率和预后也不尽相同。2000年,德国学者所进行的一项随机研究证明了这一点,他们选择了5种支架进行了6个月的造影随访,重点观察不同结构设计的支架对造影结果和临床预后的影响。结果表明,Multilink支架的再狭窄率最低,为25.3%;Nir和Inflow支架的再狭窄率最高,分别为35.9%和35.0%,因此,认为不同的支架设计影响支架的再狭窄率。2001年,日本报道了100例患者随机植入Multilink支架和GFX支架比较的结果,术前和术后造影和血管内超声的各项指标无差别,但随访(平均4.2个月)发现,前者的最小管腔直径明显增加(2.46mm vs2.08mm,p<0.05),支架内最大面积减少(1.8mm2 vs 2.9mm2,p<0.01),再狭窄率也明显降低(4% vs26%,p=0.003)。多因素回归分析表明,与再狭窄显著相关的唯一预测因子为支架类型,说明支架的结构可能会影响患者的预后。
2.支架丝的厚度对预后的影响动物实验发现,两种不同支架丝厚度的支架(0.15mm和0.09mm)的结果不同,支架丝越厚,内膜增生越明显。为此,在ISAR-STEREO研究中比较了相同设计但不同支架丝的厚度对患者临床预后的影响,对651例患者随机植入Multilink(支架丝厚度为0.05mm)和Duet(支架丝厚度为0.10mm)。结果表明,前者的晚期管腔丢失减少(0.94mm vs1.17mm,p=0.001),再狭窄率降低(15% vs25.8%,p=0.003),靶血管血运重建率降低(8.6% vs13.8%,p=0.003),但一年总的死亡和心肌梗死发生率两组间无差别。又在ISAR-STEREO-2研究中,比较了不同的支架设计和不同的支架丝厚度对临床预后的影响,试验入选611例自身冠状动脉病变患者,随机分为Multilink组(支架丝厚度为0.05mm)和Bx velocity组(支架丝厚度为0.14mm),发现尽管急性期获得无显著差别,但晚期管腔丢失前者明显减少(0.93mm vs1.19mm,p<0.001),而且再狭窄率也明显降低(17.9% vs31.4%,p<0.001),临床上靶血管重建率较低(12.3% vs21.9%,p=0.002)。同样,两组间无心肌梗死的一年生存率无差别。以上研究说明,支架丝的厚度能明显影响患者的临床预后,不但支架丝较细的支架与再狭窄明显降低有关,而且相同设计的不同支架丝的厚度与不同设计不同支架丝厚度的临床结果相似。目前,各厂家在支架的设计上采取不降低支架支撑力的前提下,尽量降低支架丝的厚度,这样就诞生了新一代的支架——含钴支架。其中以ACS公司的Vision支架和AVE公司的Driver支架为代表,这两种支架的支架丝厚度明显减少,但支撑力没有下降,明显地改善了支架的输送性,更适合于各种类型的复杂病变。
3.镀金支架的研究金是一种很好的生物相容性材料,镀金可减少血栓形成,并且增加支架在X线下的可视性。有一项随机前瞻性研究(NUGGET),比较了镀金的Nir支架和无镀金的Nir支架,6个月的造影随访表明,镀金Nir支架的再狭窄率高(37.5% vs20.6%,p<0.001)。晚期管腔丢失较高(1.04mm vs0.68mm,p<0.001);尽管两组总的主要心脏不良事件无显著差别,但镀金支架组进行靶血管再次介入干预治疗的患者明显增加(8.5% vs4.4%,p=0.046)。对有无镀金的Inflow支架的研究,结果也类似。故目前镀金支架已被淘汰。
四、应用支架的原则
应根据病变的长度、是否弯曲、血管大小和病变的部位、是否有大的分支、钙化等选择支架,应针对不同病变和支架的特性选用不同支架(表3-7)。
表3-7 针对不同病变选用不同支架

-:不推荐;+:好;++:很好;+++:优秀。
(一)在非药物支架年代
在非药物支架时代,使用支架的原则为:①支架的直径与参照血管的直径比为1.0~1.1,强调越大越好;②长度应将病变或夹层全部覆盖,对于特别长的病变有时例外;③避免过长支架和一支血管植入多个支架,多个支架不可避免时,应尽可能减少支架过多重叠。对有经验的中心和医生可以提倡直接植入支架。
1.局限性病变对于近段局限性病变不呈角,近段血管无明显弯曲,可以选择管状支架,原因:病变覆盖的好,弹性回缩小,可选择Tetra、Duet、Bxvelocity、BiodivYsio,Nir Elite、BestentⅡ、Jomed等。
2.弯曲性病变管状支架太硬、太直,有时会引起夹层,可以选用AVE S670、Crossflex、Coroflex、Tetra、Duet、Biodivysio、Bx velocity等。
3.开口部病变可以分为主动脉开口病变和冠状动脉开口部病变。前者宜选用管状支架,支撑力如何准确定位,如Nir Royale、Nir Elite、Tetra;如果血管直径≥4mm,可选用Plamaz胆道支架;若病变位于冠状动脉开口,如前降支开口或回旋支开口,最好选用有近段标志和X线下可见的支架,如Nir、Tetra、Bxvelocity、Bestent、Biodivysio等。
4.分叉部病变术前应仔细计划是主支与分支均需要植入支架,还是仅需要主支植入支架,分支单纯用球囊加压扩张。北京阜外医院通常是在主支植入一个支架,分支用球囊扩张。可选择S670,但如果两个分支直径均≥3.5mm者例外。
5.左主干病变左主干病变选择能准确定位和支撑力好,最好在X线下可见为宜。对于开口部和体部病变,宜选用支撑力好的管状支架;对于左主干分叉处病变,宜选用S670。植入支架前一定要进行充分的预扩张。对于无保护的左主干,可在旋切后植入支架,以减少再狭窄。
6.钙化病变由于钙化病变硬,宜选择回缩小、支撑力强的支架,也可以先做旋磨,后植入支架。
7.慢性完全闭塞植入管状支架可以明显减少慢性完全闭塞性病变。对于大血管弥漫性病变,如右冠状动脉,也可植入Wallstent。对小血管病变植入非药物支架是否有益尚存争议。很多公司都有<3.0mm的支架。但均缺乏长期随访资料。
8.静脉桥血管病变静脉桥血管病变弥漫、血管粗大,常选Wallstent,也可选用带膜的Jomed支架。
(二)在药物支架时代
支架的植入技术有了明显的改变。
1.预扩张植入药物支架时,为了尽量减少球囊对病变处及邻近血管壁损伤,应选择小、短的球囊进行低压预扩张。选择球囊应比参照血管的直径小0.5~1.0mm;球囊的长度一定短于计划选择的药物支架的长度;加压的压力一般小于8atm;加压应在狭窄最重的部位,且牢记球囊越短,加压扩张时越容易滑动移位,因此选择较短的球囊加压时一定在透视下进行。有些病变也可选择短的切割球囊。在有经验的医院可以选择直接植入药物支架。但对于技术不成熟的医院、复杂病变以及狭窄程度较重(≥80%)的病变不提倡直接植入药物支架,这样可以避免在操作过程中由于强行通过病变造成损伤涂层结构而影响药物支架的疗效。对于复杂病变和多支病变最好先预扩张,球囊的预扩张会使斑块发生改变,其意义不仅仅是单纯的预扩张,从某种意义上这种预扩张会有利于药物支架的准确定位和扩张。
2.药物支架型号的选择在计划植入药物支架前应首先了解各种药物支架的直径和长度。选择药物支架仍可根据参照血管的直径而定,一般直径比仍为1.0~1.1。或根据血管内超声测量的结果选择。如果病变两端直径相差较大,需根据两端直径取平均值来选择;若植入后近段支架扩张不满意,尤其在球囊已经移出支架的情况下,尽量不用原球囊再扩张,可以选择大一号的短球囊在支架内的近段行加压以求获得满意的效果。选择支架的长度非常重要,此点与非药物支架有明显差别。在非药物支架年代,支架的长度与再狭窄率成正比,即支架越长,再狭窄率越高,预后越差,提倡选择较短的支架。而在药物支架随即临床试验的结果中,发现药物支架植入后再狭窄的病例中,支架边缘的近端和远端分别为5.8%和2.0%,支架内再狭窄仅占3.2%,故多数为植入支架的边缘效应,即支架的长度未能完全覆盖全部病变、支架的长度不能全部覆盖球囊预扩张的血管段以及后扩张损伤部分超出了支架的长度。由于雷帕霉素和紫杉醇均为脂溶性药物,在支架未覆盖的区域不能达到有效的药物治疗浓度而容易产生这种类似放射治疗的边缘效应。所以,在选择药物支架的长度时,应注意支架的长度应完全覆盖病变的全长,即从病变近端的正常段到病变远端的正常段,以长出病变两端3~5mm为宜,在某种程度上强调越长越好。对于相同的病变,选择药物支架的长度比非药物支架长5~10mm。在不能确定病变的准确长度或选择两种长度的支架犹豫不决时,应选择较长的支架。估计病变长度时,预扩张球囊两端的标记或导引钢丝不透X线的头端长度以及X线机测量系统都会提供有益的参考。强生公司生产的ATW标记钢丝对于正确估计病变长度、选择合适长度的支架非常有价值,尤其在直接植入支架时,该标记钢丝的头端共有四个标记不透X线,每两个标记间的距离为1cm,四个标记的长度为3cm。对于非药物支架而言,支架内再狭窄的发生率还与支架的直径成反比,故提倡选择直径相对较大的支架以求获得良好的预后。在药物支架年代,由于药物支架能明显抑制内膜增生,几乎没有内膜增生,晚期管腔丢失不是再狭窄的主要因素,因此不需要选择加大直径的药物支架。但需强调药物支架长度应完全有富裕地覆盖病变的全部,这样可以避免球囊损伤又未被药物支架完全覆盖的血管段引起的边缘再狭窄。此外,不会因选择的药物支架长度较长而增加患者的费用。切记,选择药物支架越长越好,完全覆盖病变是保证降低术后再狭窄的关键。
3.药物支架的输送此点与非药物支架不同,药物支架的表面有涂层,故一定要注意输送药物支架的细节,以避免损伤支架表面的聚合物涂层。从包装中取出药物支架后,不要用手或物品触碰支架,避免用液体浸泡支架。将Y型接头完全彻底打开后再送入支架,过活瓣时不能有任何阻力。支架过了活瓣进入导引导管后再适度关紧活瓣以免出血过多。支架通过病变时如遇到阻力,不可以强力推送,应撤出支架用球囊重新扩张后再送入,一定避免过度用力推送。准确定位后即可加压扩张。紫杉醇支架至少9atm;而雷帕霉素支架至少11~12atm。可根据支架膨胀的程度适当增加大气压数,尽量一次加压达到理想的贴壁,但一般不宜超过支架的爆破压。
4.药物支架的后扩张通常绝大多数情况下一次加压释放可达到满意的释放效果,不需要后扩张。若已加至爆破压结果还不满意,仍存在较重的残余狭窄或支架有“腰”,可以选择一个大一号的、较支架短的非顺应球囊重新适当加压,最好为耐高压的短球囊,如Boston Scientific公司的quantum球囊和Cordis公司的powersail。加压时球囊的位置很重要,一定要限制在支架内,不能超出支架。加压的结果尽量达到术后即刻支架内直径的造影结果接近参照血管直径,切忌像非药物支架时代追求过大的直径。此外,后扩张所使用的球囊不宜过大,至少不提倡选择大两个数量级的球囊,如3.0mm支架的后扩张可以选择3.5mm球囊,而尽量避免使用4.0mm球囊。过度的后扩张有时可能会对支架的结构和药物涂层产生影响,增加亚急性血栓形成的危险,因此应尽量避免不必要的过度后扩张。对于极度偏心的病变更应注意,后扩张有时会造成支架在管壁内不均匀地膨胀,一侧扩张不开。
5.串联应用支架通常情况下,应尽可能地选择单个支架。如果型号不全、支架的长度不够或因支架植入后支架两端撕裂而必须植入第二个药物支架时,应注意两支架间重叠3~5mm,以免两支架间无药物的空隙使再狭窄增加。紫杉醇支架的重叠不宜超过4mm,并且应在两支架重叠处行高压扩张。家兔试验表明,药物支架重叠处的内皮化不好,有纤维蛋白和过度的炎症反应,提示对于有药物支架重叠的患者进行充分的和足够的抗血小板治疗可能使患者受益。
五、支架的现状及发展趋势
尽管目前已有的研究表明不同的支架设计再狭窄率不同,但在临床实际中仍无法精确地控制危险因素。此外,市场上厂家产品的更新太快,有关这方面的研究信息发表延迟。所以,临床上最终多由介入医生综合各种因素决定应用何种支架。在过去的几年里,各种不同的支架均在不断改进,差别明显减少,药物涂层支架是最重要的进展,为支架研究提供了新的平台。尽管已经明确药物涂层支架能确切降低再狭窄率,但没有证明其能够降低总死亡率和心肌梗死的证据。对于哪些病变适合药物支架,哪些病变适合非药物支架,还是所有的病变均应使用药物支架尚无定论。但肯定的是对再狭窄高危者应植入药物支架。现今支架研究的热点是在不减少支撑力的前提下,尽量减少支架丝的厚度;以金属支架为平台,携带药物涂层,其中以抗增值药物为主,辅以抗血小板药物、生物降解支架的研制。相信在不久的将来,会有更多有价值的试验研究结果和更理想的支架诞生。
(高展乔树宾)
参考文献
[1] Kutryk M, Serruys P: Stents currently available. In Kutryk M, Serruys P(eds): Coronary Stenting. Current Perspectives[M]. London, Martin Dunitz Ltd, 1999, 17-86.
[2] Escaned J, Goicolea J, Alfonso F, et al: Propensity and mechanism of restenosis in different coronary stent designs[J]. J Am Coll Cardiol,1999, 34: 1490-1497.
[3]Goy JJ,Eeckhout E,Stauffer JC, et al. Emergency endoluminal stenting for abrupt vessel closure following coronary angioplasty: A randomized comparison of the Wiktor and Palmaz-Schatz stents[J]. Cathet Cardiovasc Diagn, 1995, 34: 128-132.
[4] Wong SC, Popma JJ, Pichard AD, et al. Comparison of clinical and angiographic outcomes after saphenous vein graft angioplasty using coronary versus biliarytubular slotted stents[J]. Circulation,1995, 91: 339-350.
[5] George BS, Voorhees WD 3d, Roubin GS, et al. Multicenter investigation of coronary stenting to treat acute or threatened closure after percutaneous transluminal coronary angioplasty: Clinical and angiographic outcomes[J]. J Am Coll Cardiol,1993, 22: 135-143.
[6] Leon M, Popma J, O'Shaughnessy C, et al. Quantitative angiographic outcomes after Gianturco-Roubin II stent implantation in complex lesion subsets(abstract)[J]. Circulation, 1997,96(Suppl 1):653.
[7] de Jaegere PP, Serruys PW, Bertrand M, et al.Wiktor stent implantation in patients with restenosis following balloon angioplasty of a native coronary artery[J]. Am J Cardiol, 1992, 69: 598-602.
[8]Chalet Y, Panes F, Chevalier B, et al. Should we avoid ostial implantations of Wiktor stents?[J]. Cathet Cardiovasc Diagn, 1994, 32: 376-379.
[9] Baim D, Midei M, Linnemeier T, et al. A randomized trial comparing the Multilink stent to the Palmaz-Schatz stent in de novo lesions. Am J Cardiol, in press.
[10] Heuser R, Kuntz R, Lansky A, et al. Six-month clinical and angiographic results of the SMART Trial(abstract)[J]. J Am Coll Cardiol, 1998, 31: 64.
[11] Almagor Y, Feld S, Kiemeneij F, et al. First international new intravascular rigid-flex endovascular stent study(FINESS): Clinical and angiographic results after elective and urgent stent implantation[J]. J Am Coll Cardiol, 1997,30:847-854.
[12] Baim D, Cutlip D, O′Shaughnessy C, et al. A randomized trial comparing the NIR Stent to the Palmaz-Schatz stent in native coronary lesions[J]. Am J Cardiol, in press, 1997, 32:56.
[13]Watson P, Ponde C, Aroney C, et al. Angiographic follow-up and clinical experience with the flexible tantalum Cordis stent[J]. Cathet Cardiovasc Diagn, 1998, 43: 168-173.
[14] Feres F, Sousa E, Londero H, et al. Early results of the SOLACI Registry of a new coil stent(Cross-flex)(abstract)[J]. Am J Cardiol, 1997, 80(Supp)l:28.
[15] Kobayashi Y, Teirstein P, Bailey S, et al. Self-expandable stent versus balloon-expandable stent: A serial volumetric analysis by intravascular ultrasound(abstract)[J]. J Am Coll Cardiol, 1998, 31: 396.
[16] Han R, Schwatz R, Mann T, et al. Comparative efficacy of self-expanding and balloon expandable stents for the reduction of restenosis(abstract)[J]. J Am Coll Cardiol, 1998, 96: 314.
[17] Bilodeau L, Schreiber T, Hilton J, et al. The Wallstent in native coronary arteries(W IN)multicenter randomized trial: Inhospital acute results(abstract)[J]. J Am Coll Cardiol, 1998, 31: 80.
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。

















