第十章 病毒各论
学 习 目 标
1.何谓呼吸道病毒?主要包括哪些病毒?分别引起什么疾病?
2.简述流感病毒抗原变异与流行性的关系?
3.肠道病毒的共同特点是什么?
4.简述乙肝“两对半”及检测意义。
5.人类免疫缺陷病毒的传播途径有哪些?
6.引起人类疾病的疱疹病毒主要有哪些?分别与哪类疾病有关?
7.人一旦被狂犬咬伤,如何预防狂犬病?
8.比较“乙脑”与“流脑”的流行特点。
第一节 呼吸道感染病毒
呼吸道感染病毒是指一大类主要以呼吸道为侵入门户,侵入呼吸道黏膜上皮组织,并引起呼吸道局部感染或呼吸道以外组织器官病变的病毒。此类病毒具有感染力强、传播快、潜伏期短、起病急等特点。其中常见的有流行性感冒病毒、禽流感病毒、冠状病毒、麻疹病毒、流行性腮腺炎病毒、风疹病毒等。据统计,急性呼吸道感染中90%~95%由病毒引起。
一、流行性感冒病毒
流行性感冒病毒(influenza virus)简称流感病毒,在病毒分类上属于正黏病毒科,是流行性感冒的病原体。流感病毒分为甲、乙、丙3型,除引起人类流感外,还可引起动物感染,它们的生物学性状基本相似。甲型流感病毒于1933年分离成功,在引起人类流感流行上最重要,曾多次引起世界性大流行,如1918~1919年的流感世界大流行,50%的世界人口被感染,死亡人数至少2 000万,平均的死亡率3%,比第一次世界大战死亡总人数还多。乙型流感病毒于1940年分离出来,仅对人体有较低的致病性。丙型流感病毒主要感染婴幼儿,引起轻微的上呼吸道感染,很少引起流行。
(一)生物学性状
1.形态结构 多呈球形或丝状,球形直径80~120 nm,丝状有时可达4 000 nm左右,有包膜,为单股分节段RNA病毒。其结构由内向外可分3层(图10-1)。
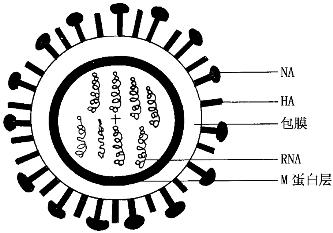
图10-1 流感病毒结构模式图
内层:是病毒的核心,它是由蛋白质盘绕着单股的RNA组成核衣壳,呈螺旋对称。与核酸结合的蛋白质称为核蛋白。流感病毒的核酸分7~8个节段,每个RNA节段结合有RNA多聚酶,分别控制编码一种结构或功能蛋白。病毒核酸分节段这一结构特点使病毒在复制中易发生基因重组,导致新病毒株的出现。
中层:是病毒基因编码的基质蛋白(M蛋白),位于包膜与核心之间,主要作用为保护病毒核心并维持病毒外形与结构的完整性。其免疫原性稳定,具有型的特异性。
外层:是病毒的包膜,位于基质蛋白之外的双层脂质膜,其上镶嵌有2种刺突蛋白,一种呈柱状的为血凝素(hemagglutinin,HA),另一种呈蘑菇状为神经氨酸酶(neuraminidase,NA)。HA与病毒的吸附、穿入有关,能与人、鸡等多种红细胞发生凝集。NA有利于成熟病毒的释放和集聚病毒的扩散,故两者与病毒感染性有关。HA和NA又称为表面抗原,均由糖蛋白组成,具有免疫原性,可诱导机体产生相应抗体,以中和病毒的感染性。这2种结构决定了流感病毒的亚型,其免疫原性易发生变异。
2.分型与变异 根据流感病毒核蛋白和M蛋白抗原的不同将其分为甲、乙、丙3型。各型流感病毒又根据其HA和NA的免疫原性不同再区分为若干亚型。世界流感流行的资料分析表明,乙型和丙型的免疫原性较稳定,而甲型流感病毒表面的HA和NA变化最为频繁,很易发生变异。
病毒的变异与流感的流行关系密切。其原因是表面抗原氨基酸序列出现一系列的点突变,使HA抗原决定基发生某些改变。
流感病毒抗原变异有2种形式:①抗原漂移,其变异幅度小,属量变,由基因组自发的点突变所造成,引起甲型流感周期性的局部中、小型流行;②抗原转变,变异幅度大,属质变,由基因组发生重新排列所造成,产生新亚型,由于人群失去原有的免疫力,可致大规模流行,甚至世界性大流行。甲型流感病毒迄今已经历过数次大变异(表10-1)。
表10-1 甲型流感病毒抗原变异引起的世界性流行

3.培养特性 流感病毒可在鸡胚和培养细胞中增殖,病毒在其中增殖后不引起明显的病变,需用红细胞凝集试验以证实病毒的存在。
4.抵抗力 较弱,不耐热,56℃、30 min被灭活,0~4℃能存活数周,-70℃以下可长期保存;对干燥、紫外线、甲醛、乳酸等敏感。
(二)致病性与免疫性
流感病毒的传染源主要是患者,病毒随飞沫传播而侵入易感者呼吸道黏膜上皮细胞,在细胞内增殖,引起上皮细胞的破坏、变性和脱落,黏膜充血、水肿。潜伏期1~4 d,患者出现鼻塞、流涕、咳嗽、咽痛等上呼吸道感染的症状。发病初期2~3 d内,鼻腔分泌物中含大量病毒,传染性最强。流感病毒多在局部增殖,很少入血形成病毒血症,有的患者出现头痛、发热、乏力、全身肌肉酸痛等全身症状,与病毒感染刺激机体产生的干扰素和免疫细胞释放的细胞因子有关。婴幼儿或年老体弱者易继发细菌感染,导致肺炎,死亡率高。
病后机体产生的呼吸道局部SIg A为抗HA的中和抗体,可抵抗同型病毒的再感染。NA抗体可抑制新合成病毒的释放,阻止病毒扩散;由于甲型流感病毒易变异,机体对新出现的亚型无抵抗力,故病后免疫力不牢固。
(三)防治原则
流感病毒传染性强,传播迅速,同时流感病毒基因容易发生变异。因此,人类至今无法有效控制流感。在流感流行期间应避免人群聚集,必要时应戴口罩。对公共场所应进行空气消毒,如公共场所每100 m3空间可用2~4 ml乳酸加10倍水混合均匀,加热熏蒸空气,可灭活空气中的流感病毒。免疫接种是预防流感最有效的方法,但必须与当前流行株的型别基本相同。
流感疫苗有灭活疫苗和减毒活疫苗两种。我国用于流感预防的疫苗全部是灭活疫苗:全病毒灭活疫苗、裂解疫苗和亚单位疫苗。目前较多使用的为三价灭活疫苗(甲型2个亚型和1个乙型)。全病毒灭活疫苗免疫效果好,但副作用较大,只能用于成人,儿童不能接种;亚单位疫苗副作用较小,但免疫效果一般;裂解疫苗免疫效果好,同时副作用也比较小,目前全球使用量最大的是裂解疫苗。减毒活疫苗目前仍处于研制阶段。
目前尚无有效的治疗方法,金刚烷胺对预防流感病毒穿入和脱壳有一定作用,在发病24~48 h内使用,可减轻患者全身中毒症状。此外,干扰素滴鼻以及中草药板蓝根、大青叶等有一定疗效。并发细菌感染时,应使用抗生素。
二、禽流感病毒
禽流感病毒(avian influenza virus,AIV)是引起禽流行性感冒的病原体。此种病毒属于RNA病毒的正黏病毒科,分甲、乙、丙3个型,其中甲型流感病毒多发于禽类,一些亚型也可感染猪、马、海豹和鲸等各种哺乳动物及人类,乙型和丙型流感病毒则分别见于海豹和猪的感染。
(一)生物学特性
禽流感病毒一般呈球形,直径为80~120 nm,有包膜。包膜表面有钉状血凝素(HA)和蘑菇状的神经氨酸酶(NA)两种刺突,HA和NA的抗原性容易发生变异。基因组为分节段单股负链RNA。依据其外膜血凝素(H)和神经氨酸酶(N)蛋白抗原性的不同,目前可分为15个H亚型(H1~H15)和9个N亚型(N1~N9)。感染人的禽流感病毒亚型主要为H5N1、H9N2、H7N7,其中感染H5N1的患者病情重,病死率高。研究表明,原本为低致病性的禽流感病毒株(H5N2、H7N7、H9N2),经6~9个月禽间流行的迅速变异可成为高致病性毒株(H5N1)。禽流感病毒形态见图10-2。

图10-2 禽流感病毒形态
禽流感病毒对乙醚、氯仿、丙酮等有机溶剂均敏感,常用消毒剂容易将其灭活,如氧化剂、稀酸、十二烷基硫酸钠、卤素化合物(如漂白粉和碘剂)等都能迅速破坏其传染性。禽流感病毒对热比较敏感,65℃加热30 min或100℃煮沸2 min以上可灭活。病毒在粪便中可存活1周,在水中可存活1个月,在p H为4.1的条件下也具有存活能力。病毒对低温抵抗力较强,在有甘油保护的情况下可保持活力1年以上。病毒在直射阳光下40~48 h即可灭活,如果用紫外线直接照射,可迅速破坏其传染性。
(二)致病性与免疫性
传染源主要为患禽流感或携带禽流感病毒的家禽,另外野禽或猪也可成为传染源,许多家禽都可感染病毒发病。世界上带禽流感病毒的鸟类达88种,我国已在17种野生鸟中检测出禽流感病毒。有专家认为家庭成员同时患病的几率较大,并且随着高致病性禽流感病毒变异程度加大,不能排除将有人—人传播的可能性。传播途径是主要经呼吸道传播,通过密切接触感染的禽类及其分泌物、排泄物或受病毒污染的水等,以及直接接触病毒毒株被感染。人禽流感的发生,目前只可能是因接触的病禽而感染。一般认为任何年龄均具有易感性,但12岁以下儿童发病率较高,病情较重。与不明原因病死家禽或感染、疑似感染禽流感家禽密切接触人员为高危人群。禽流感早期表现类似普通流感,主要为发热、流涕、鼻塞、咳嗽、咽痛、头痛、全身不适。有些患者可见眼结膜炎。体温大多持续在39℃以上,热程1~7 d,多数为2~3 d。部分患者可有恶心、腹痛、腹泻、稀水样便等消化道症状。
(三)防治原则
近年来,世界部分国家和地区暴发禽流感疫情。在没有特效疫苗和药物出现之前,做好自我防护成为个人预防禽流感的最有效方法。
鉴于禽流感的传播特点,个人预防禽流感应该注意以下几点:首先,注意饮食卫生。食用禽蛋、禽肉要彻底煮熟,禽蛋表面的粪便应当洗净,加工保存这类食物要生熟分开。第二,避免接触水禽、候鸟等易于携带禽流感病毒的动物。第三,如果条件允许,可以接种流感疫苗。健康的成年人和青少年可以接种减毒活疫苗,老年人、婴幼儿、孕妇和慢性病患者可以接种流感灭活疫苗。接种流感疫苗的主要目的是减少感染普通流感病毒的几率,而减少流感病毒与禽流感病毒发生基因整合的机会。
三、冠状病毒
冠状病毒(coronavirus)在分类上属于冠状病毒属。该属既包括一些能引起人类疾病的病毒,也包括一些能引起其他哺乳动物和禽类疾病的病毒。人冠状病毒以往是普通感冒的主要病原体,引起轻型感染,也可引起腹泻或胃肠炎。
冠状病毒呈多形性,直径约80~160 nm,核酸为单正链RNA,不分节段,核衣壳呈螺旋对称,有包膜,其表面有突起,电镜下病毒颗粒的外膜上存在日冕或皇冠状的突起,故命名为冠状病毒。1957年国际病毒命名委员会正式定名这类病毒为冠状病毒科。
冠状病毒感染在世界各地普遍存在,可感染各年龄组人群,引起普通感冒和咽喉炎。某类冠状病毒还可引起成人腹泻或胃肠炎。多为自限性疾病,以往对其流行病学研究十分重视。该病毒主要经飞沫传播,流行期为冬春两季。疾病的潜伏期短,平均为3 d,病程一般为6~7 d,病后免疫力不强,可发生再感染。
SARS冠状病毒(coronavirus SARS)
此病毒是严重急性呼吸综合症(SARS)的病原体。SARS是2002年底至2003年上半年在世界范围流行的一种急性呼吸道传染病,又称传染性非典型性肺炎。2003年4月16日WHO正式宣布SARS的病原体是一种新的冠状病毒,称为SARS冠状病毒。
(一)生物学特性
SARS冠状病毒形态与其他冠状病毒类似,有包膜,表面有刺突,形状如花冠。核心为单正链RNA。SARS冠状病毒形态见图10-3。该病毒对脂溶剂敏感,不耐热和酸,可用0.2%~0.5%过氧乙酸或10%次氯酸钠消毒,普通消毒剂也可使其灭活。
图10-3 SARS冠状病毒
(二)致病性与免疫性
SARS患者可通过呼吸道分泌物、粪便及尿液排出病毒。主要通过鼻或黏膜传播。具感染性的物质如粪便或尿液产生的气溶胶被吸入后,其中的病毒侵入黏膜也可导致感染的传播。实验证明经吸入气溶胶颗粒感染的动物与密切接触吸入飞沫感染的动物相比,前者排除病毒的时间更长,病情也更重。约占发病人数1%~2%的“超级传播者”可以传播数十甚至数百人,该现象可能是由于患者合并其他感染,使传染性增强。
SARS起病急,潜伏期1~12 d,最长的一例达14 d,发病后最快1 d,最慢7~10 d发展为肺炎。患者表现为发热、干咳或咳痰、胸闷、胸痛、呼吸困难等,还有的患者伴有腹泻。
(三)防治原则
SARS的预防措施主要是隔离病人、切断传播途径和提高机体免疫力。对患者治疗主要采用支持疗法,如早期氧疗及适量激素疗法等。给予抗病毒类药物和大剂量抗生素,可防治病情发展及并发症的发生。目前已研制出灭活疫苗、基因工程疫苗,但必须通过动物安全实验和疫苗保护性实验测定后方可应用于临床。
四、其他常见的呼吸道病毒
(一)麻疹病毒
麻疹病毒(measles virus)是引起麻疹的病原体。麻疹是冬春季儿童最常见的一种急性呼吸道传染病。发病率高,常因并发症导致死亡,自普遍使用麻疹减毒活疫苗以来,发病率大大降低。
1.生物学性状 病毒颗粒较大,呈球形,核心为完整的单股RNA,不分节段。该类病毒有包膜,其上有放射状排列的刺突,有血凝素(HA)和融合因子(fusion factor,F蛋白),前者与病毒吸附有关,后者可促进宿主细胞膜与病毒、细胞与细胞间的融合,形成多核巨细胞。病毒在感染细胞核和胞浆内形成嗜酸性包涵体。需在人胚肾、猴肾及人羊膜细胞培养中生长,只有一个血清型。
2.致病性与免疫性 急性期麻疹患者为传染源,通过飞沫传播,也可通过用具、玩具间接传播。潜伏期为10~14 d,病毒由呼吸道或眼结膜侵入人体,先在呼吸道上皮细胞内增殖,随后进入血流形成第一次病毒血症。患者可表现发热、咳嗽、流涕、流泪、眼结膜充血、口颊黏膜出现灰白色外绕红晕的黏膜斑(Koplik`s spots,柯氏斑),有助于临床早期诊断。血流中的病毒继而侵入全身淋巴组织的单核/巨噬细胞系统细胞内进一步增殖后,病毒再次入血,形成第二次病毒血症,继而侵犯全身皮肤、黏膜及中枢神经系统,表现为细胞病变。此时患儿全身皮肤由颈、躯干、四肢相继出现红色斑丘疹,出疹期病情最严重。数日后体温下降,皮疹渐消退,若无并发症可自愈。若患儿抵抗力低下、护理不当则易并发细菌感染,最常见的并发症是肺炎,死亡率高。最严重的并发症是亚急性硬化性全脑炎(SSPE),极少数患儿在儿童期感染后发展到SSPE平均为7年,潜伏的病毒被激活,患者大脑功能发生渐进性衰退,表现为反应迟钝、运动障碍,最后导致痉挛、昏迷而死亡。
麻疹病毒免疫原性强、稳定,感染后由于发生2次病毒血症,使病毒与免疫系统接触广泛,诱发较强的免疫应答,引起体液免疫和细胞免疫。麻疹病后可获牢固免疫力,很少发生再感染。6个月以内的婴儿,因有从母体获得的自然被动免疫(Ig G),故不易感。6个月~5岁的婴幼儿易感性高,因此时从母体获得的抗体渐已消失,而自身免疫系统尚未健全。5岁后易感性下降。但近年来,由于广泛接种麻疹减毒活疫苗,麻疹发病年龄有后移现象,致使成人麻疹较以往多见,其症状不很典型。
3.防治原则 预防麻疹的主要措施是对儿童进行人工主动免疫,提高机体免疫力。鸡胚细胞麻疹病毒减毒活疫苗是目前最有效的疫苗。WHO已经将消灭麻疹列入继消灭脊髓灰质炎后的主要目标。我国自1965年开始接种麻疹疫苗以来,麻疹发病率大幅度下降。我国的免疫程序是8个月龄为初次免疫,学龄前再加强免疫一次。疫苗接种后,抗体阳转率可高达90%以上,免疫力可持续10年以上。对接种麻疹的易感者,可紧急用丙种球蛋白或胎盘球蛋白进行人工被动免疫,可防止麻疹病毒发病或减轻症状。
(二)腮腺炎病毒
腮腺炎病毒(mumps virus)是流行性腮腺炎的病原体,世界各地均有流行。流行性腮腺炎多发于学龄前儿童,亦见于青壮年。以腮腺肿大、疼痛为主要临床特征,有时亦可累及其他唾液腺。
腮腺炎病毒仅感染人,通过直接接触、飞沫、唾液污染食具和玩具等途径传播;四季都可流行,以晚冬、早春多见。腮腺炎病毒经口、鼻侵入机体后,在上呼吸道上皮细胞内繁殖,引起局部炎症和免疫反应,如淋巴细胞浸润、血管通透性增加及Ig A分泌等。然后,增殖后的病毒进入血液循环,发生病毒血症,播散入不同器官,如腮腺、中枢神经系统等。在这些器官中病毒再度繁殖并再次侵入血循环,散布至第一次未曾侵入的其他器官,引起炎症,临床呈现不同器官相继出现病变的症状。
流行性腮腺炎传染性强,潜伏期2~3周,排毒期为发病前后一周。腮腺肿大常是疾病的首发体征,主要临床症状为体温中度增高、头痛、肌痛等,持续7~10 d,常一侧先肿2~3 d后,对侧腮腺亦出现肿大,有时肿胀仅为单侧,或腮腺肿大同时有颌下腺肿大,或仅有颌下腺肿大而无腮腺肿大。病程大约1~2周。30%腮腺炎病毒感染者无临床症状。儿童感染一般症状较轻;青春期感染者,25%男性易合并睾丸炎,导致睾丸萎缩、不育;女性易合并卵巢炎。此外,腮腺炎病毒感染也可累及中枢神经系统而并发脑炎。流行性腮腺炎病后可获得持久免疫。
预防腮腺炎应及时隔离患者。疫苗接种是有效的预防措施。目前使用的是减毒活疫苗。美国、日本等国家已经将腮腺炎病毒、麻疹病毒、风疹病毒组成三联疫苗,我国目前使用的是单价减毒活疫苗,程序是1岁初次免疫,2岁及学龄前各加强免疫一次。
(三)风疹病毒
风疹病毒(rubella virus)是风疹的病原体。
人是风疹的唯一传染源,儿童是主要易感者。病毒经呼吸道侵入人体,潜伏期为2~3周,病毒先在上呼吸道黏膜上皮细胞增殖后进入血流而扩散到全身。表现为发热、咽痛、咳嗽、耳后及枕部淋巴结肿痛,继而在面部及两耳旁出现浅红色斑丘疹,迅速遍及全身。病程短、并发症少。成人感染后症状较重,除出疹外,伴有关节疼痛、血小板减少、出疹后脑炎等。
风疹病毒感染最严重的危害是经垂直传播导致胎儿先天性感染。未感染过风疹病毒的孕妇,以孕期5个月内感染风疹病毒对胎儿危害最大,胎儿细胞可因感染而发生变化,引起胎儿死亡或出生后表现为先天性心脏病、耳聋、白内障、智力发育下降等畸形,这些先天性损害统称为先天性风疹综合征。
隐性感染或感染风疹病毒后,机体可产生特异性的Ig M、IgG,IgG能持续多年,因此风疹病毒感染后可获得牢固免疫力。我国的一项调查研究表明,育龄妇女血清中抗风疹病毒IgG阳性率为76%~98%,血清中抗风疹病毒IgG可保护胎儿免受风疹病毒感染。
为了保证优生优育,育龄妇女和学龄儿童应接种风疹疫苗,特别是学龄女童接种更有意义。风疹病毒自然感染和疫苗接种后可获得持久免疫力。风疹减毒活疫苗是预防风疹的有效措施,常与麻疹、腮腺炎组合成三联疫苗使用。我国自己研制的风疹减毒活疫苗BRDⅡ免疫原性良好,已正式生产。风疹减毒活疫苗免疫保护时间一般为7~10年,为避免胎儿发生畸形,应在妊娠之前接种。
第二节 肠道感染病毒
肠道感染病毒在病毒分类上归属于小核糖核酸科。它们在人类消化道细胞内繁殖,然后通过血液侵犯其他器官,引起各种临床综合病症。
一、肠道病毒
肠道病毒的共同特性:
1.病毒体呈球形,直径20~30 nm,衣壳呈20面体立体对称,无包膜。
2.基因组为单正链RNA病毒,有感染性。
3.在宿主细胞浆内增殖,迅速引起细胞病变。
4.抵抗力较强,耐酸、耐乙醚,在污水或粪便中可存活数月。
5.经粪—口途径传播,多为隐性感染。可通过病毒血症侵犯神经系统和多种组织,引发多种疾病,临床表现多样化。如麻痹、无菌性脑炎、心肌损伤、腹泻等。
(一)脊髓灰质炎病毒
脊髓灰质炎病毒(poliovirus)引起脊髓灰质炎。病毒主要损害脊髓前角运动神经细胞,导致弛缓性肢体麻痹,因多见于儿童,故又称小儿麻痹症。
1.生物学性状 病毒体呈球形,直径27~30 nm,核心为单股RNA,核衣壳由4种主要衣壳蛋白组成,分别称为VP1、VP2、VP3、VP4。用中和试验可将该病毒分为Ⅰ型、Ⅱ型和Ⅲ型,Ⅲ型间无交叉反应。脊髓灰质炎病毒常用人胚肾、猴肾或人羊膜细胞等灵长类细胞进行培养。病毒在细胞质内复制,产生典型的细胞病变,导致细胞变圆、坏死和脱落。若将病毒注入猴、猩猩的脊髓或脑内,可引起动物肢体发生麻痹。
2.致病性与免疫性 患者或无症状病毒携带者是脊髓灰质炎病毒的传染源。主要通过粪—口途径传播。病毒侵入人体后,先在咽部扁桃体和肠道下段上皮细胞和肠道集合淋巴结中初步增殖。90%以上患者感染后,病毒仅限于肠道,不进入血流,表现微热、咽痛、腹部不适等轻症感染或隐性感染。少数感染者由于机体抵抗力较弱,在肠道局部淋巴结内增殖的病毒侵入血流,形成第一次病毒血症,可表现发热、恶心、头痛等症状。当病毒随血流播散至全身的淋巴组织或其他易感的神经外组织中进一步增殖后,大量病毒再度入血形成第二次病毒血症。患者全身症状加重,表现为发热、头痛、乏力、咽痛和呕吐等症状,机体免疫力的强弱显著影响其结果。若抵抗力强,则迅速恢复。少数病人由于免疫力弱,则病毒经血流播散至靶器官,如脊髓前角运动神经细胞、脑膜、心脏等引起细胞病变,病毒在细胞内大量复制和释放,阻断宿主细胞的核酸和蛋白质合成,轻者发生暂时性肌肉麻痹,以四肢多见,下肢尤甚。重者可造成肢体弛缓性麻痹后遗症。极少数患者发展为延髓麻痹,导致呼吸、心脏功能衰竭而死亡。
病后机体可获得对同型病毒的牢固免疫力。在保护性免疫中,体液免疫发挥着重要作用。SIg A能清除咽喉部和肠道内病毒,防止其侵入血流;血清中的中和抗体IgG、Ig M 及Ig A可以阻止病毒进入神经系统。中和抗体可持续多年,甚至终身。婴幼儿可通过胎盘接受母体给予的IgG抗体或通过初乳给予的SIg A而获得自然被动免疫,但抗体仅能维持数月。
3.防治原则
(1)一般性预防 消化道病毒主要由粪—口途径传播感染,故应及早发现病人,隔离治疗;对病人排泄物、食具进行消毒;加强粪便、饮水管理,搞好个人和饮食卫生;消灭苍蝇和蟑螂。
(2)特异性预防 人工自动免疫是预防脊髓灰质炎行之有效的方法。疫苗有脊髓灰质炎减毒活疫苗和灭活疫苗。减毒活疫苗口服后可在肠道增殖,但不侵入血流,可诱发机体产生血清中和抗体和肠道的SIg A,并且活疫苗病毒可从粪便排出,再经粪—口途径传播给未服用疫苗的儿童,从而扩大免疫范围,但活疫苗不稳定,需低温保存。灭活疫苗较稳定,且易保存,但不能诱发肠道产生SIg A,故不能阻止病毒的侵入,仅预防麻痹症的发生,适用于免疫缺陷及免疫抑制剂使用者。我国自1986年卫生部颁布实行2月龄开始连续3次口服脊髓灰质炎减毒活疫苗,即三价混合糖丸疫苗,每次间隔1个月,4岁时加强一次的措施,脊髓灰质炎发病率持续下降。展望未来,消灭脊髓灰质炎的目标一定能够实现。
人工被动免疫是对未服用疫苗而又与脊髓灰质炎病人有密切接触的易感儿童,注射丙种球蛋白或胎盘球蛋白,可减少发病率或后遗症发生率。
(二)柯萨奇病毒、埃可病毒及新型肠道病毒
柯萨奇病毒、埃可病毒及新型肠道病毒分布广泛。它们的流行病学特点和致病机制与脊髓灰质炎相似,但各自攻击的靶细胞不同。脊髓灰质炎病毒往往侵犯脊髓前角运动细胞,而柯萨奇病毒、埃可病毒及新型肠道病毒更容易感染脑膜、肌肉和黏膜等部位。人体受感染后,约60%呈隐性感染。出现临床症状时,由于侵犯的器官组织不同而表现各异。
1.无菌性脑膜炎 是肠道病毒感染中极为常见的一种综合病症。在夏季流行时,不易与轻型的流行性乙型脑炎相区别。发病特点是短暂的发热,类似感冒,相继出现头痛、咽痛、恶心、呕吐和腹泻。进一步发展可出现颈项强直、嗜睡等。病程1~2周。
2.麻痹 在上述无菌性脑膜炎的基础上,部分患者可进入麻痹期,表现出特有的脊神经支配的肌群或部分肌群麻痹症状。
3.疱疹性咽峡炎 是一种发生于儿童的急性传染病,主要由柯萨奇A组病毒引起,常流行于春末和夏初。患者突然发热、咽痛厌食、吞咽困难,在咽腭弓、咽部、扁桃体及软腭边缘出现散在性小疱疹,破溃后形成小溃疡。
4.心肌炎和心包炎 在新生儿表现为皮肤青紫、呼吸困难;在儿童和成人表现为呼吸道感染症状,心动过速、心电图表现异常等,预后不良。
5.肌痛或肌无力 患者常有发热、头痛和肌肉酸痛。有的病例表现为肌无力。恢复后疼痛消失,预后良好。
6.急性出血性结膜炎 常发生于成年人,俗称“红眼病”。潜伏期短,起病急,侵犯双眼,引起眼睑水肿、眼球压痛、结膜下严重出血。人群对此病毒普遍易感,发病率高,但预后良好。
应当指出的是,肠道病毒血清型别繁多,不同型别病毒可引起相同的病症,而同样型别的病毒在不同条件下也可引起不同的临床病症,因此确定任何一个型别作为某种病症的病原是困难的。另外目前肠道病毒各型别对人体的侵害范围仍在研究中,将来可能会发现更多的临床病症与肠道病毒感染有关。
除一般的卫生措施外,无特效的预防和治疗方法。对有感染性的患者应当隔离。
二、轮状病毒
人类轮状病毒(human rotavirus,HRV)是1973年澳大利亚学者从因患急性非细菌性胃肠炎而住院治疗的儿童十二指肠黏膜上皮细胞超薄切片中首次发现的病毒颗粒,因这些病毒颗粒形似车轮,故将其命名为轮状病毒。该病毒是秋、冬季婴幼儿腹泻的主要病原体,其特点是发病率高、流行广、死亡率高。这种轮状病毒引起的秋季腹泻症状类似细菌性痢疾,临床容易误诊,应加以注意。
(一)生物学形状
病毒体为大小不等的球形,直径为60~80 nm,有双层衣壳,从内向外呈放射状排列,形同车轮的辐条,故称为轮状病毒(图10-4)。具有双层衣壳的轮状病毒体才具传染性。核心为双股RNA,由11个基因节段组成。根据内衣壳的免疫原性不同,可将其分为7个组(A~G)。
图10-4 轮状病毒形态
人类轮状病毒的抵抗力较强,在粪便中可存活数天或数周,在室温中其传染性能保持7个月,耐酸(p H3),故能抵抗胃内的酸性环境。轮状病毒生长要求严格,不易培养。常用恒河猴肾细胞、非洲绿猴肾传代细胞培养,常不出现明显细胞病变,因此分离病毒成功率较低(50%)。为提高细胞培养的阳性率,病毒标本处理以及细胞维持液中均加入胰蛋白酶,以增强其感染性。
(二)致病性与免疫性
人类感染轮状病毒的传染源是病人和无症状带毒者,粪—口是主要的传播途径,潜伏期为24~48 h。病人每克粪便中排出的病毒体可达1010个,温带地区晚秋和冬季是疾病发生的主要季节。病毒侵入人体后在小肠黏膜绒毛细胞内增殖,造成细胞溶解、死亡及微绒毛萎缩、变短、脱落至肠腔释放大量病毒,随粪便排出。腺窝细胞增生、分泌增多,导致电解质平衡失调,大量水分进入肠腔,引起严重水样腹泻。起病突然并伴有发热、呕吐、腹痛等症状。腹泻严重者,可出现脱水、酸中毒而导致死亡。轻者病程3~5 d,可完全恢复。
A、B、C三组轮状病毒能引起人类和动物腹泻,D~G组只引起动物腹泻。其中A组轮状病毒最为常见,有60%以上婴幼儿急性胃肠炎是由轮状病毒引起,患者以6个月~2岁婴幼儿为多见;B组病毒可在年长儿童和成人中产生暴发流行,据我国报道,1982~1983年该组病毒曾在我国东北、西北矿区青壮年工人中暴发了大规模霍乱样腹泻流行,患者达数十万人;C组对人的致病性类似A组,但发病率很低,迄今仅见个别报道。
轮状病毒感染后机体可产生Ig M、Ig A和IgG抗体,但主要发挥保护作用的抗体是肠道局部SIg A。由于抗体只对同型病毒有中和作用,且6个月~2岁婴幼儿SIg A含量较低,故病愈后还可重复感染。
(三)防治原则
目前对轮状病毒引起的急性胃肠炎的预防措施主要是控制传染源、切断传播途径。特异性疫苗正在加紧研制中。治疗原则主要是积极对症治疗、及时输液、补充血容量、纠正电解质失调等支持疗法,防止严重脱水和酸中毒的发生,降低婴幼儿的死亡率。
三、其他肠道病毒
(一)肠道腺病毒
肠道腺病毒(enteric adenovirus,EAd)40、41、42三型已证实是引起婴儿病毒性腹泻的第2位病原体。根据DNA同源性和血凝格局,它们归属于人类腺病毒F组,其形态结构、基因组成、复制特点、致病和免疫与其他腺病毒基本一致,但不易在通常用于分离腺病毒的细胞中增殖,后用腺病毒5型DNA转染的人胚肾细胞才分离成功。我国学者应用A549细胞分离40型亦获得成功。世界各地均有小儿腺病毒胃肠炎报告,主要经粪—口传播,四季均可发病,以夏季多见。主要侵犯5岁以下小儿,引起腹泻,很少有发热或呼吸道症状。
(二)杯状病毒
能引起人类胃肠炎的杯状病毒(calicivirus)称为人杯状病毒(HuCVs),包括小圆形结构化病毒(SRSV)和“典型”杯状病毒(“classic”calicivirus)。
SRSV是世界上引起非细菌性胃肠炎暴发流行最重要的病原体,血清学研究也证实这一点。流行季节为冬季,可累及任何年龄组,学校、家庭、医院、度假村等集体机构均可发生流行。在美国,成人无菌性急性胃肠炎的暴发中有42%由该类病毒引起,我国尚未有暴发流行的报道。病人、隐性感染者、健康带毒者为传染源。粪—口为主要传播途径,其次为呼吸道。传染性强。污染的水源和食物,尤其是海产品是引起流行的重要原因。
SRSV感染引起小肠绒毛轻度萎缩和黏膜上皮细胞的破坏。潜伏期约24 h,突然发病,恶心、呕吐、腹痛和轻度腹泻,呈自限性,无死亡发生,感染后可产生相应抗体。Norwalk病毒血清流行病学调研表明,5岁以下抗体阳性率为20%,18~35岁为45%,45~65岁为55%~60%,亦有高达89.7%的报道。但在发展中国家,到5岁时抗体检出率几乎达100%。抗体保护作用不明确。HuCVs主要引起5岁以下小儿腹泻,但发病率很低。据英国报告资料,其引起的腹泻只占病毒性胃肠炎的0.8%~0.9%。其临床症状类似轻型轮状病毒感染。
第三节 肝炎病毒
肝炎病毒是引起病毒性肝炎的病原体。目前公认的主要有甲型肝炎病毒、乙型肝炎病毒、丙型肝炎病毒、丁型肝炎病毒及戊型肝炎病毒。其中甲型肝炎病毒与戊型肝炎病毒由消化道传播,引起急性肝炎。乙型肝炎病毒与丙型肝炎病毒均由输血、血制品或注射器的污染而传播,除引起急性肝炎外,可致慢性肝炎,并与肝硬化及肝癌有关。丁型肝炎病毒为一种缺陷病毒,必须在乙型肝炎病毒等辅助下方能复制,故其传播途径与乙型肝炎病毒相同。
近年来还发现一些与人类肝炎相关的病毒如已型肝炎病毒、庚型肝炎病毒和TTV型肝炎病毒等。我国流行最广泛的是乙型肝炎病毒。
一、甲型肝炎病毒
甲型肝炎病毒(hepatitis A virus,HAV)是引起甲型肝炎的病原体。甲型肝炎呈世界性分布。病毒从感染者粪便排出,污染食物或水源而引起流行。主要感染儿童和青少年,大多数表现为隐性或亚临床型感染,少数则引起急性甲型肝炎并可完全恢复,不转为慢性或长期带毒者。
(一)生物学性状
1.形态与结构 病毒体呈球形,直径约为27 nm,呈20面体立体对称结构,无包膜(图10-5)。病毒核酸为单股正链RNA,长约7.5 kb。本病毒免疫原性稳定,只有一个血清型。

图10-5 HAV结构模式图
2.培养与动物模型 黑猩猩和狨猴对HAV易感,经口服或静脉注射可使动物发生肝炎,并在肝细胞质中检出HAV。我国猕猴属中的红面猴也对HAV易感,并从其粪便中分离到HAV。动物模型的主要用途在于研究发病、免疫机制以及对减毒活疫苗的毒力和免疫效果的考核。
3.抵抗力 HAV对热、酸、碱及乙醚等均有较强的抵抗力,100℃煮沸5 min才能使之灭活。对紫外线、乙醇、甲醛、石炭酸、漂白粉等较敏感,可消除其传染性。
(二)致病性与免疫性
1.传染源 甲型肝炎的传染源主要是病人,潜伏期为15~50 d。在潜伏期末,病毒常在患者转氨酶升高前5~6 d就存在于患者的血液和粪便中,病毒可随粪便排出体外,并可持续3~4周。随着特异性抗体的出现,血清及粪便中的病毒才渐消失。
2.传播途径 HAV随患者粪便排出体外,污染水源、食物、海产品(毛蚶等)、食具等,主要通过粪—口途径传播,传染性极强。历史上有记载的甲型肝炎大流行都是由于正在排出病毒的管理人员污染食物或传染性污物污染水源所致。在污染的水中生长的牡蛎和贝类也曾经引起过几次大流行。1988年我国上海甲型肝炎爆发流行,就是由于生食了在污染水中生长的毛蚶所致,患者多达30余万,危害极大。HAV感染后,出现的病毒血症持续时间较短,故通过输血、注射传播方式较为少见。
3.致病机制 HAV经口侵入人体,在口咽部或唾液腺中早期增殖,然后在肠黏膜与局部淋巴结中大量增殖,并侵入血流,引起短暂的病毒血症,最终侵犯靶器官(肝脏),在肝细胞内增殖而致病。HAV在组织培养细胞内增殖缓慢,并不直接造成明显的细胞损害。由此推论甲型肝炎早期的临床表现是HAV的直接作用,而随后的肝组织损害是机体的免疫应答产生的免疫损伤作用。甲型肝炎的临床表现有发热、乏力、食欲减退、腹胀、恶心、厌油,继而出现肝脏肿大、压痛、肝功能损害,部分患者出现黄疸。
4.免疫性 HAV感染后,机体可产生抗-HAV的Ig M和IgG抗体。前者在急性期和恢复早期出现;后者在恢复后期出现,并可在体内维持多年,可阻止再感染,获得牢固免疫力。
(三)防治原则
1.一般预防措施 HAV主要通过粪便污染饮食和水源经口传播。加强卫生宣传工作和饮食业卫生管理、管理好粪便、保护水源、注意个人卫生是预防甲肝的主要环节。病人排泄物、食具、物品和床单衣物等,要认真消毒处理。
2.特异性预防措施 接种疫苗主要用于学龄前和学龄儿童以及其他易感人群。现有HAV减毒活疫苗和灭活疫苗两种。我国应用的减毒活疫苗是从患者粪便中分离的HAV在人胚胎二倍体细胞连续传代减毒而制成,效果良好,已正式批准使用;国外已经发展了HAV灭活疫苗。
3.人工被动免疫 注射丙种球蛋白对HAV感染有应急预防作用。在潜伏期,肌肉注射丙种球蛋白能预防或减轻临床症状。
二、乙型肝炎病毒
乙型肝炎病毒(hepatitis B virus,HBV)是乙型肝炎(简称乙肝)的病原体。HBV在世界范围内传播,估计全世界有乙型肝炎患者及无症状HBV携带者达3.5亿人之多,其中有1.2亿在我国。乙型肝炎的危害性比甲型肝炎大,约10%乙型肝炎可转变为慢性肝炎,部分慢性活动性肝炎转变为肝硬化、肝癌,HBV携带者发生原发性肝癌的危险性大。
(一)生物学性状
1.形态与结构 用电子显微镜观察乙型肝炎患者的血清标本,可看到3种不同形态的颗粒(图10-6)。①大球形颗粒:为完整的乙型肝炎病毒,直径为42 nm。具有双层衣壳结构,其外衣壳相当于一般病毒的包膜,由脂质双层与蛋白质构成。内衣壳是20面体立体对称,相当于一般病毒的核衣壳,其内含有病毒的DNA和DNA多聚酶。这种大球形颗粒是Dane于1970年首先发现的,故又称Dane颗粒。②小球形颗粒:大量存在于HBV感染者血流中。直径为22 nm,不含DNA和DNA多聚酶,是HBV在肝细胞内组装过程中过剩的衣壳,不具有传染性。③管形颗粒:直径22 nm,长100~500 nm,成分与小球形颗粒相同。这种颗粒是一串聚合起来的小球形颗粒。
2.基因结构 HBV的DNA为未闭合的环形双股结构,但其中有一段仅为单股。单股区的长短在各病毒体可不等,约为全基因长度的一半。由于HBV的基因结构非常特殊,现已归属于嗜肝DNA病毒科。病毒DNA较短的一股为正股(S+),其长股为负股(L-)。负股DNA核苷酸序列上含有4个开放读框(ORF),均为重叠基因,分别称为S、C、P和X区。S区中有S基因、前S1和前S2基因,分别编码HBV的外衣壳蛋白(HB-s Ag、PreS1与PreS2抗原);C区中有C基因及前C基因,分别编码HBc Ag及HBe Ag;P区最长,编码DNA多聚酶与病毒复制有关;X区中的X基因所编码的蛋白质称为HBx-Ag,可反式激活细胞内的某些癌基因及病毒基因,与肝癌的发生和发展有关(图10-7)。

图10-6 HBV结构示意图

图10-7 HBV基因结构
3.培养与动物模型 HBV至今尚不能在体外细胞中分离及培养,目前采用的细胞培养系统是病毒DNA转染系统。将病毒DNA导入肝癌等细胞后,病毒核酸可整合并复制,在细胞中表达HBs Ag并分泌HBeAg,有些细胞株还可产生Dane颗粒。这些细胞培养系统主要用于过筛抗HBV药物。用S基因转染一些细胞系(如中国地鼠卵巢细胞),可以分泌HBs Ag,而不含病毒其他蛋白,已用于制备疫苗。
4.抗原组成
(1)表面抗原(HBs Ag) 是HBV的外衣壳抗原由S基因编码,其化学成分是糖脂蛋白,相对分子质量为25 000,存在于Dane颗粒外衣壳、小球形和管形颗粒上。因HBs Ag大量存在于感染者血中,故是检查受HBV感染的主要指标。HBs Ag具有免疫原性,是制备疫苗的主要成分,可刺激机体产生具有特异保护性的抗HBs中和抗体(HBs-Ab)。血清中出现HBs-Ab可视为乙型肝炎恢复的标志,一般不具有传染性而具有保护作用,可以防御HBV的感染。
研究证明HBV的外壳除HBs Ag外,还有2种抗原存在,即前S1(Pre-S1)与前S2 (Pre-S2)抗原。由S基因编码,被证明其具有吸附于肝细胞表面的决定基,可使HBV吸附于肝细胞表面,有利于病毒侵入肝细胞内。其免疫原性比HBs Ag更强,可刺激机体产生有中和作用的前S1抗体(PreS1-Ab)和前S2抗体(PreS2-Ab),能通过阻断HBV与肝细胞结合而起抗病毒作用。若乙型肝炎病人血清中出现此类抗体提示病情好转。
(2)核心抗原(HBc Ag) 由C基因转录、转译编码而成。为HBV的内衣壳成分,存在于Dane颗粒核心结构的表面,相对分子质量为22 000。由于HBV以出芽方式从细胞内释放时表面包围有外衣壳(即HBs Ag),故不易在血循环中检出。HBc Ag主要成分是蛋白质,免疫原性强,可刺激机体产生抗-HBc(HBc-Ab)。抗-HBcIgG在血中持续时间较长,为非保护性抗体,抗-HBcIg M的存在常提示HBV正在肝细胞内复制。HBc Ag可在感染的肝细胞表面存在,是CTL识别和攻击的主要靶细胞。
(3)e抗原(HBe Ag) 是由PreC及C基因编码,整体转录及转译后成为e抗原,为可溶性蛋白质,相对分子质量为19 000。HBeAg存在于Dane颗粒核心结构的表面,隐蔽或镶嵌于HBc Ag中,当HBV内衣壳裂解时释放出来,可游离存在于血清中,其消长与病毒体及DNA多聚酶的消长基本一致,是体内HBV复制的指标之一,表明该患者具有较强的传染性。HBe Ag可刺激机体产生抗-HBe,对病毒的感染有一定的保护作用,抗-HBe能与受染肝细胞表面的HBe Ag特异性结合,激活补体而破坏受染的肝细胞。抗-HBe的出现是患者愈后的良好征象。
5.抵抗力 HBV对外界环境抵抗力很强,能耐受低温、干燥、紫外线及70%乙醇。HBV对高压蒸气灭菌法、加热100℃经10 min、0.5%过氧乙酸、3%漂白粉溶液、5%次氯酸钠和环氧乙烷等抵抗力弱,可灭活HBV,消除其传染性,但仍可保留免疫原性。
(二)致病性与免疫性
1.传染源 主要是患者或无症状HBs Ag携带者。乙型肝炎患者不论在潜伏期(较长,30~160 d)、急性期或慢性活动初期,病人血清都有传染性。在乙型肝炎的传播方面,HBs Ag携带者不容忽视,因无症状,故不易被察觉,其作为传染源的危害性比患者更甚。
2.传播途径 HBV的传播途径有多种,但归结起来主要有以下3种。
(1)血液、血制品等传播 人类对HBV极为敏感,而HBV在血流中大量存在,故只需极少量污染血进入人体即可导致感染。输血及血制品、输液、注射、针刺、手术、医院内污染的器械、共用剃刀和牙刷、皮肤和黏膜的微小损伤等均可传播。医务人员可通过接触患者的血液等标本或被污染物品经微小伤口而致感染。
(2)母—婴传播 母亲若为HBV携带者,孕期可经血流感染胎儿,分娩时新生儿经过产道可被感染,哺乳也是传播HBV的途径。人群中50% HBV携带者来自母婴传播,为乙型肝炎的稳定传染源,故乙型肝炎表现为以母亲为核心的家庭聚集倾向。
(3)性传播 从HBV感染者的精液和阴道分泌物中可检出HBV,故配偶为HBs Ag阳性者容易感染HBV。性乱者易受HBV感染。西方国家已将乙型肝炎列为性传播疾病之一。
3.致病性与免疫机制 乙型肝炎临床表现复杂。HBV在肝细胞内增殖,除对肝细胞有轻度直接损害外,其抗原成分诱发机体产生的免疫病理损害是导致肝细胞破坏的主要原因。肝细胞受损程度与机体免疫应答的强弱有关,可由无症状带毒者至急性肝炎、慢性肝炎、重症肝炎等。HBV引起免疫病理损害的机制可能有以下几种。
病毒致机体免疫应答低下HBV感染后可抑制机体的免疫功能,使受染细胞(靶细胞)产生干扰素和IL-2能力下降,并使靶细胞表面HLA-I类抗原的表达减少。因CTL对靶细胞的杀伤需双重识别,既要识别病毒特异性抗原,又要识别HLA-I类抗原,因此,靶细胞HLA-I类抗原表达低下,CTL作用减弱。幼龄感染HBV后,因免疫系统尚未发育成熟,故对HBV产生免疫耐受,成为HBV无症状携带者。免疫功能低下严重了妨碍机体对病毒的消除,使感染迁延不愈。
病毒发生变异HBV的PreC基因可发生变异,不能正确转译出HBe Ag,使病毒逃避机体对HBe Ag特异性免疫的识别和攻击,使感染转为慢性。近年来还发现HBV PreC区及C区的变异株可引起重症肝炎。
抗体介导的免疫病理损害:①Ⅱ型超敏反应,HBV感染肝细胞后,肝细胞膜上出现HBV特异性抗原(HBs Ag、HBc Ag、HBeAg),并可导致肝细胞膜表面自身结构的改变,暴露出肝特异性脂蛋白抗原(LSP)。2种抗原均可诱发机体产生相应抗体(HBV-Ab、LSP-Ab),这些抗体与肝细胞膜上相应的抗原发生特异性结合可激活补体、巨噬细胞、NK细胞,从而溶解破坏被HBV感染的肝细胞;②Ⅲ型超敏反应,血清中小分子HBs Ag、HBe Ag可分别与相应抗体结合形成免疫复合物(IC),中等大小的IC可沉积于肝内或肝外小血管壁基底膜,激活补体,释放多种活性介质,造成血管炎症。慢性肝炎患者常同时伴有肾小球肾炎、关节炎、结节性多发性血管炎等症状。大量IC沉积于肝内,可使肝毛细血管栓塞,并诱导产生肿瘤坏死因子(TNF),导致急性肝坏死,表现为重症肝炎。
细胞介导的免疫病理损害(Ⅳ型超敏反应)HBV感染后,可使肝细胞膜表面存在病毒特异性抗原和LSP抗原,可诱发机体产生细胞免疫,通过CTL直接杀伤作用和Th1参与的迟发型超敏反应,导致肝细胞破坏。
HBV与原发性肝癌关系密切。通过核酸杂交技术,已从肝癌细胞DNA中检出HBV的DNA。流行病学调查也证明人群HBs Ag携带者较无HBV感染者发生肝癌的危险性高217倍。肝癌组织检测发现有HBV DNA的整合,导致细胞转化而发展成肝癌。
HBV所诱发的免疫应答,一方面为免疫保护作用,如抗-HBs对病毒的中和作用、CTL对受染细胞内病毒的清除作用等;另一方面可引起免疫病理损伤。免疫保护和免疫损伤是一个过程的两个方面,两者相互依赖又相互制约引起多样化的临床经过和转归。当HBV感染波及的肝细胞数量不多、免疫功能正常时,特异的CTL可破坏靶细胞,释放至细胞外的HBV则可被抗体中和而清除,临床表现为隐性感染或急性肝炎;相反,若受染的肝细胞为数众多,机体免疫应答过强,短时间内导致大量受染肝细胞破坏、肝功能衰竭时,可表现为重症肝炎;当机体免疫功能低下,不能将病毒完全清除,病毒则持续存在并感染其他肝细胞,则引起慢性肝炎。慢性肝炎造成的肝脏病变又可促进成纤维细胞增生,引起肝硬化。
(三)微生物学检查
HBV抗原抗体的检测方法主要包括HBs Ag、抗-HBs、HBe Ag、抗-HBe及抗-HBc(俗称“两对半”、“五项指标”),因HBc Ag存在于病毒内衣壳上,一般不易检出。HB-s Ag的检测最为重要,可发现无症状携带者,是献血员筛选的必检指标。血清学方法以RIA(放射免疫测定法)和ELISA(酶联免疫吸附试验)最敏感、最常用。
HBV抗原、抗体的血清学标志与临床关系较为复杂,必须对几项指标同时分析,方能有助于临床判断(表10-2)。
表10-2 HBV抗原、抗体检测结果的临床分析

HBs Ag阳性见于急性、慢性乙型肝炎或无症状携带者。急性肝炎恢复后,HBs Ag可在1~4个月内消失,若HBs Ag持续6个月以上,则考虑已转为慢性肝炎。无症状携带者是HBs Ag长期阳性,肝穿刺活检常发现已有病变而无症状者。部分携带者可发病,少部分可发展成肝硬化或肝癌。HBs Ag阳性者具有传染性,应禁止献血,若同时伴有HBe Ag阳性及病毒血症,则传染性更强。
HBeAg阳性提示HBV在体内复制,若HBeAg转为阴性,抗-HBe阳性,表示病毒停止复制,机体已获相应的免疫力,患者将恢复痊愈,但出现PreC区变异株者例外。
抗-HBs阳性常提示患者已恢复或痊愈,效价高者预后更好。
抗-HBcIg M阳性是病毒在体内复制的指标;抗-HBcIgG阳性是既往感染的指标,但出现较晚,且维持多年。
(四)防治原则
1.一般预防 严格筛选献血员;输血及手术器械要进行严格的消毒;提倡使用一次性注射器;患者及病毒携带者的排泄物、用具及食具应彻底消毒。
2.人工自动免疫 接种乙肝疫苗是最有效的预防措施。我国应用的乙肝疫苗是将编码HBsAg的基因在酵母菌、哺乳动物细胞或牛痘苗病毒中高效表达,产生的HBs Ag纯化后制成疫苗。基因工程疫苗具有良好的免疫原性,可以大量制备,费用较低,目前世界各国普遍使用。我国目前规定新生儿和易感人群需接种HBs Ag疫苗。新生儿免疫3次(出生后第0、1、6个月)后,抗-HBs阳性率达90%以上;免疫HBs Ag阳性母亲的婴儿,保护率可达80%以上。
3.人工被动免疫 含高效价抗-HBs的人血清免疫球蛋白可用于被动免疫预防。主要用于以下情况:①医务人员或皮肤损伤时被乙型肝炎患者血液污染伤口者;②母亲为HBs Ag、HBe Ag阳性的新生儿;③发现误用HBs Ag、HBe Ag阳性的血液或血制品者;④HBs Ag、HBeAg阳性者的性伴侣。
乙肝的治疗至今尚无特效方法。抗病毒药物、调节机体免疫功能和改善肝功能的药物联合应用较好。一些抗病毒药物如干扰素、阿昔洛韦、拉米呋啶等对部分HBV患者有一定疗效。
三、丙型肝炎病毒
丙型肝炎病毒(hepatitis C virus,HCV)感染者和隐性感染者是主要传染源,传播途径主要是通过输血及血制品、注射、手术、器官移植等,也可经性接触及母婴传播,医务人员接触病人血液以及医疗操作意外受伤等也可感染。总之,HCV传播途径与HBV相似,为多途径传播。HCV感染后,多数可不出现症状,为HCV携带者,其比率高于HBV,因此,HCV传播的机会比HBV更大,待发病时已呈慢性过程,其症状轻重不等,20%可发展为肝硬化,少数感染者可诱发肝癌。
严格筛选献血员和加强血制品管理、控制输血传播是目前丙型肝炎最主要的预防措施。我国已规定,检测抗-HCV是筛选献血员的必需步骤,对血制品需进行检测以防污染。因HCV免疫原性不强,且易变异,给疫苗的研制带来困难,目前尚无有效的疫苗。目前尚缺乏对丙型肝炎治疗的特效药物。临床药物治疗多采用干扰素、利巴韦林等抗病毒药物,有一定疗效。
四、丁型肝炎病毒
1977年,意大利学者在慢性乙型肝炎患者的肝细胞核内发现除HBc Ag外,还有一种新的抗原,当时称之为δ抗原。通过对黑猩猩实验感染证实这是一种缺陷病毒,必须在HBV或其他嗜肝病毒辅助下才能复制。现已正式命名为丁型肝炎病毒(hepatitis D vi-rus,HDV)。
HDV的传染源、传播途径与HBV相同,其感染常发生于乙型肝炎患者或HBs Ag携带者中。主要通过输血或使用血制品传播,也可通过密切接触或母婴垂直传播。由于HDV为一种缺陷病毒,因此,急性丁型肝炎具有2种感染方式:一是联合感染(共同感染),即同时感染HBV和HCV,发生急性乙型肝炎和急性丁型肝炎;另一方式是重叠感染,即先有HBV或其他嗜肝DNA病毒感染。这2种感染方式常导致感染症状加重,使病情恶化,故在重症肝炎发生时,应注意有无HDV的重叠感染。HDV的致病机制与免疫尚不清楚。
丁型肝炎预防原则与乙型肝炎相同。严格筛选献血员和血制品可防止HDV医源感染。接种HBV疫苗也可预防丁型肝炎。抑制HBV的药物也能控制HDV的复制。
五、戊型肝炎病毒
戊型肝炎病毒(hepatitis Evirus,HEV),曾称为经消化道传播的非甲非乙型肝炎病毒。HEV的主要传染源是潜伏期末和急性期初的病人,因此期粪便排毒量最大,传染性最强。病毒主要经粪—口途径传播,常因病人的粪便污染水源和食物所致。有明显的季节性,常在雨季或洪水过后流行。潜伏期为10~60 d。HEV经胃肠道进入血液,在肝细胞内复制,经肝细胞释放到血液和胆汁中,然后经粪便排出体外,污染水源、食物和周围环境而传播。人感染后可表现为亚临床型或临床型(成人多见)。HEV的致病机制与HAV相似,病毒通过对肝细胞的直接损伤和免疫病理作用,引起肝细胞的炎症或坏死,临床上表现为急性戊型肝炎(包括黄疸型和无黄疸型)、重症肝炎(死亡率高)及胆汁淤滞性肝炎。青壮年对HEV易感。多数患者于发病后4~6周内恢复并痊愈,不发展为慢性。孕妇感染HEV后,病死率高达10%~20%,并发生流产或死胎。
预防HEV感染主要是以切断传播途径为主的综合性预防措施,包括保护安全用水、防止食物被粪便污染、加强食品卫生管理、讲究个人卫生和提高环境卫生水平。目前尚无有效的HEV疫苗。普通免疫球蛋白预防HEV感染有效。
六、庚型肝炎病毒
庚型肝炎病毒(hepatitis Gvirus,HGV)的传染源是庚型肝炎病人及HGV慢性携带者;其传播途径同HBV和HCV,主要经输血等非肠道途径传播;HGV所引起的庚型肝炎其病理特征是肝细胞索被融合肝细胞代替,出现融合巨细胞;HGV单独感染时症状不明显,肝脏损害较轻,黄疸少见,发展为慢性肝炎的较丙型肝炎少;HGV常与HBV或HCV发生重叠感染后引起的病毒血症持续时间较长,表现为HGV慢性携带者。
七、TTV病毒
TTV病毒为无包膜的单负链环状DNA病毒。病毒体呈球形,直径为30~32 nm。TTV病毒可以经血液、粪—口途径、唾液、精液和多途径传播。TTV病毒感染呈全球性分布,人群感染率很高。欧美等国家献血者的感染率为33%~93%,亚洲、非洲和南美洲正常献血员的感染率为80%~100%。TTV病毒感染一般表现为无症状携带者,病毒长时间存在甚至终生携带,尚未发现TTV病毒有引起感染或其他疾病的能力。
第四节 疱疹病毒
疱疹病毒(herpesvirus)属疱疹病毒科,现已发现有110种以上。其共同特点有:病毒呈球形,是一群中等大小、有包膜的DNA病毒,直径为120~300 nm;除EB病毒外,人疱疹病毒均能在人二倍体细胞核内复制,并形成核内嗜酸性包涵体、多核巨细胞等病变;病毒可通过呼吸道、消化道、泌尿生殖道等侵入宿主细胞,表现为增殖性感染和潜伏状态,前者病毒增殖并引起细胞破坏,后者病毒不增殖,其DNA稳定地潜伏于细胞核内,基因表达受抑制,当病毒受刺激因素激活或抵抗力下降时又可转为增殖性感染而引起疾病;病毒可通过垂直感染胎儿和新生儿,造成胎儿畸形、流产或死产,出生者可有发育迟缓、智力低下;除水痘外,原发感染多为隐性感染。引起人类疾病的疱疹病毒主要有:EB病毒、巨细胞病毒、单纯疱疹病毒、水痘-带状疱疹病毒等。
一、单纯疱疹病毒
单纯疱疹病毒(herpes simplex virus,HSV)主要引起皮肤、黏膜疱疹疾病,也可引起三叉神经炎、小儿脑膜脑炎等。
1.血清型 HSV-1和HSV-2,2型病毒的DNA有50%同源性,即2型病毒有共同的抗原成分,也有不同的型特异性抗原成分。HSV宿主范围广,常用的实验动物有家兔、豚鼠、小鼠等;体外培养可感染多种细胞,病毒复制周期短,感染细胞很快发生肿胀、变圆、出现嗜酸性核内包涵体等典型细胞病变。
人群中HSV感染率为80%~90%,传染源是病人和健康带毒者,直接密切接触与性接触为主要传播途径。
2.原发感染 6个月以后的婴儿易发生HSV-1的原发感染,常引起龈口炎、咽颊部黏膜产生成群疱疹、疱疹性角膜结膜炎或疱疹性脑炎等;HSV-2主要引起生殖器疱疹。
3.潜伏与再发感染 HSV原发感染后,机体迅速产生特异性免疫力而康复,但不能彻底消除病毒,病毒从侵入部位沿感觉神经髓鞘上行至感觉神经节。HSV-1潜伏于三叉神经节和颈上神经节;HSV-2潜伏于骶神经节。当机体受到各种非特异性刺激(如发热、寒冷、日晒、月经期、某些细菌和病毒感染等)或免疫功能降低时,潜伏病毒被激活,沿感觉神经纤维轴索下行到末梢部位的上皮细胞内继续增殖,导致局部疱疹复发。
避免与患者接触或给易感人群注射特异性抗体,可减少HSV传播的危险。目前尚无特异性预防方法。常规抗病毒药物的作用直接针对RNA聚合酶,难以清除潜伏状态的病毒。近年来的研究表明无环鸟苷及其衍生物脱氧鸟苷本身低毒,可选择性抑制HSV的复制,能够抑制HSV感染的复发。如果孕妇产道发生HSV-2感染,在羊膜未破时采用剖腹产,可预防新生儿疱疹感染。分娩后给新生儿注射特异性抗体或丙种球蛋白也可作为紧急预防措施。在治疗方面,用5-碘脱氧尿嘧啶核苷、阿糖胞苷等治疗疱疹性角膜炎疗效较好。
二、水痘-带状疱疹病毒
水痘-带状疱疹病毒(varicella-zoster virus,VZV)在儿童初次感染时引起水痘,潜伏多年后在成年人中复发则表现为带状疱疹,故称为水痘-带状疱疹病毒。
VZV只有一个血清型,其基本特性与HSV相似。病毒只能在人胚成纤维细胞中增殖并缓慢地产生局灶性细胞病变,受染细胞出现嗜酸性核内包涵体和多核巨细胞。
人是VZV的唯一自然宿主,主要的靶细胞是皮肤。病毒经呼吸道侵入人体,儿童初次感染(因无特异性免疫力)后约经2周潜伏期,全身皮肤出现斑丘疹、水疱疹,可发展为脓疱疹。皮疹分布呈向心性,病情较轻,偶有并发病毒性脑炎或肺炎。但在细胞免疫缺陷、白血病或正在接受皮质激素治疗的病儿,则常易患重症水痘。成人首次感染VZV者,常引起病毒性肺炎,病情较重,死亡率较高;孕妇患水痘的表现亦较重,可引起胎儿畸形、流产或死胎。
儿童患水痘后,因机体获得持久的特异性免疫,可阻止病毒再感染,而对于已潜伏在脊髓后根神经节或颅神经节内的病毒,则不能有效地发挥清除作用。成年以后机体受到有害因素刺激或细胞免疫功能降低等因素,潜伏病毒可被激活,沿感觉神经轴索到达所支配的胸腹或面部皮肤细胞内增殖而引起复发。由于疱疹沿感觉神经支配的皮肤分布,串联成带状,故称带状疱疹。
VZV减毒活疫苗在预防水痘感染和传播方面有良好效果,经免疫的幼儿所产生的体液免疫和细胞免疫可维持几年。应用含特异抗体的人免疫球蛋白,也有预防效果。无环鸟苷、阿糖腺苷、阿昔洛韦和大剂量干扰素可限制免疫功能低下患者的病情发展并缓解局部症状。
三、巨细胞病毒
巨细胞病毒(cytomegalovirus,CMV)是引起新生儿巨细胞包涵体的病原体,由于感染细胞肿胀明显,并具有巨大的核内包涵体,故称为巨细胞病毒。
CMV种属特异性高,即人CMV只能感染人。在体内人CMV可感染各种不同的上皮细胞、白细胞和精子细胞等;但在体外培养只能在人成纤维细胞中增殖。其特征是:病毒复制周期长、增殖缓慢,细胞肿胀、核变大并形成巨大的核内嗜酸性包涵体。
CMV在人群中感染非常广泛,多为隐性感染,虽可产生抗体,但多数可长期带毒成为潜伏感染。潜伏部位常在唾液腺、乳腺、肾、白细胞或其他腺体中,并可长期或间歇地从唾液、乳汁、尿液、精液或宫颈分泌物中排出,通过口腔、生殖道、胎盘、哺乳、输血、器官和骨髓移植等多种途径传播。临床表现:先天性感染是造成胎儿畸形的最常见病毒,患儿可表现为巨细胞包涵体病(肝脾肿大、黄疸、血小板减少性紫癜、溶血性贫血等)、先天畸形(小头、耳聋、智力低下等),重者可致流产或死胎;后天感染可引起单核细胞增多症和肝炎、间质性肺炎等。此外,CMV与子宫颈癌和结肠癌的发病有关。
近年应用ELISA检测CMV的Ig M抗体,可辅助诊断CMV的近期感染。若从新生儿血清中检出CMV的Ig M抗体,提示胎儿有宫内感染。丙氧鸟苷是无环鸟苷类似物,能抑制CMV的DNA聚合酶,缓解其感染导致的视网膜炎、食管炎等。国外研制的CMV减毒活疫苗已问世,能诱导机体产生抗体,在高危人群中使用有一定保护作用。但如何排除疫苗潜在的致癌性,还有待进一步研究。
四、EB病毒
EB病毒(Epstein-Barr virus,EBV)是1964年Epstein和Barr从非洲儿童恶性淋巴瘤的培养细胞中发现的一种新病毒。EBV是传染性单核细胞增多症的病原体。现已证实EBV与鼻咽癌关系密切。
EBV在电镜下其形态与疱疹病毒相似,但免疫原性不同。EBV在人群中感染非常普遍,我国3~5岁儿童的EBVIgG/VCA抗体阳性率达90%以上,感染后多数无明显症状或引起轻度咽炎和上呼吸道感染。青春期发生原发感染,约有50%出现单核细胞增多症。EBV主要通过唾液传播,偶见经输血传播。感染后病毒可能先侵犯口咽部上皮细胞,并在其中形成增殖性感染,释放出的病毒再感染局部黏膜的B细胞,后者进入血循环而引起全身性EBV感染。与EBV感染有关的疾病主要有:①传染性单核细胞增多症,是一种急性全身淋巴细胞增生性疾病,在青春期初次感染较大量EBV时可发病;②非洲儿童恶性淋巴瘤,多见于6~7岁儿童,发生于非洲中部和新几内亚某些热带林区;③鼻咽癌,EB病毒对鼻咽黏膜细胞有特殊亲嗜性,流行病学研究表明与鼻咽癌的发病有密切关系,该病多发于40岁以上的中老年人,是广东、广西和湖南等地的一种常见的恶性肿瘤。
EB病毒通过人与人之间直接接触而传播。应用病毒特异性抗原进行主动免疫,有可能预防Burkitt淋巴瘤和鼻咽癌的发生。EB病毒的DNA聚合酶对无环鸟苷敏感,因此无环鸟苷和丙氧鸟苷可抑制EB病毒的复制。
第五节 人类免疫缺陷病毒
人类免疫缺陷病毒(human immunodeficiency virus,HIV)是获得性免疫缺陷综合征(acquired immunodeficiency syndrome,AIDS)的病原体。艾滋病即AIDS的音译。HIV在分类学上属逆转录病毒科,慢病毒亚科。HIV主要有2型:HIV-Ⅰ与HIV-Ⅱ,前者流行于全球,后者只在西非呈地区性流行。
AIDS病例1981年由美国疾病控制中心首次报告后迅速在全球流行,1984年证实其病原为HIV。据联合国艾滋病规划署报告,截止2005年底该病毒感染者全球总人数已达4030万,仅2005年度就有310万人死于艾滋病,其中57万是15岁以下的儿童,严重威胁着人类的身心健康,人类面临着艾滋病的严重挑战。
一、生物学性状
1.形态与结构 HIV呈球形,直径为100~120 nm,核心为2条单股正链RNA,并含有逆转录酶、蛋白酶和整合酶。包裹其外的是衣壳蛋白(p24)、核心和p24共同构成圆柱状的核衣壳。HIV有包膜,包膜内有由p17组成的内膜,包膜中嵌有两种特异性糖蛋白gp120和gp41,前者构成包膜表面的刺突,后者为跨膜蛋白(图10-8)。

图10-8 HIV结构模式图
2.培养特性 HIV感染宿主范围和细胞范围比较狭窄,仅感染表面有CD4+分子的细胞。因此实验室常用外周血T细胞经有丝分裂原(如PHA)激活后,与疑有HIV感染的淋巴细胞混合,培养2~4周后分离病毒。HIV感染的动物模型是恒河猴和黑猩猩,但其感染过程与产生的症状与人类不同。
3.抵抗力 HIV抵抗力较弱,加热56℃、30 min可被灭活。用0.2%次氯酸钠、0.1%漂白粉、70%乙醇、0.3% H 2 O2、50%乙醚或0.5%来苏儿处理,均可在5~10 min灭活。HIV在20~22℃室温中可保存活力达7 d,在23~28℃室温液体(如血液)环境中可存活15 d以上。紫外线对HIV杀灭作用不强。
二、致病性与免疫性
1.传染源和传播途径 艾滋病的传染源是艾滋病患者和HIV无症状携带者。HIV可存在于血液、精液、阴道分泌物、乳汁、唾液、骨髓、脑脊液、皮肤及中枢神经组织等标本中,故主要的传播方式有3种:①性传播,通过异性或同性间的性行为传播;②血液传播,输入含有HIV的血液或血制品、器官或骨髓移植、静脉药瘾共用污染的注射器及针头、人工授精等传播;③母婴传播,HIV可经胎盘、产道或经哺乳等方式传播。
2.感染过程与致病机制 HIV初次感染人体后,病毒通过gp120刺突选择性地与带有CD4+分子的T细胞(以Th细胞为主)等结合而穿入细胞内,经逆转录合成的双股DNA以前病毒的形式整合到宿主细胞染色体上。前病毒活化可转录成病毒子代RNA 与mRNA,病毒的mRNA在胞质核蛋白体上翻译出子代病毒蛋白,然后装配成子代病毒,以出芽的方式释放到细胞外。此时感染者血循环中CD4+T细胞数减少和HIV量增多,感染者可不出现症状或出现发热、咽炎、淋巴结肿大、皮肤斑丘疹和黏膜溃疡等自限性症状,此即为HIV的原发感染期。经数周后转入较长时间的慢性感染期,此期感染者可不表现临床症状而处于临床潜伏期(3~5年或更长),病毒以较低水平的慢性增殖、持续感染状态存在,并不断少量释放入血循环中。随着感染时间的延长,当机体受到各种刺激(如有丝分裂原、细菌、真菌、其他病毒感染等),激发HIV大量增殖。病毒的增殖可影响CD4+细胞的正常生物合成;病毒的出芽释放导致细胞膜损伤;病毒感染细胞可与周围未受感染的CD4+细胞融合,形成多核巨细胞而导致细胞死亡;受染细胞表达病毒抗原可被特异性CTL识别并杀伤;同时病毒可诱导自身免疫使T细胞损伤或功能障碍等。从而引起以CD4+细胞(Th细胞为主)缺损和功能障碍为中心的严重免疫缺陷。Th细胞大量减少,而CD8+T细胞(CTL或Ts)相对增多,出现CD4+/CD8+比例倒置,巨噬细胞和NK细胞功能下降,引起严重细胞免疫缺陷,并影响到CD4+细胞有关的体液免疫功能。
综合上述致病机制,患者抗感染能力明显下降,可迅速发展为艾滋病相关综合征和全身持续性淋巴结病综合征。患者表现为全身持续性淋巴结肿大,不规则发热、乏力、盗汗、体重减轻、长期腹泻、厌食及各种神经症状等。艾滋病的晚期,感染者免疫功能被严重破坏,以致发生各种机会性感染和恶性肿瘤,临床表现复杂,是艾滋病患者死亡的主要原因。
3.免疫性 机体感染HIV后,诱发机体产生的特异性免疫,包括有抗gp120中和抗体的保护作用,在初发期感染可降低血清中的病毒抗原量,但不能清除病毒;特别是CTL 对HIV感染细胞的杀伤和阻止病毒间的扩散有重要作用,但CTL亦不能清除有HIV潜伏感染的细胞。因此,HIV一旦感染,便终生携带病毒。
三、微生物学检查及防治原则
1.微生物学检查
(1)检测病毒抗体 常用的血清学方法有ELISA、胶乳凝集试验,可作为常规筛选HIV抗体阳性病人。
(2)检测病毒核酸或抗原用RT-PCR法检测HIV基因,已被应用于HIV感染早期诊断及艾滋病的研究中。
(3)病毒分离 从患者体内直接分离出HIV是确诊的最直接证据,但病毒分离需严格的工作条件,且需时间长、价格昂贵,故不宜用于临床诊断。
四、预防措施
1.一般预防 由于艾滋病的高度致死性与惊人的蔓延速度,WHO和许多国家都制订实施了预防HIV感染的综合措施:①开展广泛的卫生宣传教育,普及艾滋病预防知识,认识其传播方式及其严重危害性,杜绝吸毒和性滥交;②建立HIV感染和AIDV的检测系统,掌握流行动态,对高危人群实行监测,严格管理AIDS人及HIV感染者;③对供血者进行HIV抗体检查,确保输血和血制品的安全性;④加强国境检疫,严防传入。
2.特异性预防 迄今尚无理想疫苗。由于HIV变异性大,且以前病毒形式潜伏在体内,从而给疫苗研制造成困难,迄今,对AIDS的特异性预防尚缺乏理想的疫苗。
3.抗病毒治疗 AIDS的治疗无特效药物,目前临床上用于治疗AIDS的药物分为三类:①核苷类逆转录酶抑制剂,如叠氮胸苷等;②非核苷类逆转录酶抑制剂,如地拉韦定等;③蛋白酶抑制剂,如塞科纳瓦等。常使用联合疗法。联合疗法的优点是能迅速降低病人血浆中HIV-RNA载量至极底水平,延缓HIV病情的发展,延长病人的寿命。
第六节 其他病毒
一、狂犬病病毒
狂犬病病毒(rabies virus)是狂犬病的病原体。该病毒主要在野生动物及家畜中传播,人被病畜咬伤后受感染。狂犬病是一种中枢神经系统的急性传染病,也是目前我国病死率最高的传染病,至今尚无有效的治疗方法,一旦发病,病死率近乎100%。
(一)生物学性状
病毒外形呈子弹状,大小为75 nm×180 nm;核心为单股负链RNA,外绕螺旋对称的蛋白衣壳;有包膜,包膜上有糖蛋白刺突,与病毒的感染性和毒力相关。狂犬病病毒感染动物范围较广。在易感动物(如狼、狐狸、犬、猫等)或人的中枢神经细胞(主要是大脑海马回的锥体细胞)中增殖时在胞质内形成嗜酸性包涵体,称内基小体,在诊断上很有价值。
(二)致病性与免疫性
狂犬病病毒存在于患病的动物或带病毒动物唾液中,是重要的传染源,人被患病或带病毒动物咬伤、抓伤而感染,病毒通过伤口进入体内。潜伏期一般为1~3个月,但也有短至1周或长达数年才出现症状者,潜伏期长短取决于被咬伤部位与头部的远近及伤口内感染的病毒数量。进入体内的病毒先在肌纤维细胞中增殖,再由神经末梢沿神经轴索上行至中枢神经系统,在神经细胞内增殖并引起中枢神经系统损伤,然后又沿传出神经扩散至唾液腺和其他组织(包括泪腺、鼻黏膜、舌味蕾、肝、肺等)。典型的临床表现是神经兴奋性增高,病人吞咽或饮水时喉头肌肉发生痉挛,甚至闻水声或其他轻微刺激均可引起痉挛发作,故称恐水病。这种兴奋期经3~5 d后,病人由兴奋转入麻痹期,最后因昏迷、呼吸、循环衰竭而死亡。病死率几乎达100%。动物研究表明,机体感染狂犬病病毒后能产生细胞免疫和中和抗体。这种特异性免疫在狂犬病疫苗接种后诱生的抗狂犬病病毒感染性免疫机制中起重要作用,但病毒若已侵入中枢神经系统则无保护作用。
(三)微生物学检查
人被犬或其他动物咬伤后,应捕获动物隔离观察,若经7~10 d不发病,一般可认为该动物不是狂犬病或咬人时唾液中尚无狂犬病病毒。若观察期间发病,即将其杀死,取脑海马回部位组织涂片,用免疫荧光抗体法检查抗原,同时做组织切片检查内基小体。
对狂犬病患者的诊断可取唾液沉渣涂片、睑及颊皮肤活检,用免疫荧光抗体法检测病毒抗原,但阳性率不高。最近应用逆转录PCR法检测标本中的狂犬病病毒RNA,此法敏感、快速、特异性高,值得在有条件的实验室推广应用。
(四)防治原则
狂犬病一旦发生难以治愈,因此狂犬病的预防十分重要。主要预防措施是加强家犬管理,捕杀野犬,注射犬用疫苗。人被动物咬伤后应立即采取下列措施。
1.处理伤口 立即用20%肥皂水、0.1%新洁尔灭或清水反复冲洗伤口,再用70%乙醇和碘酒涂擦。
2.人工被动免疫 用高效价抗狂犬病病毒血清浸润注射于伤口周围及底部并同时肌内注射。
3.人工自动免疫 狂犬病的潜伏期一般较长,人被咬伤后如及早接种高效狂犬疫苗,可以预防发病。我国现使用地鼠肾原代细胞或二倍体细胞培养制备的灭活病毒疫苗,免疫效果好,副作用小。应用痘苗病毒或腺病毒作为基因载体,构建表达狂犬病病毒G蛋白的重组疫苗,目前正处于试用阶段,其效果和安全性尚待进一步研究确定。
二、虫媒病毒
虫媒病毒(arbovirus)又称为节肢动物媒介病毒(arthropod borne virus),是指一大类通过吸血的节肢动物叮咬人、家畜及野生动物而传播疾病的病毒。虫媒病毒需在敏感的节肢动物体内繁殖,但对节肢动物不致病。大多数虫媒病毒具有自然疫源性,现已发现对人致病的达100多种,其中在我国以流行性乙型脑炎病毒、登革病毒、森林脑炎病毒为主,它们均归类于为黄病毒科。
(一)流行性乙型脑炎病毒
流行性乙型脑炎病毒(epidemic type B encephalitis virus),简称乙脑病毒,是引起流行性乙型脑炎(简称乙脑)的病原体。
1.生物学性状 乙脑病毒呈球形,直径约为40 nm。核心含有单正链RNA。病毒包膜表面有糖蛋白刺突,即血凝素,能凝集鸡、鹅、羊等动物红细胞。包膜内还有内膜蛋白参与病毒的组装。乙脑病毒免疫原性稳定,只有一个血清型。此病毒抵抗力弱,对理化因素均敏感,加热56℃、30 min可灭活;碘酊、石炭酸、来苏儿等常用消毒剂均能使其灭活。
2.致病性与免疫性 乙脑病毒的传染源是家畜、家禽、野生动物,特别是幼猪是最重要的传染源,病人及隐性感染者也可成为传染源。传播途径是经传播媒介蚊子叮咬而感染人和动物。乙脑病毒主要由库蚊传播,在我国乙脑流行的高峰期是6~9月份,主要与带病毒蚊出现的早晚和密度有关。蚊虫可携带病毒越冬,且能经卵传代,故蚊不仅是传播媒介,还可能是病毒的长期储存宿主。
乙脑病毒侵入人体后,先在局部血管内皮细胞及局部淋巴结中增殖,随后少量病毒入血形成第一次病毒血症。病毒随血流播散到肝、脾单核/巨噬细胞内继续大量增殖,病毒再次入血流形成第二次病毒血症,引起发热等全身不适。多数呈隐性感染,少数病人病毒可穿过血脑屏障而进入中枢神经系统,引起脑实质及脑膜病变,临床表现为高热、剧烈头痛、呕吐、颈项强直、嗜睡或昏迷等症状。死亡率高,幸存者可遗留智力减退、痴呆、偏瘫、失语等后遗症。病后及隐性感染均可获得持久免疫力,主要依赖体液免疫的中和抗体。完整的血脑屏障和细胞免疫功能对防止病毒进入脑组织也很重要。
(二)登革病毒
登革病毒(dengue virus)是引起登革热的病原体。登革热是一种由伊蚊传播的急性传染病,于热带、亚热带地区,特别是东南亚、西太平洋、中南美洲有流行。我国广东、海南以及广西等地区均有发生。
登革病毒形态结构与乙脑病毒相似。根据免疫原性不同分为4个血清型,各型病毒间有交叉抗原。病毒可在多种组织细胞中增殖培养(如地鼠肾细胞等哺乳动物细胞、伊蚊传代细胞),可产生明显的细胞病变。
登革病毒的自然宿主是人和猴,病人为主要传染源。病毒经蚊叮咬进入人体,先在毛细血管内皮细胞和单核细胞中增殖,随后经血流播散,引起发热、肌肉和关节剧痛(故俗称断骨热)、淋巴结肿大、皮肤出血(表现淤点和淤斑)及休克等症状。初次感染为普通型登革热,症状较轻,约1周内恢复;再次感染者为登革出血热/登革休克综合征,症状重,病死率高,其发生机制尚未完全清楚,多数学者认为是免疫病理反应起重要作用。
(三)虫媒病毒的防治原则
虫媒病毒是由媒介节肢动物传播引起。因此,消灭媒介节肢动物,搞好个人防护,是切断传播途径、保护易感人群的首要措施。如防蚊灭蚊、防蜱灭蜱是预防乙型脑炎、登革热及森林脑炎的重要环节。
人工自动免疫预防乙型脑炎,目前普遍使用的主要是灭活疫苗,对9个月~10岁以下儿童大规模进行乙脑疫苗接种,接种后血清中和抗体阳转率达50%~80%,保护率为60%~90%;近年我国用地鼠肾组织培养而制成的乙脑减毒活疫苗,接种于15岁以下儿童,接种后中和抗体阳转率达85%,并能有效地降低乙型脑炎的发病率。流行区对幼猪接种疫苗,有可能控制乙脑病毒在猪群及人群中的传播与流行。登革病毒疫苗正在研制阶段。
目前乙脑治疗仍采用对症处理及支持疗法。病毒唑、干扰素、恢复期血清等治疗措施可减轻症状,但对已出现脑炎症状者则无治疗效果。我国采用高中和活性的乙脑单克隆抗体具有明显的治疗效果。
三、出血热病毒
流行性出血热是由不同科属的多种病毒引起,以发热、出血为主要临床特征,属于自然疫源性疾病。我国已发现的有汉坦病毒、新疆出血热病毒、登革病毒。
(一)汉坦病毒
汉坦病毒(hantaviruses)于1978年从韩国汉滩河附近流行性出血热疫区捕获的黑线姬鼠中分离出。分为14个型,其中与人类疾病关系密切的有6个型。
汉坦病毒是引起汉坦病毒肾综合征(hantavirus fever with renal syndrome,HFRS)和汉坦病毒肺综合征(hantavirus pulmonary syndrome,HPS)的病原体。本病毒引起的疾病主要流行于欧亚大陆,HFRS在我国主要集中在东北三省、长江中下游和黄河下游各省。流行范围大,危害严重,习惯称流行性出血热。HFRS以发热、出血和肾损伤为特征。HFRS有明显的地区性和季节性,发病的高峰与鼠类的分布和活动有关。国内已查出20余种啮齿动物自然携带病毒,为主要传染源,其唾液、粪便、尿液可排出病毒污染环境,人或动物(猫、犬等)经呼吸道、消化道或直接经皮肤伤口接触而感染。HPS是以肺组织的急性出血、坏死为主,病理变化为肺水肿、胸膜渗出液增多等。
(二)新疆出血热病毒
此病毒是从我国新疆塔里木盆地出血热病人的血液和尸体的肝、脾、肾以及在疫区捕获的硬蜱中分离到的。病毒呈球形或椭圆形,直径90~120 nm。病毒结构、培养特性和抵抗力与汉坦病毒相似,但免疫原性、传播方式、致病性却不相同。
新疆出血热是一种自然疫源性疾病,有严格的地区性和明显的季节性,主要分布于有硬蜱活动的荒漠牧场。硬蜱是传播媒介,病毒在蜱体内增殖并能经卵传给后代,故蜱亦是储存宿主。每年4~5月份蜱大量增殖,也是新疆出血热的发病高峰期。野生啮齿动物及家畜是重要的传染源。人被带病毒硬蜱叮咬后,经5~7 d的潜伏期,患者表现发热、全身疼痛、中毒症状和出血。病后机体产生多种特异性抗体,可获持久免疫力。
微生物学检查方法与汉坦病毒基本相同。我国已研制成功精制的灭活乳鼠脑疫苗,该疫苗安全,但其预防效果尚待确定。
四、人乳头瘤病毒
乳头瘤病毒包括人乳头瘤病毒(human papilloma virus,HPV)和多种动物的乳头瘤病毒。HPV主要侵犯人的皮肤和黏膜,导致不同程度的增生性病变,引起良性疣和纤维乳头瘤,某些型别可引起组织癌变。
HPV呈球形,直径为52~55 nm,无包膜。病毒核心为双链环状DNA。病毒衣壳蛋白呈20面体立体对称,由72个壳粒组成,每个壳粒又由两种结构蛋白构成。
HPV具有宿主和组织特异性,仅对人的皮肤及黏膜上皮细胞具有高亲和力,因此人类是HPV的唯一自然宿主。HPV的传播主要通过直接接触感染者的病变部位或间接接触被病毒污染的物品。生殖器感染主要有性接触传播;婴幼儿发生尖锐湿疣的增多趋势,多系新生儿在分娩过程中或出生后与母体密切接触时被感染所致;少数患者则可通过内裤、浴巾、浴盆等生活用品感染。病毒感染仅局限于局部皮肤和黏膜中,不产生病毒血症。
HPV所致感染性疾病的潜伏期通常为3个月,也有短至1个月或长达6个月以上者。男性生殖器(阴囊少见)及周围皮肤,女性外阴、阴道、宫颈及肛周等部位均是疾病的好发部位。临床表现可因病变发生部位的不同而异,在皮肤与黏膜交界处可见多发性乳头瘤样或疣状损伤;在温度较低和干燥部位则表现为小而扁平的疣状改变;温暖潮湿部位的病变常呈丝状或乳头样,易融合成团。HPV在细胞内的存在方式与细胞发生癌变的可能性相关。
HPV引起性传播疾病,加强性安全教育和社会管理,对控制感染、减少生殖器疣和宫颈癌的发生有重要意义。目前尚无有效疫苗,预防HPV感染最有效的方法,目前仍然是避免与感染组织的直接接触。疣可自行消失,但需数月乃至数年的时间,故常采用人工干预的办法。对疣主要采用局部治疗方法,包括冷冻、激光、电灼、外科手术及局部涂药除疣。这些方法可将局部病灶去除,但不能根除周围正常组织中的病毒,因此常可复发。此外,注射干扰素同样是临床应用的有效方法,但对喉乳头状瘤必须采取外科手术切除。
小 结
本章主要介绍了呼吸道感染病毒、肠道感染病毒、肝炎病毒、疱疹病毒、人类免疫缺陷病毒及其他病毒。呼吸道感染病毒是通过呼吸道感染的一大群病毒的总称,常见的包括流行性感冒病毒、禽流感病毒、冠状病毒、麻疹病毒、流行性腮腺炎病毒、风疹病毒等。流感病毒是流感的病原体,流感抗原性极易发生变异,故流感病毒常引起大规模流行,根据变异幅度分为抗原漂移和抗原转变两种变异。肠道病毒是一类通过粪—口途径传播,经过消化道感染,在肠道外发病的病毒。肠道病毒主要介绍了脊髓灰质炎病毒、柯萨奇病毒、埃可病毒及轮状病毒,其中轮状病毒是引起秋季腹泻的一类病毒。肝炎病毒是指以侵害肝脏为主的一组病原体,人类肝炎病毒主要包括HAV、HBV、HCV、HDV、HEV,其中HBV在我们国家的病毒携带率及发病率最高,应引起高度重视,其传播途径有血液和血制品、母—婴传播及性传播。疱疹病毒中介绍了单纯疱疹病毒、水痘-带状疱疹病毒、巨细胞病毒及EB病毒。人类免疫缺陷病毒是获得性免疫缺陷综合征(HIV)的病原体。HIV的传播途径有性传播、血液传播及母—婴传播。其他病毒中主要介绍了狂犬病毒及虫媒病毒等,狂犬病一旦发作,病死率近达100%,因此对于狂犬病来说重在预防,一旦被狂犬咬伤及时接种疫苗是预防狂犬病的关键。
(王玉红)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















