第七章 免疫应答
学习目标
1.掌握免疫应答的概念、类型、基本过程;掌握T、B淋巴细胞对抗原的识别;掌握T、B淋巴细胞活化的双信号;掌握效应T细胞的作用。
2.熟悉TD-Ag的免疫应答过程、抗体产生的一般规律及意义。
3.了解TI-Ag的免疫应答过程。
第一节 免疫应答概述
抗原物质进入机体后激发免疫细胞活化、增殖、分化和产生效应的过程称为免疫应答(immune response)。
免疫应答最基本的生物学意义是识别“自己”和“非己”,从而清除体内的抗原性异物,以保持内环境的相对稳定。但在某种情况下,免疫应答也可能对机体造成损伤,引起超敏反应性疾病或其他免疫相关性疾病。
一、免疫应答的类型
体内存在两种免疫应答:一种是机体遇到抗原后,首先迅速起防御作用的天然免疫应答,即非特异性免疫应答,是生物体在长期种系发育和进化过程中逐渐形成的一系列防御功能。另一种是在接受抗原刺激后产生的,是在非特异性免疫应答的基础上所建立的,即特异性免疫应答,又称为获得性免疫应答。
特异性免疫应答又可根据其效应机制分为:B细胞介导的体液免疫应答和T细胞介导的细胞免疫应答。
机体免疫应答的类型取决于抗原的质和量,以及机体免疫功能状态和反应性。正常情况下,机体对“非己”抗原产生正应答,以免遭外源性抗原侵害;机体对自身抗原则产生负应答,即免疫耐受,以保护组织器官不受自身免疫系统攻击而发生异常。上述两种情况下均属于生理性免疫应答,对机体有保护作用。但在某种情况下,机体免疫应答也可发生异常:若对非己抗原应答过强,可至超敏反应;应答过弱,或形成耐受,则导致免疫功能低下或缺失,易发生严重感染或肿瘤;若对自身抗原产生正应答,则导致自身免疫病。这些均属于病理性免疫应答。
二、免疫应答的过程和场所
淋巴结、脾脏等外周免疫器官是抗原特异性T/B淋巴细胞接受抗原刺激发生免疫应答的主要场所。抗原经血流或淋巴循环进入脾脏或进入引流淋巴结后,可被脾脏边缘区的巨噬细胞和淋巴结中的树突状细胞、并指状细胞等抗原提呈细胞(APC)捕获,经加工处理后以抗原肽-MHC-Ⅰ类/Ⅱ类分子复合体的形式表达于APC表面,供相应T/B淋巴细胞识别结合,产生体液和(或)细胞免疫应答。
体内和体外的实验已证明,B细胞介导的体液免疫和T细胞介导的细胞免疫,这两种免疫应答的产生都是由多细胞系完成的,包括单核-吞噬细胞系、T细胞和B细胞等。所以免疫应答过程不是单一细胞系的行为,而是多细胞系相互作用的复杂行为。这一过程可人为的分为以下三个过程。
1.识别活化阶段 是指抗原递呈细胞(APC)加工处理、递呈抗原和抗原特异性T/B淋巴细胞识别抗原后,在细胞间黏附分子协同作用下,启动活化的阶段,又称抗原识别阶段。
2.增殖分化阶段 是指抗原特异性T/B淋巴细胞接受相应抗原刺激后,在细胞间共刺激分子和细胞因子协同作用下活化、增殖、分化为免疫效应细胞(即效应T细胞和浆细胞)的阶段。
3.效应阶段 是浆细胞分泌抗体和效应T细胞释放细胞因子和细胞毒性介质,并在固有免疫细胞和分子参与下产生免疫效应的阶段。
第二节 B细胞介导的体液免疫应答
外来抗原进入机体后诱导抗原特异性抗体产生的过程称为体液免疫应答,主要由B细胞介导。B细胞通过BCR特异性识别和结合抗原,启动B细胞激活信号。活化信号被传递入胞内,导致B细胞活化、增值并分化成抗体分泌细胞(浆细胞)或记忆B细胞,在某种情况下,也可导致B细胞灭活或凋亡。B细胞识别的抗原可分为TD-Ag和TI-Ag,这两类抗原分子结构组成特征不同,刺激机体产生体液免疫应答所需免疫细胞的种类不同,免疫应答的特点也不同。TD-Ag引起的体液免疫应答至少需要三种免疫细胞参与:即APC、CD4+ Th细胞和B细胞,而TI-Ag引起的体液免疫应答则无需APC和CD4+ Th的参与。
一、B细胞对TD-Ag的免疫应答
(一)识别活化阶段
1.B细胞对TD-Ag的特异性识别 BCR复合受体分子是由膜表面免疫球蛋白(surfacemembrance immunoglobulin,Sm Ig/m Ig,即BCR)和Igα/Igβ非共价结合而成。不同发育和分化阶段的B细胞,其m Ig类别各异:未成熟B细胞表达m IgM;成熟B细胞同时表达m IgM和m IgD;记忆B细胞表达m IgG、m IgA或m IgE。
BCR对抗原的识别具有与TCR不同的特点:①BCR不仅可以识别蛋白质抗原,还能识别多肽、核酸、多聚糖、脂类和小分子化学物质;②BCR可特异性识别完整游离蛋白质抗原的天然空间构象,或直接识别蛋白质降解而暴露的决定基的空间构象,故无需经过APC对抗原的加工和处理,也无MHC限制性。
2.B细胞活化的信号要求 B细胞的活化需要两个信号(图7-1):
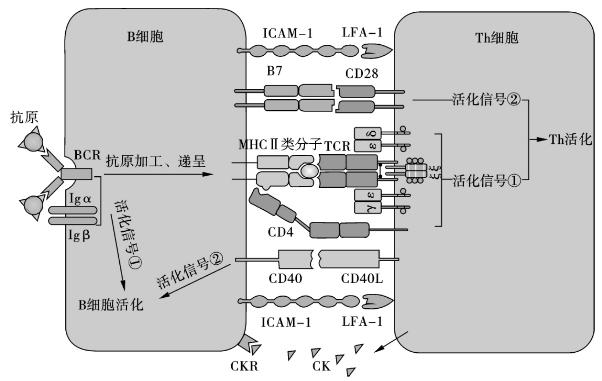
图7-1 B细胞与Th细胞间的相互作用
(1)B细胞的第一激活信号 BCR可变区中的超变区与抗原表面的B表位特异性结合,即BCR对抗原的识别产生B细胞活化的第一信号。B细胞膜表面的Igα/Igβ将此信号传递致胞内,B细胞膜表面的CD19-CD21-CD81辅助受体复合物参与加强抗原诱导下的信号转导,促进B细胞活化。
(2)B细胞的第二激活信号 又称协同刺激信号(costimulatory signal),由多种协同刺激分子对的参与,其中最重要的是CD40与CD40L。CD40主要表达于B细胞,单核细胞和DC表面;CD40L主要表达在活化的CD4+ Th2细胞表面。CD40/CD40L在B细胞活化、抗体的产生、Ig类别转换、记忆B细胞和生发中心的产生等方面均发挥关键的作用。活化的B细胞表达B7分子上调,参与T细胞的活化。
(二)增殖分化阶段
活化的T、B淋巴细胞,在细胞因子作用下增殖分化。活化的CD4+ Th0细胞通过表面IL-4等细胞因子受体,经旁分泌和自分泌作用方式与以IL-4为主的细胞因子结合后,可增殖分化形成CD4+ Th2细胞克隆。该种CD4+ Th2细胞可产生大量以IL-4、5、6、10和13为主的细胞因子,为活化B细胞增殖分化做好物质准备。活化B细胞通过表达IL-2、4、5、6等细胞因子受体,与活化CD4+ Th0细胞和CD4+ Th2细胞产生的IL-2、4、5、6等细胞因子结合作用后,可进一步增殖分化为浆细胞。浆细胞是具有合成分泌抗体功能的效应B细胞,在不同细胞因子作用下,可合成分泌不同类型的抗体,发挥体液免疫效应。在B细胞分化阶段,有部分B细胞停止分化,成为长寿记忆B细胞。该种记忆B细胞再次与相同抗原接触后,可迅速增殖分化为浆细胞,合成分泌抗体产生免疫效应(图7-2)。
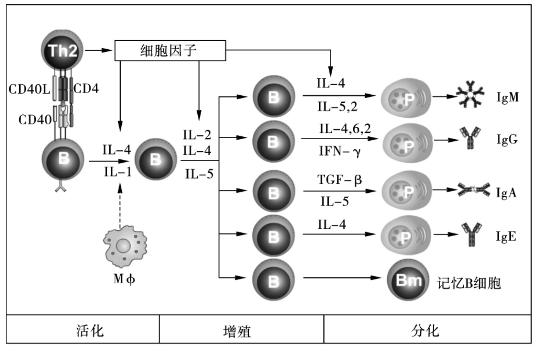
图7-2 B细胞应答过程示意图
(三)效应阶段
体液免疫效应阶段是指浆细胞分泌免疫球蛋白(抗体)发挥免疫保护作用(详见第三章免疫球蛋白和抗体)或引起免疫病理损伤(详见第八章超敏反应)的阶段。
二、B细胞对TI-Ag的免疫应答
TI-Ag(如某些细菌多糖、多聚蛋白质及脂多糖等)可直接激活B细胞,而无需CD4+ Th细胞辅助。根据抗原分子结构特征,TI-Ag可分为两类,即TI-1Ag和TI-2Ag,对其产生免疫应答的细胞为CD5+ B-1细胞,它们通过不同机制激活B-1细胞。
1.TI-1Ag诱导的B细胞应答 TI-1Ag抗原常被称为B细胞丝裂原。高浓度TI-1Ag可诱导多克隆B细胞增殖和分化;在低浓度时,只有BCR能结合TI-1Ag的B细胞,才能在细胞表面浓缩足够量TI-1Ag,从而被激活。机体感染病原体时,TI-1Ag浓度可能很低,只有抗原特异性B细胞才能被激活,并产生相应抗体。B细胞对TI-1Ag的应答在机体抵御某些胞外病原体感染中发挥重要作用,因其无需Th细胞预先致敏和克隆扩增,故比TD-Ag的应答发生早。但是,TI-1抗原单独不足以诱导Ig类别转换、抗原亲和力成熟及记忆B细胞形成(图7-3)。
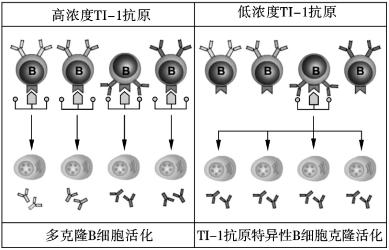
图7-3 TI-1Ag诱导B细胞的激活
2.TI-2Ag诱导的B细胞应答 TI-2Ag多为细菌胞壁与荚膜多糖成分,具有高度重复结构。TI-2Ag只能激活成熟B细胞。婴幼儿中B细胞多为不成熟细胞,故不能有效产生抗多糖抗原的抗体。TI-2Ag可使成熟的抗原特异性B细胞m Ig发生广泛交联,而使B细胞活化,进而增殖分化,产生抗体。
B细胞对TI-2Ag的应答具有重要生理意义。已知多种胞外菌含有胞壁多糖成分,使细菌得以抵抗吞噬细胞直接吞杀,而TI-2Ag可直接激活B细胞并产生相应抗体,在无需抗原特异性T细胞辅助的情况下迅速产生荚膜多糖抗体,后者可包被有荚膜的化脓菌,使之易被吞噬消化。
三、抗体产生的一般规律——初次应答与再次应答
抗体产生可分为四个阶段。①潜伏期:是指抗原进入体内到相应抗体产生之前的阶段,此期的长短与抗原的性质、抗原进入途径和机体状况有关,短者几天,长者数周。②对数期:是指抗体呈指数生长的阶段。③平台期:是指抗体水平相对稳定,既不明显增高,也不明显减少的阶段。④下降期:是指抗体合成小于降解速度,血清中抗体水平逐渐下降的阶段。
病原体等TD-Ag初次进入机体引发的体液免疫应答称为初次免疫应答(primary im-mune response)。初次免疫应答与再次免疫应答相比,其特点如下:①抗体产生所需潜伏期较长;②抗体倍增所需时间较长,抗体含量低;③平台期持续时间较短,抗体水平下降迅速;④血清中抗体以IgM为主,IgG为辅且出现相对较晚;⑤抗体与抗原结合的强度较低,为低亲和性抗体(图7-4)。
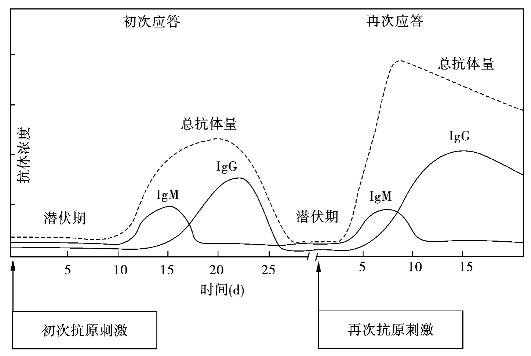
图7-4 初次与再次应答抗体产生的一般规律
初次应答后,机体再次接受相同抗原刺激产生的体液免疫应答称为再次应答(seccondary immune response)或回忆应答(anamnestic response)。再次应答具有如下特征:①诱导抗体产生的潜伏期明显缩短;②抗体倍增所需时间短,抗体含量迅速大幅度上升;③平台期维持时间较长,抗体水平下降缓慢;④血清中抗体以IgG为主;⑤抗体与抗原结合的强度较高,为高亲和性抗体。再次应答主要由记忆T、B淋巴细胞介导产生,其应答规律已广泛应用于传染性疾病的预防。例如多数疫苗在初次免疫后,均需进行再次免疫,以便获得对某种传染病更强、更持久的免疫力。
第三节 T细胞介导的细胞免疫应答
T淋巴细胞介导的免疫应答称为细胞免疫应答,通常由TD-Ag引起,在多种免疫细胞协同作用下完成。参与细胞免疫应答的细胞主要包括专职APC、非专职APC、CD4+ Th细胞以及CD8+ Tc细胞。细胞免疫应答与体液免疫应答类似,也可分为识别活化、增殖分化和效应三个阶段。
一、识别活化阶段
(一)T细胞对抗原的识别
未接受抗原刺激的T细胞被称为初始T细胞(naive T cell)。初始T细胞表面的TCR只能特异性识别表达于APC表面并与MHC分子结合成复合物的肽类抗原。换言之,TCR在特异性识别APC所递呈的抗原肽时,需同时识别与抗原肽结合的MHC分子,这种特性称为MHC限制性。
(二)T细胞活化的信号要求
T细胞在特异性识别APC所递呈的抗原肽-MHC分子复合物并被激活的过程中,与B细胞相似,T细胞活化需要接受两个胞外信号,此即T淋巴细胞激活的双信号。
1.T细胞的第一激活信号 为T细胞表面的TCR与APC表面的抗原肽-MHC分子复合物的特异性结合,即T细胞对抗原的特异性识别,此过程发生在APC递呈抗原后。此外,表达于T细胞表面的CD4或CD8分子作为共受体,可分别与APC表面的MHC-II 或MHC-I类分子的非多肽区结合,从而增强T细胞与APC间的黏附作用,在此过程中,APC分泌的细胞因子(如IL-1)在T细胞活化、增殖和分化过程中起重要作用。
2.T细胞的第二激活信号 即协同刺激信号,由APC表面和T细胞表面黏附分子的相互作用所提供,这些黏附分子(及其配体)也被称为协同刺激分子。在参与T细胞激活的诸多协同刺激分子中,最重要的是T细胞表面CD28分子与APC表面相应配体B7-1 (CD80)和B7-2(CD86)的结合。CD28或B7启动的第二信号可增强细胞因子基因转录,并可稳定细胞因子(尤其是IL-2)mRNA,从而促进T细胞产生细胞因子。活化的T细胞分泌的细胞因子如IL-2,IL-12,IFN-r进一步促进T细胞的增殖和分化。
活化的T细胞还可表达CTLA-4,其配体也是B7-1和B7-2。但与CD28分子的作用相反,CTLA-4与配体结合可向T细胞发出抑制信号,使活化T细胞(及其子代细胞)对抗原刺激的敏感性降低,从而限制T细胞应答的强度。APC表面还表达VCAM-1,IVAM-1和LFA-3等协同刺激分子,它们分别与T细胞表面的VLA-4,LFA-1和CD2结合,共同提供T细胞活化的第二信号。TCR识别并结合抗原肽的过程中若缺乏协同刺激信号,则特异性T细胞不能充分活化,也不能显示其效应,呈不应答(或称无能)状态(anergy),或导致抗原特异性T细胞凋亡(图7-5)。
APC表面协同刺激分子的表达可受多种因素调节。正常组织中的静止APC一般仅低表达或不表达协同刺激分子,故不能诱导自身抗原特异性的T细胞活化。当病原微生物侵袭而发生炎症时,感染灶炎症细胞可释放多种细胞因子,使局部APC表面的协同刺激分子表达增高,从而有利于针对微生物抗原的特异性T细胞活化,产生免疫应答以清除微生物。T细胞活化要求“专职”APC既递呈特异性抗原,又提供协同刺激信号,这对阻止自身免疫性病理损伤具有重要意义。

图7-5 T细胞活化的双识别和双信号
T细胞活化有赖于双信号刺激,这一现象为临床免疫治疗提供了新的途径。例如:对肿瘤细胞进行基因修饰,使其高表达B7-1分子,可诱导有效的T细胞抗肿瘤效应;相反,应用抗B7抗体封闭B7-1和B7-2,或应用CTLA-4干扰CD28与B7分子结合,可抑制移植排斥反应,延长同种移植存活期。
二、增殖分化和效应阶段
在局部微循环中不同细胞因子诱导下,活化CD4+ Th细胞和CD8+ CTL细胞增殖分化,最终成熟为具有免疫功能的CD4+效应Th1细胞和CD8+效应CTL细胞,CD4+效应Th1细胞通过表面TCR-CD3复合受体分子与APC表面相应抗原肽-MHC-Ⅱ分子复合物结合相互作用后,可通过分泌IL-2、IFN-γ、TNF-α/β等细胞因子,产生免疫效应; CD8+效应CTL细胞通过表面TCR-CD3复合受体分子与靶细胞表面相应抗原肽-MHC-Ⅰ类分子复合物相互作用后,可通过释放穿孔素、颗粒酶和表达FasL对靶细胞产生细胞毒性作用。
(一)CD4+ Th1细胞的形成和主要生物学效应
CD4+ Th1细胞是体内CD4+ Th0细胞经抗原刺激后,在IL-12为主的细胞因子作用诱导下产生的,其形成过程和主要生物学效应简述如下。
1.CD4+ Th0细胞的活化 CD4+ Th0细胞通过表面TCR-CD3复合受体和CD4辅助受体分子,与抗原递呈细胞(如树突状细胞)表面相应抗原肽-MHC-Ⅱ类分子复合物结合产生第一信号活化;通过表面共刺激分子(CD28)与APC表面相应分子(B7)相互作用,获得共刺激信号即第二活化信号。在上述两种信号刺激下,CD4+ Th0细胞活化,表达IL-2、4、12和IFN-γ等多种细胞因子的受体,同时产生IL-2、4和IFN-γ等多种细胞因子,参与免疫调节。与此同时,接受抗原刺激和CD4+ Th0细胞反馈刺激的APC活化,其表面MHC分子和共刺激分子表达增加,并产生IL-1、12、IFN-γ和TNF-α等多种细胞因子,参与免疫调节(图7-6)。
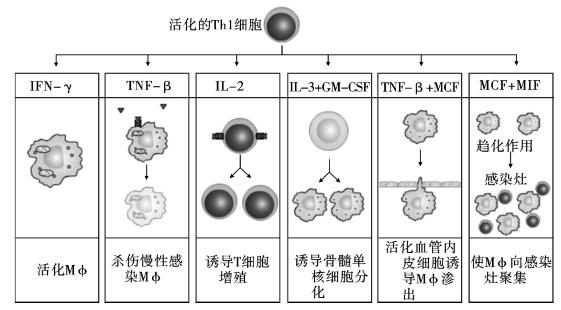
图7-6 CD3+ Th1细胞在抗胞内病原体等中的效应
2.CD4+ Th1细胞的形成 活化CD4+ Th0细胞通过表面IL-12、IFN-γ等细胞因子的受体,经旁分泌和自分泌方式,接受以IL-12和IFN-γ为主的细胞因子的作用后,增殖分化,最终成熟为具有免疫效应功能的CD4+ Th1细胞,又称CD4+炎性T细胞。
3.CD4+ Th1细胞的主要生物学效应 CD4+ Th1细胞通过表面TCR-CD3复合受体分子与APC表面相应抗原肽-MHC-Ⅱ类分子复合体特异性结合后,可通过释放IL-2、IFN-γ和TNF-α/β等细胞因子,在局部组织产生以淋巴细胞和单核吞噬细胞浸润为主的慢性炎症反应或迟发型超敏反应。
(二)CD8+ Tc细胞形成和主要生物学效应
CD8+ Tc细胞是在专职/非专职APC参与和CD4+ Th细胞协助下诱导产生的,其形成过程和主要生物学作用简述如下。
1.CD8+ Tc细胞活化 CD8+ Tc细胞活化也需要双信号刺激,根据靶细胞表面共刺激分子的表达情况,其活化有以下三种方式。
(1)CD8+ Tc细胞识别结合的靶细胞是高表达共刺激分子的树突状细胞(如病毒感染的DC)时,CD8+ Tc细胞活化无需CD4+ Th细胞辅助。在此种情况下,CD8+ Tc细胞通过表面TCR-CD3复合受体和CD8分子与上述靶细胞表面相应抗原肽-MHC-Ⅰ类分子复合物特异性结合,可获得活化第一信号;通过表面共刺激分子与靶细胞表面相应共刺激分子互补结合,可诱导产生T细胞活化第二信号,使CD8+ Tc细胞活化。
(2)CD8+ Tc细胞识别结合的靶细胞是不表达或低表达共刺激分子的专职或非专职APC(如病毒感染的细胞和肿瘤细胞)时,CD8+ Tc细胞活化需CD4+ Th细胞协助。在此种情况下,CD8+ Tc细胞通过表面TCR-CD3复合受体分子与上述靶细胞表面相应抗原肽-MHC-Ⅰ类分子复合物特异性结合后,虽然可诱导产生活化第一信号,并表达IL-2 和IFN-γ等细胞因子的受体,但由于靶细胞表面不表达或低表达共刺激分子,因此不能或不足以诱导共刺激信号,即T细胞活化第二信号的产生。此时,某些病毒抗原、肿瘤抗原或同种异体MHC抗原可作为外源性抗原被APC摄取、加工处理,并以抗原肽-MHC-Ⅱ类分子复合物的形式表达于APC表面,供CD4+ Th细胞识别,并使之活化。活化的CD4+ Th细胞和效应CD4+ Th1细胞可分泌IL-2和IFN-γ等细胞因子,这些细胞因子与上述靶细胞表面相应受体(IL-2R和IFN-γR)结合后,可诱导产生T细胞活化第二信号,使CD8+ Tc细胞活化。
(3)某些病毒抗原,肿瘤抗原或同种异体MHC抗原也可通过抗原交叉递呈作用,以抗原肽-MHC-Ⅱ类分子和抗原肽-MHC-Ⅰ类分子复合物的形式表达于同一APC表面。在此种情况下,活化CD4+ Th细胞通过表面TCR-CD3复合受体分子和CD40L与APC表面相应抗原肽-MHC-Ⅱ类分子复合物和CD40结合,相互作用后,可诱导或促进APC表达共刺激分子(如B7分子),从而能使与同一APC结合只产生活化第一信号的CD8+ Tc细胞获得B7分子刺激,产生T细胞活化第二信号,使CD8+ Tc细胞活化。活化的CD8+ Tc细胞可表达IL-12、2、6和IFN-γ等多种细胞因子的受体,为其增殖分化做好准备。
2.CD8+ Tc细胞的增殖与分化 CD8+ Tc细胞通过表面IL-12、IL-2和IFN-γ等细胞因子的受体经旁分泌和自分泌作用方式,接受APC、活化CD4+ Th细胞和CD4+效应Th1细胞分泌的IL-1、IL-2和IFN-γ等细胞因子的刺激后,发生克隆扩增,产生足够数量的特异性CD8+ Tc细胞,进而分化、成熟为高表达黏附分子和FasL的CD8+效应Tc细胞。
3.CD8+ Tc细胞主要生物学效应 CD8+ Tc细胞的主要效应是清除肿瘤和病毒感染的靶细胞。其对靶细胞的杀伤破坏作用具有抗原特异性,且受MHC-Ⅰ类分子的限制。
(1)Tc细胞对靶细胞的杀伤效应 Tc细胞杀伤靶细胞的过程可分为两个阶段。①效应靶细胞结合阶段:Tc细胞须与靶细胞直接接触才能发挥杀伤效应。Tc细胞表面TCR/CD3复合物与靶细胞表面抗原肽MHC-Ⅰ类分子复合物紧密结合,并在多种协同刺激因子参与下,通过复杂的识别、黏附、信息传递等过程,触发Tc细胞活化并释放溶细胞介质。该过程历时数分钟,需在37℃下进行,并依赖Mg2+存在。②致死性打击溶解阶段:历时约1 h或更长时间,Tc细胞对靶细胞造成不可逆损伤,此过程对温度敏感,需Ca2+存在(图7-7,图7-8,图7-9)。
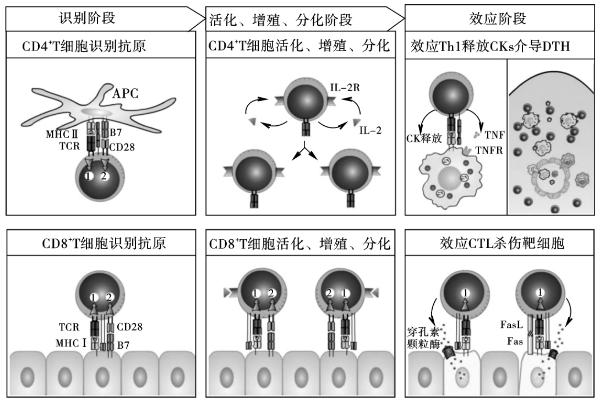
图7-7 细胞免疫应答的基本过程
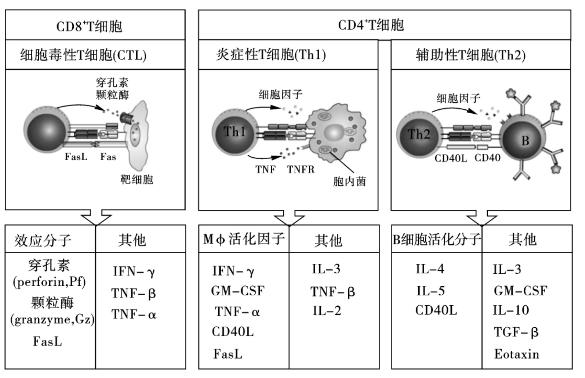
图7-8 三种效应T细胞的效应示意图
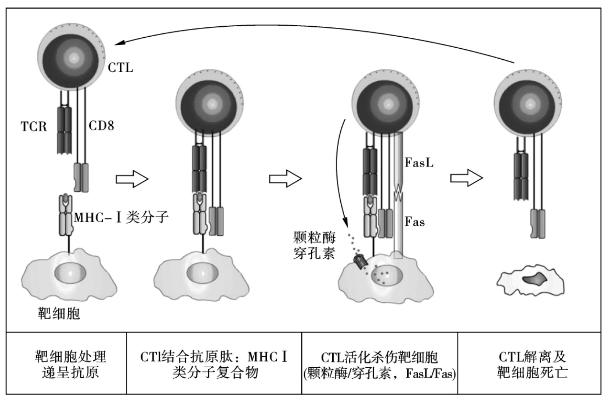
图7-9 CD8+ Tc细胞杀伤靶细胞的过程
(2)Tc细胞杀伤靶细胞的主要机制 ①穿孔素-颗粒酶系统:穿孔素(perforin)也称为成孔蛋白(preforming protein,PFP)或细胞溶素(cytolysin),由Tc细胞和NK细胞产生。单体形式的穿孔素从颗粒中释放后,在Ca2+存在下可与双层质膜结合,插入靶细胞膜并发生多聚化,形成管状的多聚穿孔素,其所形成的穿膜管状结构能容许Na+和水分子进入靶细胞内,从而改变细胞渗透压,最终导致细胞溶解。颗粒酶(granzyme)是存在于NK细胞和Tc细胞颗粒中的一类丝氨酸酯酶(serine esterase)。不论Tc细胞以何种方式被激活,其胞内颗粒酶表达水平均增加,并转化为活性形式。目前已发现7种颗粒酶(A~G),其中最重要者为颗粒酶A和B。颗粒酶B具有内源性核苷酸酶效应,在Tc细胞致靶细胞凋亡过程中发挥重要作用。②Fas/FasL系统:活化Tc细胞表面可高表达FasL,其与靶细胞表面Fas结合,可介导靶细胞凋亡。此外,高表达FasL的活化T细胞也可诱导表达Fas的自身或相邻T细胞凋亡,称为活化诱导的细胞凋亡(activation induced cell death,AICD)。③通过分泌TNF-α杀伤表达TNF受体的靶细胞。
(靳 静)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















