第十七章 病原性球菌
学习目标
1.掌握致病性葡萄球菌的致病物质、所致疾病、鉴定依据。
2.掌握链球菌的分类、致病物质、所致疾病、抗O试验。
3.熟悉肺炎链球菌、脑膜炎奈瑟菌、淋病奈瑟菌的致病性。
病原性球菌是一群对人有致病性的球菌,主要引起人的化脓性炎症,故又称为化脓性球菌。根据染色性不同,可分为革兰阳性和革兰阴性两大类。前者包括葡萄球菌、链球菌、肺炎链球菌等,后者包括脑膜炎奈瑟菌和淋病奈瑟菌等。
第一节 葡萄球菌属
葡萄球菌属(Staphylococcus)的细菌是一群革兰阳性球菌,通常排列成不规则的葡萄串状,故名。葡萄球菌可引起各种类型的化脓性感染,甚至严重的败血症。正常人体也可携带致病菌株,一般鼻咽部带菌率为20%~50%,医务人员的带菌率可高达70%,是医院内交叉感染的重要来源。临床上较重要的葡萄球菌根据其色素、生化反应等不同可分为金黄色葡萄球菌(Staph.Aureus)、表皮葡萄球菌(Staph.epidermidis)和腐生葡萄球菌(Staph.saprophyticus)三种。金黄色葡萄球菌为凝固酶阳性菌;表皮、腐生葡萄球菌为凝固酶阴性菌。金黄色葡萄球菌是人类主要的致病菌。凝固酶阴性葡萄球菌为人体的正常菌群,一般情况下不致病。在某些条件下,凝固酶阴性葡萄球菌也可致病,尤其是引起免疫功能低下的病人及年轻女性、老年人群的感染,75%的病例是由表皮葡萄球菌引起。腐生葡萄球菌是引起年轻女性尿路感染的常见细菌。三种葡萄球菌的主要生物学性状见表17-1,我们重点探讨金黄色葡萄球菌。
表17-1 三种葡萄球菌的主要生物学性状比较

一、生物学性状
(一)形态与染色
呈球形,直径约为1μm,革兰染色阳性在固体培养基中繁殖时,菌体向多个平面不规则分裂,故常排列成典型的葡萄串状(图17-1)。在液体培养基中生长时,常可见到单个、成对或成短链状排列的菌体。

图17-1 金黄色葡萄球菌形态
右下为光镜下形态,革兰染色(×1 000);左上为扫描电镜(×135 000)
(二)培养特性
金黄色葡萄球菌需氧或兼性厌氧,少数是专性厌氧。营养要求不高,在普通培养基中,37℃生长良好。室温下(20~25℃)色素形成最佳。色素为金黄色,脂溶性,不溶于水,故培养基不着色,仅菌落呈色。最适pH值为7.4左右。
金黄色葡萄球菌在肉汤培养基中37℃孵育24 h后,呈均匀混浊生长。管底稍有沉淀,轻轻振摇,沉淀物即上升,且易消散。在普通琼脂平板上孵育24~48 h后,形成圆形、隆起、表面光滑、湿润、边缘整齐、不透明的菌落。直径通常为1~2 mm。菌落初为白色,随时间延长,产生的色素使菌落呈现为金黄色。金黄色葡萄球菌在血琼脂平板上生长时,菌落周围形成明显的完全透明的溶血环(β溶血)。
(三)生化反应
金黄色葡萄球菌可发酵多种糖类,产酸不产气。可分解甘露醇,非致病性葡萄球菌菌株无此作用。
(四)抗原构造
葡萄球菌抗原构造复杂,其化学组成有多糖抗原、蛋白质抗原及细胞壁中重要成分抗原。较重要者为葡萄球菌A蛋白。
葡萄球菌A蛋白(staphylococcal protein A,SPA)是绝大多数金黄色葡萄球菌细胞壁的一种表面蛋白。SPA可与除IgG3外的IgG分子的Fc段发生非特异性结合。二者结合后,IgG的Fab段仍然可以与特异性抗原结合。SPA这种特性使其可以作为免疫学及实验室诊断技术中的应用试剂。如Fc段结合于SPA的IgG分子,Fab段与相应的细菌抗原结合后,可使金黄色葡萄球菌发生肉眼可见的凝集现象。这种简易、快速的协同凝集试验(coagglutination)已广泛应用于多种微生物抗原的检测。
SPA与IgG结合后的复合物具有抗吞噬等多种生物学活性。SPA抗吞噬作用主要是由于受体结合,使吞噬细胞的激活受阻。此外,SPA还有促细胞分裂、引起变态反应、损伤血小板等多种生物活性。
(五)分类
多数金黄色葡萄球菌可用噬菌体分型,将其分为5群共26个噬菌体型。噬菌体分型在流行病学调查时追踪传染源及研究菌型与疾病种类间的关系上均有重要意义。
(六)抵抗力
金黄色葡萄球菌对热和干燥的抵抗力较一般无芽胞细菌强,加热80℃30 min才被杀死。在干燥的脓汁、痰液中可存活2~3个月。5%石炭酸中10~15 min死亡。对碱性染料敏感,十万分之一的龙胆紫液即可抑制其生长。
金黄色葡萄球菌对青霉素、红霉素和庆大霉素高度敏感。本菌易产生耐药性,可对以下抗生素产生耐药。①青霉素(penicillin)类抗生素:金黄色葡萄球菌可携带编码β-内酰胺酶的质粒,对多种青霉素类抗生素(青霉素G、氨苄青霉素等)产生耐药性。这种耐药性质粒可通过转导在细菌间传递。目前金黄色葡萄球菌对青霉素G的耐药菌株已高达90%以上。②万古霉素(vancomycin):日本、美国等国家分离到对万古霉素耐药的金黄色葡萄球菌,主要是从长期使用万古霉素治疗,而疗效不佳的患者中分离到的。研究发现,其耐药性的机理是由于细菌细胞壁合成量增加及细胞壁组成成分的替代导致耐药性形成。这种对万古霉素耐药的金黄色葡萄球菌,对奈夫西林(nafcillin)也耐药。此外,金黄色葡萄球菌还可携带抗红霉素、四环素及其他抗药基因的质粒。
二、致病性与免疫性
(一)致病物质
金黄色葡萄球菌侵袭力强,能产生多种外毒素及胞外酶。
1.凝固酶(coagulase)金黄色葡萄球菌产生的一种能使含有肝素或枸橼酸钠抗凝剂的人或兔血浆凝固的酶类物质,是鉴别葡萄球菌有无致病性的重要指标。
凝固酶分两种:①游离凝固酶(free coagulase)是细菌分泌至菌体外的酶样蛋白质,可被人或兔血浆中的协同因子(cofactor)激活为凝血酶样物质后,使液态的纤维蛋白原变成固态的纤维蛋白,从而使血浆凝固;②结合凝固酶(bound coagulase),结合于菌体表面并不释放。其作用类似于菌株表面的纤维蛋白原受体。当细菌悬浮于人或兔血浆中时,纤维蛋白原与菌体表面结合凝固酶结合,并沉积于菌体表面。
凝固酶和金黄色葡萄球菌的毒力关系密切。细菌侵入机体后,使血液或血浆中的纤维蛋白沉积于菌体表面,阻碍体内吞噬细胞的吞噬;即使被吞噬后,也不易被杀死。同时凝固酶聚集在菌体周围,亦能保护病原菌免受血清中杀菌物质的杀伤作用。金黄色葡萄球菌引起的感染易于局限化和形成血栓也与凝固酶的作用有关。
凝固酶具有免疫原性,刺激机体产生的抗体对金黄色葡萄球菌感染有一定的保护作用。
2.葡萄球菌溶血素(staphylolysin)按抗原性不同,至少有α、β、γ、δ、∈五种,对人有致病作用的主要是α溶血素。α溶血素为蛋白质,不耐热,65℃30 min被破坏。其生物活性表现为:①对多种哺乳动物红细胞有溶血作用;②对白细胞、血小板有损伤、溶解作用;③使小血管收缩,造成局部缺血、坏死;④使循环系统功能发生紊乱,肌肉组织和肾皮质出现病变。α溶血素虽非葡萄球菌感染中的唯一毒力因素,但当感染灶形成后是造成组织病变的重要致病物质。
α溶血素是一种外毒素,经甲醛处理后可制成类毒素,可作为防止金黄色葡萄球菌感染的人工主动免疫制剂。
3.杀白细胞素(leukocidine)大多数金黄色葡萄球菌能产生除溶血素外的另一种破坏白细胞的毒素称为PV杀白细胞素(Panton-Valentine leukocidine)。与葡萄球菌溶血素不同,PV杀白细胞素只攻击中性粒细胞和巨噬细胞,不涉及其他类型的细胞。PV杀白细胞素作用于白细胞胞膜,导致细胞通透性增加,钾离子丢失,最终细胞死亡。其在抵抗宿主吞噬细胞吞噬,增强葡萄球菌侵袭力方面有意义。
4.肠毒素(enterotoxin)几乎50%的金黄色葡萄球菌菌株可产生至少6种(A~F)肠毒素分子。编码肠毒素的基因可能位于细菌染色体上,但质粒DNA可能带有编码激活肠毒素基因表达的蛋白质的基因。肠毒素为可溶性蛋白质,较耐热,100℃30 min仍能保持部分活性。毒素作用机制可能是毒素作用于内脏神经受体,刺激呕吐中枢引起。
5.表皮溶解毒素(epidermolytic toxin)其也称表皮剥脱毒素(exfoliatin),主要由噬菌体Ⅱ群金黄色葡萄球菌产生。毒素能裂解表皮组织的棘状颗粒层,使表皮与真皮脱离,引起葡萄球菌烫伤样皮肤综合征,亦称剥脱性皮炎,多见于新生儿及婴幼儿。
6.毒性休克综合征毒素Ⅰ(toxic shock syndrome toxinⅠ,TSST-1) 由噬菌体Ⅰ型金黄色葡萄球菌产生。研究发现,分离出的金黄色葡萄球菌中20%携带有TSST-1基因。毒素结构类似于葡萄球菌肠毒素B,引起发热、休克及脱屑性皮疹,称为毒性休克综合征(toxic shock syndrome,TSS)。
(二)所致疾病
金黄色葡萄球菌可引起化脓性炎症、毒素性疾病及葡萄球菌性肠炎。
1.化脓性炎症 可引起皮肤、器官及全身感染。
(1)皮肤软组织感染 如疖、痈、毛囊炎、睑腺炎、蜂窝织炎、伤口化脓等。
(2)内脏器官感染 金黄色葡萄球菌进入血流,并随血流播散,可导致心内膜炎、血源性骨髓炎、脑膜炎、肺部感染等。
(3)全身感染 如败血症、脓毒血症等。
2.毒素性疾病 一般由金黄色葡萄球菌产生的相关外毒素引起。
(1)食物中毒 由葡萄球菌肠毒素引起。进食被肠毒素污染的食物1~8 h后出现剧烈的恶心、呕吐及腹泻症状。发病过程中不伴有发热,病情很快好转,预后良好。
(2)烫伤样皮肤综合征 由产生表皮剥脱毒素的金黄色葡萄球菌引起。此症多见于幼儿及免疫功能低下的成人。发病初期患者皮肤出现弥漫性红斑(可累及全身皮肤的20%~100%),48 h内表皮起皱,继而形成清亮的水疱。皮肤有触痛,形似砂纸状。最后表皮上层脱落。
(3)毒性休克综合征 此病常发生在使用月经塞的年轻女性月经来潮5日内,表现为突发的高热、呕吐、腹泻、皮肤猩红热样皮疹。严重者可出现低血压及心肾功能衰竭,导致休克。毒性休克综合征也可发生在儿童及存在葡萄球菌感染伤口的男性成人。
3.葡萄球菌性肠炎 正常人群中约有10%~15%的人肠道中寄生有少量金黄色葡萄球菌。由于长期使用广谱抗生素,杀伤肠道中不耐药的优势菌群,如脆弱类杆菌、大肠埃希菌等,使耐药的金黄色葡萄球菌大量繁殖产生肠毒素,引起以腹泻为主的临床症状。葡萄球菌性肠炎本质是一种菌群失调性肠炎,病理特点是肠黏膜覆盖一层由炎症渗出物、肠黏膜坏死块和细菌组成的炎性假膜。
(三)免疫性
正常人群对金黄色葡萄球菌有一定的天然免疫力。只有当皮肤黏膜受创伤后或患有慢性消耗疾病以及其他病原体感染导致免疫力降低时,才易导致金黄色葡萄球菌感染。感染后可获得一定的免疫力,但难以防止再次感染。
三、微生物学检查法
1.标本 根据疾病类型不同采取不同的标本。如化脓性病灶采取脓液;败血症取血液;食物中毒采取患者的剩余食物或呕吐物等。
2.直接涂片镜检 制备标本涂片革兰染色后油镜下观察。根据细菌形态、排列方式及染色性,可做出初步诊断。但涂片镜检并不能区别致病菌与非致病菌。
3.分离培养与鉴定 将标本接种到血琼脂平板上,37℃培养18 h后可长出典型菌落。若要观察溶血现象及色素,需延长培养时间,最佳温度是室温。培养基中加入浓度为7.5%氯化钠,可抑制除金黄色葡萄球菌外的其他杂菌的生长,有利于分离出金黄色葡萄球菌。
致病性葡萄球菌的特点是:产生金黄色色素,有溶血性,凝固酶阳性,可发酵甘露醇。目前虽不断发现凝固酶阴性葡萄球菌菌株也可致病,但一般仍以凝固酶阳性作为判断致病性葡萄球菌的依据。
4.凝固酶试验 是将1∶5稀释后的肝素抗凝人或兔血浆与等量肉汤培养物混合。消毒灭菌后的肉汤培养基作为对照。若1~4 h内试验管出现血浆凝固现象,是为凝固酶阳性。此为试管法,目的是检测有无游离的血浆凝固酶。也可用玻片法检测有无结合凝固酶。
5.食物中毒的检测 取患者呕吐物或剩余食物作为标本,接种于肉汤培养基,孵育后取滤液注射于6~8周龄的幼猫腹腔,如注射后4小时内幼猫出现呕吐、腹泻、体温升高或死亡等现象,提示有肠毒素存在的可能。
6.药敏试验 金黄色葡萄球菌易产生耐药性变异。约90%的金黄色葡萄球菌产生β-内酰胺酶,成为青霉素类药物的耐药菌株。故对临床分离出的葡萄球菌标本,药敏试验应作为一项常规检测,以便挑选出细菌敏感的药物。
四、防治原则
注意个人卫生,做好消毒隔离,防止医源性感染。
葡萄球菌引起的脓肿应采取引流治疗。这是因为抗生素不容易作用到化脓性病灶的坏死中心区域。
急性血源性骨髓炎,抗生素治疗效果好;对于慢性、反复发作的病例,使用抗生素的同时应采取外科引流,或切除坏死骨质。
败血症及各种严重的内脏器官感染,应采取抗β-内酰胺酶的青霉素类药物,并用静脉给药的方法治疗。
由于耐药菌株的不断增多,治疗时应根据药物敏感试验结果,选用敏感抗菌药物。
第二节 链球菌属
链球菌属(Streptococcus)细菌为革兰染色阳性球菌,其特征之一是生长过程中成对或成链状排列。链球菌广泛分布于自然界,大多为人或动物体内寄生的正常菌群。寄生部位以上呼吸道为主,一般情况下不致病。有些链球菌如化脓性链球菌,可产生多种胞外物质及酶,是引起人类多种疾病的重要病原菌,主要引起各种化脓性感染。
一、链球菌的分类
链球菌常用的分类方法有3种。
(一)根据溶血现象分类
在血液琼脂平板上生长时,有些链球菌可使菌落周围的红细胞完全溶血;有些链球菌可部分溶解菌落周围的红细胞或不溶解。传统的分类方法是按产生溶血与否及其溶血性质将链球菌分为三类。
1.甲型溶血性链球菌(α-hemolytic streptococcus) 菌落周围的血细胞发生部分溶血,形成围绕菌落1~2 mm宽的半透明溶血环,称为甲型溶血或α溶血。甲型溶血性链球菌菌落周围溶血环中的红细胞大部分没有完全溶解,并伴有绿色素生成,故亦称为草绿色溶血性链球菌(Streptococcusviridans)。此类链球菌多为条件致病菌,引起的感染主要为龋齿和心内膜炎。
2.乙型溶血性链球菌(β-hemolytic streptococcus) 使红细胞完全破坏并释放出血红素的链球菌称为乙型或β溶血性链球菌。在血琼脂平板上可见到菌落周围形成2~4 mm宽、界限分明、完全透明的无色溶血环。乙型溶血性链球菌致病力强,常引起人和动物多种疾病。
3.丙型链球菌(γ-streptococcus)不产生溶血素,菌落周围无溶血环,故亦称为非溶血性链球菌(non-hemolytic streptococcus)。一般情况下不致病。
(二)根据抗原结构分类
根据链球菌细胞壁中多糖抗原性不同将链球菌分为A~H及K~V等20个族。对人有致病作用的链球菌90%属于A族,A族链球菌常引起各种类型的化脓性感染,故又称为化脓性链球菌,我们将重点探讨。A族链球菌在血琼脂平板上形成(β溶血环),对细菌素敏感。根据表面抗原(M抗原、T抗原及R抗原)的不同,A族链球菌又分为至少60个型。
(三)根据对氧的需要分类
根据对氧的需要分为需氧性、兼性厌氧性和厌氧性链球菌三类。对人类致病的主要为前两类;厌氧性链球菌是口腔、消化道、泌尿生殖道的正常菌群,在特定条件下可致病。
二、生物学性状
(一)形态与染色
单个菌体呈球形或卵圆形,直径约1μm。排列成链状或成双排列,链的长短受环境因素影响而不同(图17-2)。革兰染色阳性。随着培养时间延长或菌体死亡,可表现为革兰染色阴性。无鞭毛,不形成芽胞。A族链球菌有发丝样M蛋白,外包裹脂磷壁酸的菌毛结构。大多数A族链球菌培养早期(2~4 h)可形成透明质酸荚膜,随培养时间延长由于细菌产生的透明质酸酶而将其降解后消失。
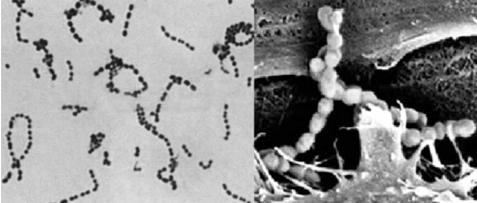
图17-2 链球菌
左为革兰染色(×1 000);右为扫描电镜(×13 000)
(二)培养特性
普通琼脂平板及肉汤培养基中生长不好,需在培养基中加入血液或组织液方能生长。对人类有致病作用的链球菌还需在培养基中加入多种生长因子。10% CO2可促进链球菌生长及溶血作用。多数有致病作用的溶血性链球菌最适生长温度为37℃,需氧或兼性厌氧。在血琼脂平板上形成圆形隆起,表面光滑,灰白色半透明或不透明的细小菌落,多数菌株菌落周围有β溶血现象。在血清肉汤培养基中生长时易形成长链状,管底呈絮状沉淀。
(三)生化反应
能发酵简单的糖类,产酸不产气。一般不分解菊糖,不被胆汁溶解。
(四)抗原构造
链球菌抗原构造较复杂,主要有以下几种。
1.核蛋白抗原 或称P抗原。P抗原无特异性,各种链球菌均相同。
2.多糖抗原 或称C抗原。存在于多数链球菌的细胞壁中,是链球菌分群的依据。
3.蛋白质抗原 或称表面抗原。是链球菌细胞壁的蛋白质成分,位于C抗原外层。A族链球菌的蛋白质抗原有M、T、R和S四种不同性质的抗原组分,与致病性有关的是M抗原。
(五)抵抗力
多数链球菌不耐热,60℃30 min可被杀死。对一般消毒剂敏感。在干燥的尘埃中可生存数月。A族乙型溶血性链球菌对青霉素、红霉素、氯霉素、四环素和磺胺药极敏感,极少有耐药株发现。
三、致病性
(一)致病物质
A族链球菌较强的侵袭力取决于其能产生多种胞外酶及毒素。
1.脂磷壁酸(lipoteichoic acid,LTA)围绕在M蛋白外层,与M蛋白共同构成A族链球菌的菌毛结构。人类多种细胞膜上均有LTA受体,LTA与细胞表面受体结合,增强细菌对宿主细胞的黏附性。
2.M蛋白(M protein)是A族链球菌主要的毒力因子。其毒性作用一方面表现为抗吞噬细胞的吞噬及抗吞噬细胞内的杀菌作用;另一方面M蛋白可诱发机体的变态反应。提纯的M蛋白与心肌组织有交叉反应,推断M蛋白是风湿热的重要致病因子。M蛋白与其相应抗体形成的免疫复合物可引起急性肾小球肾炎等变态反应性疾病。
3.致热外毒素(pyrogenic exotoxin)亦称为红疹毒素(erythrogenic toxin)或猩红热毒素(scarlet fever toxin)。化学组成为蛋白质,有A、B、C三个血清型。毒素A是由携带溶原性噬菌体的A族链球菌产生。此毒素与毒性休克综合征有密切关系。从链球菌毒性休克综合征患者体内分离到的A族链球菌,大多数都产生致热外毒素或携带毒素基因,仅有15%其他类型感染患者体内分离到的A族链球菌携带此毒素基因。致热外毒素能改变血脑屏障通透性,直接作用于下丘脑引起发热、皮肤红疹,是猩红热的主要致病毒素。
4.溶血素(hemolysins) A族链球菌可产生两种溶血素分子:
(1)链球菌溶血素O(streptolysin O,SLO)是一种分子量约为60×103,含有-SH基的蛋白质。在还原状态下SLO可溶解红细胞。在氧的存在下,-SH基被氧化成-SS-基,活性很快被灭活而失去溶血性。SLO对中性粒细胞、血小板及心肌组织有毒性作用。抗原性强,可刺激机体产生相应抗体。抗溶血素O抗体(antistreptolysin O,ASO)可中和溶血素O的活性,是实验室对ASO定量检测的基础。如果血清中ASO效价超过160~200个单位,提示近期感染或敏感人群曾经感染过,目前仍处于超敏状态。风湿热患者血清中ASO效价明显升高。因此,测定ASO效价可作为风湿热及其活动性的辅助诊断。
(2)链球菌溶血素S(streptolysin S,SLS)乙型溶血性链球菌在血琼脂平板上菌落周围完全透明的溶血环由SLS所致。SLS对氧稳定,无抗原性。在人及动物血清中,存在能够抑制其溶血活性的非特异性抑制物。
5.侵袭性酶(invasive enzyme) A族链球菌可产生多种侵袭性酶,与致病性相关的主要有以下几种。
(1)透明质酸酶(hyaluronidase)能分解细胞间质的透明质酸,有利于细菌在组织中的扩散,故又称为扩散因子(spreading factor)。
(2)链激酶(streptokinase,SK)亦称为溶纤维蛋白酶(fibrinolysin)。多数A族乙型溶血性链球菌及C、G族链球菌能产生此酶。链激酶可使血浆中的纤维蛋白酶原转变成纤维蛋白酶,溶解血块或阻止血浆凝固,增强细菌的扩散能力。链激酶可刺激机体产生抗链激酶抗体,阻止酶的活性。国外已将链激酶应用到临床治疗早期肺栓塞、冠状动脉及静脉血栓形成。
(3)链道酶(streptodornase) 亦称为链球菌DNA酶(streptococcal deoxyribonuclease)。可降解黏稠的DNA,使脓液稀薄,有利于细菌的扩散。链激酶与链道酶可联合用于化脓性伤口的清创,液化脓性分泌物有利于脓液及坏死物的清除,并有利于抗菌药物进入感染的组织。机体感染链球菌后,血清中抗链球菌链道酶抗体可有明显升高,尤其是在皮肤感染后。
(二)所致疾病
人类约90%的链球菌感染是由A族链球菌引起的。常见的传播方式为通过呼吸道传播。在炎热的季节多为皮肤感染。感染类型可归为三种主要类型:
1.化脓性感染
(1)局部皮肤及皮下组织感染 丹毒、淋巴管炎、蜂窝织炎、痈、脓疱疮等。
(2)其他感染 化脓性扁桃体炎、咽炎、鼻窦炎、中耳炎及产褥热等。
2.中毒性疾病
(1)猩红热 由产生致热外毒素的A族链球菌引起的呼吸道传染病。此病多发于10岁以下儿童,潜伏期为2~3天,临床特征为发热、全身弥漫性鲜红色皮疹及皮疹退后明显的脱屑。此病常可继发于严重的咽炎或皮肤软组织感染。
(2)链球菌毒性休克综合征 由产生链球菌毒性休克综合征毒素的A族链球菌引起的以休克为主要症状的感染。可继发于皮肤伤口的感染。此病常伴有呼吸系统及其他多个脏器功能的衰竭。病死率可高达30%。
3.变态反应性疾病
(1)风湿热 常继发于A族链球菌感染的咽炎,潜伏期为1~5周,易感人群为10岁以下儿童。典型的临床症状及体征为发热,不适,游走性、非化脓性、多发性的关节炎以及全心炎(心内膜炎、心肌炎、心包炎)。严重者可导致心瓣膜肥厚、变形。从风湿热患者的上呼吸道中可分离出A族链球菌,但心脏及关节病变部位均未分离出细菌。风湿热可能的发病机制是链球菌菌体表面M抗原及细胞壁中的多糖抗原与心瓣膜及心肌组织存在抗原性的交叉反应,导致机体的免疫病理损伤。
风湿热患者在发病前,常有反复发作的A族链球菌咽炎。初次发作的风湿热,可能导致心脏的轻微损伤,然而反复发作则可加剧心脏的损伤。因此防止A族链球菌的反复感染是防止风湿热的重要环节。
(2)急性肾小球肾炎 风湿热患者仅能从上呼吸道中分离出A族链球菌,而在急性肾小球肾炎患者的上呼吸道及皮肤感染灶中(如脓疱病)均可分离出A族链球菌。目前已证实A族链球菌引起的上呼吸道及皮肤感染均可继发急性肾小球肾炎。从流行病学角度分析两种继发感染存在明显的差异:继发于上呼吸道感染的急性肾小球肾炎发生在一年中寒冷的季节,易感人群多为儿童及青少年;而继发于皮肤感染的急性肾小球肾炎发生在热而潮湿的季节,易感人群可为所有年龄的人。与风湿热不同,感染恢复后急性肾小球肾炎极少复发。
急性肾小球肾炎的典型临床表现为链球菌引起上呼吸道或皮肤感染后3周左右,患者出现血尿、蛋白尿、浮肿、尿素氮滞留、血清补体水平下降。大部分人可康复,少数病例可转变为慢性肾小球肾炎、肾功能衰竭。
急性肾小球肾炎的发病机制尚未完全清楚,推断有两种途径:①链球菌菌体抗原与机体产生的相应抗体形成抗原抗体复合物沉积于肾小球基底膜,激活补体导致肾小球基底膜损伤;②肾小球基底膜成分与A族链球菌膜表面结构有共同的抗原决定簇,导致肾小球基底膜发生免疫病理损伤。
(三)免疫性
感染A族链球菌后,机体可获得对同型链球菌的特异性免疫力。
抗链球菌M蛋白抗体于链球菌感染几周至几个月内即可在血清中测出,在体内可存在1~2年,长者可持续存在10~30年。试验证明抗M蛋白特异性抗体可防止同型链球菌的再次感染。M蛋白能干扰宿主细胞对细菌的吞噬,在M蛋白型特异性抗体存在时,链球菌很快被机体的吞噬细胞杀灭,故抗链球菌感染的免疫力仅对同型细菌有保护作用。根据M蛋白的不同,A族链球菌至少存在60个型,各型间无交叉免疫力。因此,机体可因侵入不同型别的细菌而导致链球菌的反复感染。
链球菌感染后,机体可产生ASO,此抗体虽可阻断溶血素O的溶血现象,但对链球菌的再次感染无保护作用。
四、微生物学检查法
1.标本 根据不同疾病采取不同的标本,如伤口的脓液,咽喉、鼻腔等病灶的棉拭,败血症时取血液等。检测抗体时取血清。
2.直接涂片镜检 脓液标本可直接涂片,革兰染色后镜检。脓液标本镜下观察时,细菌常呈双或以单个形式存在,而不是呈典型的链状。
3.培养 怀疑链球菌感染的标本应在血琼脂平板上培养。培养基中加入10% CO2,常有助于形成典型的溶血现象。A族乙型溶血性链球菌在血平皿上数小时或数天后形成菌落。
4.抗原的检测 目前已有快速检测A族链球菌抗原的试剂盒。采用酶或化学方法从咽拭子中提取链球菌抗原后用酶免疫技术或凝集试验的方法测定细菌抗原。与细菌培养方法相比,此法更快捷。
5.血清学试验 抗链球菌溶血素O试验(ASO test)简称抗O试验,常用于风湿热的辅助诊断。风湿热患者血清中的ASO比正常人显著增高,大多在250单位以上。活动性患者抗体一般超过400单位。
五、防治原则
患者、隐性感染者、恢复期带菌者是A族链球菌感染的传染源。对病人和带菌者应及时治疗,以减少传播机会。空气、器械、敷料等应注意消毒处理。具体的防治原则如下:
1.对A族链球菌引起的呼吸道、皮肤感染应早期诊断,早期治疗,可有效地防止风湿热或急性肾小球肾炎等并发症的发生。青霉素G是治疗的首选药物,剂量要给足。红霉素可作为替补药物。
2.对患风湿热的患者应及时给予药物治疗。每3~4周静脉输入青霉素G,或每日口服青霉素G。对于患过风湿热的儿童,治疗要持续1年左右。这是由于风湿热初次发作,极少引起心脏的严重损伤。而患风湿热的人对A族链球菌极易感,反复发作的风湿热对心脏可造成严重的损伤,导致风湿性心脏病。
3.及时彻底治疗A族链球菌感染所致的急性肾小球肾炎。抗生素对已经形成慢性的肾小球肾炎(或风湿性心脏病)疗效不佳,因此及时、彻底清除急性期感染患者体内的链球菌是十分必要的。足够剂量的青霉素G或红霉素治疗10天,一般可收到良好的效果。
第三节 肺炎链球菌
肺炎链球菌(Streptococcus pneumoniae)简称肺炎球菌(pneumococcus)。为革兰染色阳性,菌体似矛头状,成双或成短链状排列的双球菌,有毒株菌体外有化学成分为多糖的荚膜。5%~10%正常人上呼吸道中携带此菌。有毒株是引起人类疾病的重要病原菌。在化脓性球菌中,肺炎链球菌的致病力仅次于金黄色葡萄球菌。不同的是,到目前为止,肺炎链球菌极少对青霉素类抗生素产生耐药性。肺炎链球菌主要的致病物质是肺炎链球菌溶血素及荚膜。荚膜具有抗原性,是肺炎链球菌分型的依据。此菌可引起大叶性肺炎、脑膜炎、支气管炎等疾病。
一、生物学性状
1.形态与染色 典型的肺炎链球菌为革兰染色阳性球菌,直径约1μm。常呈双排列。有毒株在体内形成荚膜。普通染色时荚膜不着色,表现为菌体周围透明环(图17-3),无鞭毛,不形成芽胞。菌体衰老时,或由于自溶酶(autolysin)的产生将细菌裂解后,可呈现革兰染色阴性。

图17-3 肺炎链球菌
左上为荚膜不着色,右下为扫描电镜图像
2.培养特性 需氧或兼性厌氧。在固体培养基上形成小圆形、隆起、表面光滑、湿润的菌落。培养初期菌落隆起呈穹隆形,随着培养时间延长,细菌产生的自溶酶裂解细菌,使菌落中央凹陷,边缘隆起成“脐状”。肺炎链球菌在血琼脂平板上菌落周围形成α溶血环。培养基中加入5%~10% CO2可促进细菌的生长。奥普托欣(Optochin)可抑制肺炎链球菌生长。
3.生化反应 大多数新分离出的肺炎链球菌可发酵菊糖,故菊糖发酵试验在鉴别肺炎链球菌与甲型溶血性链球菌时有一定的参考价值。
4.抗原构造与分型 荚膜多糖抗原存在于肺炎链球菌荚膜中。根据荚膜多糖抗原性的不同将肺炎链球菌分为84个血清型,其中1~3型致病力强,主要引起人类大叶性肺炎。
5.抵抗力 抵抗力较弱,56℃15~30 min即被杀死。对一般消毒剂敏感。有荚膜株抗干燥力较强。对青霉素、红霉素、林可霉素等敏感。
二、致病性
(一)致病物质
1.荚膜(capsule)是肺炎链球菌主要的致病因素。无荚膜的变异株无毒力,感染实验动物,如鼠、兔等,很快被吞噬细胞吞噬并杀灭。有荚膜的肺炎链球菌可抵抗吞噬细胞的吞噬,有利于细菌在宿主体内定居并繁殖。
2.肺炎链球菌溶血素(pneumolysin)高浓度时对实验动物有致死性。对人的致病机理尚待确定。
3.紫癜形成因子(purpura-producing factor) 注入家兔皮内,可产生紫癜及出血点并伴有内脏出血。紫癜形成因子与人类肺炎链球菌感染间的关系尚不明确。
(二)所致疾病
肺炎链球菌主要引起人类大叶性肺炎。40%~70%的正常人上呼吸道中携带有毒力的肺炎链球菌。由此可见呼吸道黏膜对肺炎链球菌存在很强的自然抵抗力。当出现某种降低这种抵抗功能的因素时,肺炎链球菌可引起感染。①呼吸道功能异常:病毒及其他感染性因子损伤呼吸道黏膜上皮细胞;某些异常因素(如过敏)导致黏液的过度分泌,使侵入的病原菌受到保护;各种原因导致的支气管阻塞及各种原因导致的纤毛功能损伤。②酒精及药物中毒:酒精及某些药物中毒可抑制吞噬细胞的活性及咳嗽反射,有利于病原菌的吸入。③循环系统功能异常及任何原因导致的肺充血、心功能衰竭。④其他:营养缺陷、体质虚弱、贫血、血清补体水平低下等。
肺炎链球菌引起的肺炎常突然发病,表现为高热、寒战、胸膜剧烈疼痛、咳铁锈色痰。10%~20%的患者可于高热期伴发菌血症。其病理表现主要是最初肺泡内有大量纤维蛋白渗出液,继之是红细胞和白细胞向肺泡内渗出,最终导致病变部位肺组织实变。病变通常仅累及单个肺叶,故称为大叶性肺炎。如果早期使用抗生素治疗,可阻止肺实变发生。
肺炎链球菌也可侵入机体其他部位,引起继发性胸膜炎、中耳炎、乳突炎、心内膜炎及化脓性脑膜炎等。
(三)免疫性
肺炎链球菌感染后,机体可建立较牢固的型特异性免疫,同型病菌的再次感染少见。
患者发病后5~6天,体内可形成荚膜多糖型特异性抗体。这种抗体与荚膜结合后,肺炎链球菌易被机体吞噬细胞吞噬杀灭。补体在清除病原菌过程中发挥调理作用,当抗原抗体复合物与补体结合后,可增强吞噬细胞对病原菌的吞噬功能。
三、微生物学检查法
(一)标本
根据感染部位不同采取不同标本,如痰液、脓液、血液、脑脊液等。
(二)直接涂片镜检
痰、脓液及脑脊液沉淀物可做成标本涂片,革兰染色后镜检。如果镜下见到成双排列、有荚膜的革兰阳性球菌,结合临床症状可做出初步诊断。
(三)分离培养
痰或脓液直接接种于血琼脂平板上,37℃孵育24 h后,挑选α溶血的可疑菌落作进一步鉴定。血液及脑脊液先在血清肉汤培养基中增菌后,接种到血琼脂平板上培养并鉴定。
(四)鉴别试验
肺炎链球菌与甲型溶血性链球菌菌落相似,应加以鉴别。常用的试验有以下几种。
1.菊糖发酵试验 大多数新分离出的肺炎链球菌可发酵菊糖,而甲型溶血性链球菌不分解菊糖,故可用于二者的鉴别诊断。
2.胆汁溶菌试验 肺炎链球菌可产生自溶酶。胆汁可激活自溶酶,加速菌体自溶。甲型溶血性链球菌不产生自溶酶,故加人胆汁后菌体不发生溶解。
3.奥普托欣试验(Optochin test)奥普托欣对肺炎链球菌的生长有抑制作用。试验时,将可疑的细菌涂布于血液琼脂平板上,取直径6 mm的无菌滤纸片在1∶2 000 Optochin溶液中浸湿后,置于涂布好菌的平板上。37℃孵育48 h后观察抑菌圈大小。肺炎链球菌的抑菌圈直径在20 mm以上,甲型溶血性链球菌(98%)小于12 mm。
(五)动物试验
小鼠对肺炎链球菌高度敏感。将0.5~1.0 mL标本悬液注射小鼠腹腔,若24 h内小鼠死亡,解剖小鼠,取心脏血或腹腔液分离培养,常可获得肺炎链球菌的纯培养物。
四、防治原则
由于肺炎链球菌对多种抗生素敏感,早期治疗通常患者可很快恢复。青霉素G为首选治疗药物。但目前已发现肺炎链球菌对青霉素、红霉素、四环素的耐药菌株。对青霉素耐药的菌株,对万古霉素依然敏感。
目前国外已采用23个型别肺炎链球菌荚膜多糖多价疫苗预防肺炎链球菌感染。接种后效果良好。该疫苗对儿童、老年人、免疫功能低下人群具有一定的保护作用。
第四节 奈瑟菌属
奈瑟菌属(Neisseria)是一群革兰染色阴性,常成双排列的球菌。此菌属其中脑膜炎奈瑟菌及淋病奈瑟菌是引起人类疾病的病原菌。典型的标本涂片,镜下在中性粒细胞内可见到成双排列的脑膜炎奈瑟菌或淋病奈瑟菌。其他奈瑟菌多为人体呼吸道中寄生的正常菌群。镜下观察时多存在于细胞外。
脑膜炎奈瑟菌与淋病奈瑟菌遗传性上十分接近,DNA序列存在70%的同源性。主要不同点表现为:①脑膜炎奈瑟菌有多糖成分的荚膜,淋病奈瑟菌分离初期有荚膜;②脑膜炎奈瑟菌体内很少有质粒,淋病奈瑟菌可携带几种质粒;③脑膜炎奈瑟菌存在于呼吸道,引起脑膜炎,淋病奈瑟菌引起泌尿生殖系统疾病。
一、淋病奈瑟菌
淋病奈瑟菌简称淋球菌(gonococcus),是我国目前人数最多的性传播疾病——淋病的病原体。淋病奈瑟菌主要侵犯人类泌尿生殖道的黏膜上皮细胞,侵入黏膜下层,引起化脓性炎症。
淋病奈瑟菌形态与脑膜炎奈瑟菌相似。革兰染色阴性,圆形或卵圆形,直径约为0.8μm。常呈双排列,菌体相接触面略凹陷,形似一对咖啡豆。急性淋病患者标本涂片镜下观察时,淋病奈瑟菌多存在于中性粒细胞内,慢性淋病时则多在细胞外。淋病奈瑟菌无鞭毛,但有菌毛,不形成芽胞,分离初期有荚膜。
淋病奈瑟菌的菌毛能增强细菌与易感细胞的黏附作用。实验证明只有有菌毛的淋病奈瑟菌有毒力。
淋病奈瑟菌脂多糖分子结构与人类细胞表面糖鞘脂分子结构相似,这种相似性使淋病奈瑟菌可逃避机体免疫系统的识别。淋病奈瑟菌可产生IgA1蛋白酶,此酶可裂解并灭活黏膜表面存在的特异性IgA1抗体,使细菌黏附于黏膜上皮细胞表面。
人类是淋病奈瑟菌唯一的天然宿主。成人淋病绝大多数是通过性接触感染,故淋病是重要的性传播疾病(sexually transmitted disease,STD)之一。淋病奈瑟菌侵入泌尿生殖道黏膜,产生急性化脓性炎症,进而细菌侵犯组织,形成慢性炎症及组织纤维化。男性感染一般为尿道炎。患者表现为尿道脓性分泌物,排尿时疼痛感。感染还可发展成附睾炎。部分患者病灶纤维化,导致尿道狭窄。女性感染淋病奈瑟菌初始部位为子宫颈内膜,继之可侵犯尿道和阴道。如不能得到控制,感染可继续扩展到输卵管,导致输卵管纤维化、阻塞。患淋病奈瑟菌性输卵管炎的女性患者中,有20%的病例可导致不育。
感染淋病奈瑟菌的孕妇在分娩时,胎儿通过产妇产道可被感染,引起新生儿淋病奈瑟菌性结膜炎,有大量脓性分泌物排出,称为“脓漏眼”。
人类对淋病奈瑟菌普遍易感。感染后机体可产生特异性IgM、IgG和分泌型IgA抗体。但由于淋病奈瑟菌抗原易变异,反复感染的现象普遍。
微生物学检查可采取泌尿生殖道脓性分泌物作标本,如标本制成涂片后,革兰染色镜检,观察到中性粒细胞内大量成双排列的革兰阴性球菌时,具有诊断意义;也可将采集标本保湿保温,尽快划线接种于巧克力色血液琼脂平板上,在5%~10% CO2环境中孵育24~48 h,挑选可疑菌落进一步鉴定。应用多克隆或单克隆抗体直接检测标本中淋病奈瑟菌抗原,或用PCR技术检测淋病奈瑟菌特异的核酸序列等方法亦广泛采用。
淋病是一种性传播性疾病。预防淋病应取缔娼妓、防止不正当的两性关系。
防止新生儿感染淋病奈瑟菌,原始的方法是采用1%硝酸银滴入两眼。硝酸银对眼结膜有刺激作用,储存较困难。因此,目前常用红霉素或四环素眼药膏等替代硝酸银。
对患者应早期用药,彻底治疗。1976年发现产生青霉素酶的淋病奈瑟菌菌株,现在淋病奈瑟菌普遍耐青霉素族抗生素,治疗时应加大青霉素的用量及采用新型青霉素族抗生素。
二、脑膜炎奈瑟菌
脑膜炎奈瑟菌(N.meningitidis)是流行性脑脊髓膜炎(简称流脑)的病原菌。
脑膜炎奈瑟菌为革兰染色阴性,常呈双排列,直径约为0.8μm的双球菌。单个菌体呈肾形。成双排列时,两个凹面相对。无鞭毛,不形成芽胞。有菌毛,新分离菌株有荚膜。专性需氧,营养要求高。最常用的培养基是巧克力色培养基,即将血液加热80℃后制成的血琼脂培养基。初次分离培养时,还需提供5%~10%的CO2气体。一般培养48 h后,脑膜炎奈瑟菌在培养基上形成圆形隆起,表面有光泽,透明或半透明,直径约1~5 mm的露滴样菌落。无色素形成。血平皿上无溶血现象。
根据荚膜多糖抗原(capsular polysaccharides antigen)不同,可将脑膜炎奈瑟菌分为至少13个血清群。与人类疾病关系密切的主要是A、B、C、Y及W-135群。A群及C群是引起脑膜炎流行的主要血清群。
脑膜炎奈瑟菌对外界环境的抵抗力弱。干燥、阳光、湿热及一般消毒剂很快将细菌杀死。本菌可产生自溶酶。体外25℃,碱性环境中很快导致菌体肿胀,裂解死亡。
脑膜炎奈瑟菌荚膜可抵抗宿主体内吞噬细胞的吞噬作用,增强细菌对机体的侵袭力。其菌毛可介导细菌黏附在宿主易感细胞表面,有利于细菌在宿主体内定居、繁殖。
内毒素是脑膜炎奈瑟菌的主要致病物质。内毒素作用于小血管或毛细血管,引起血栓、出血,表现为皮肤出血性淤斑;作用于肾上腺,导致肾上腺出血。大量内毒素可引起弥散性血管内凝血(disseminated intravascular coagulation,DIC),导致休克,预后不良。
人类是脑膜炎奈瑟菌唯一的易感宿主。细菌由鼻咽部侵入机体,依靠菌毛的作用黏附于鼻咽部黏膜上皮细胞表面。多数人感染后表现为带菌状态或隐性感染,细菌仅在体内短暂停留后被机体清除。只有少数人发展成脑膜炎。我国引起脑膜炎的主要是A群菌,B群常为带菌状态。
脑膜炎奈瑟菌感染的发病过程可分为三个阶段:①病原菌首先由鼻咽部侵入,依靠菌毛吸附在鼻咽部黏膜上皮细胞表面,引起局部感染;②随后细菌侵入血流,引起菌血症,伴随恶寒、发热、呕吐、皮肤出血性淤斑等症状;③侵入血流的细菌大量繁殖,由血液及淋巴液到达脑脊髓膜,引起脑脊髓膜化脓性炎症。患者出现高热、头痛、喷射性呕吐、颈项强直等脑膜刺激症状。严重者可导致DIC,循环系统功能衰竭,于发病后数小时内进入昏迷。病理改变表现为脑膜急性化脓性炎症伴随血管栓塞,白细胞渗出。
机体对脑膜炎奈瑟菌感染的免疫力主要依赖于体液免疫。显性感染、隐性感染或疫苗接种2周后,血清中群特异性IgG、IgM和IgA抗体水平明显升高。分泌型IgA抗体可阻止脑膜炎奈瑟菌侵袭呼吸道黏膜上皮细胞;血清IgG及IgM抗体在补体的参与下有杀死病原菌的作用;血清抗体在补体的参与下可增强吞噬细胞对病原菌的吞噬与杀灭。6个月内的婴儿可通过母体获得IgG抗体,产生自然被动免疫,故很少发生感染。6个月后,来自母体的抗体水平逐渐下降,婴儿对疾病的易感性逐渐增强,故6个月~2岁年龄组婴儿免疫力最低,是脑膜炎奈瑟菌的易感人群。
微生物检查的标本可取患者脑脊液,刺破皮肤出血淤斑取渗出物、血液、带菌者鼻咽拭子等。
脑脊液离心沉淀后,取沉淀物涂片,革兰染色后镜检。消毒患者皮肤出血淤斑处皮肤后,用无菌针头挑破淤斑取渗出物制成涂片,革兰染色后镜检。若在镜下见到中性粒细胞内、外有革兰染色阴性双球菌时,即可作出初步诊断。
血液与脑脊液标本在血清肉汤培养基中增菌后,接种到巧克力色血琼脂平板上,置于含5%~10% CO2的环境中孵育。挑取可疑菌落涂片镜检,并作生化反应及群型特异性多价血清的凝集试验鉴定。
快速诊断法是依据脑膜炎患者脑脊液及血清中存在脑膜炎奈瑟菌可溶性抗原。据此用已知的抗体检测有无相应的抗原。常用对流免疫电泳和SPA协同凝集试验。
预防脑膜炎奈瑟菌感染的关键是要尽快消除传染源、切断传播途径及提高人群免疫力。我国1980年正式使用A群多糖菌苗,临床观察表明对学龄儿童和成人保护率可达90%。但此种疫苗对2岁以下婴幼儿免疫原性差:其一是因为脑膜炎荚膜多糖抗原属于T细胞非依赖抗原,免疫效果与接种者年龄有明显的依赖关系;其二,多糖菌苗诱导机体产生的以抗体主要为IgG2亚类,出现较迟,一般到8~12岁才能上升至成人水平。因此,婴幼儿接种多糖菌苗后往往以产生短暂的IgM抗体为主。国外采用A群和C群多糖与白喉毒素蛋白偶联的偶联菌苗接种8~10周龄的婴儿,证明这种偶联菌苗具有良好的免疫原性及安全性。
流脑的治疗首选药物为青霉素G,剂量要大。对青霉素过敏者,可用氯霉素或红霉素。
(黄德海)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















